日本结缕草体细胞变异表型和分子标记的研究
2012-12-24包满珠
刘 莉,包满珠
(1.华中农业大学园艺林学学院 园艺植物生物学教育部重点实验室,湖北 武汉430070;2.华中农业大学楚天学院,湖北 武汉430205)
日本结缕草(Zoysiajaponica)又称为结缕草,禾本科虎尾草亚科结缕草属,自然分布于亚洲东部环日本海、渤海、黄海及东海沿岸,广泛分布于我国东部、朝鲜半岛和日本列岛温暖地带[1]。结缕草低矮、坚韧耐磨、耐践踏、弹性好,具有发达的地下根茎,耐粗放管理,在园林、庭园和固土方面都有广泛运用,是草坪植物中适应性强的一个暖季型草种[2]。
我国结缕草种质资源极为丰富,位居世界各国之首[1,3-5]。但结缕草的应用处于较低水平,如掠青采种,品种单一,尤其自主产权新品种匮乏。因此,资源创新是利用结缕草资源的当务之急。传统育种效率低下,具有较多困难,如有性杂交、花期不遇、小穗上的小花太小不便操作等[6]。因而,借助新型的分子生物学育种手段可有效地加快育种的步伐。
体细胞变异以其变异广泛、遗传复杂、可以保持品种的基本特性而成为获得较多新种质的一个捷径,是新品种选育和生理研究的一种重要方法。狗牙根(Cynodondactylon)、结缕草和假俭草(Eremochloaophiuroides)通过体细胞变异育种已经获得一些新品系[7-13]。日本结缕草的组织培养研究已经比较成熟,而且由种子诱导的愈伤可以长期继代并获得了较高的再生频率[14-15]。结缕草自然分布区生态环境差异很大,是一种能适应多种生境的广生态幅植物[1],利用分子标记检测同样发现变异较大[16],具有容易发生遗传变异的特性。因此,组织培养是获得体细胞变异的一种良好方法。
变异的方向及遗传稳定性是变异能否可利用的关键。鉴定体细胞变异一个通用、便捷的方法是表型的变异结合分子标记遗传稳定性的双重鉴定方法。日本结缕草的分子标记方法已经发展很快,但由于ISSR标记法有较好的稳定性及简便性而成为本研究的首选方法。本研究以1粒日本结缕草种子诱导的愈伤继代18个月后的再生植株为材料,在大田经过小区种植,利用ISSR标记检测再生单株的DNA序列多态性,以期探讨结缕草愈伤长期继代再生植株的变异特点,并运用于育种及其他研究中。
1 材料与方法
1.1 材料 从青岛海源草坪有限公司购买的日本结缕草种子,通过组织培养[17],诱导愈伤,其中1粒种子诱导出愈伤,经增殖扩繁继代18个月后再生得到植株,种植于花盆中。随机选取20棵单株,种植于小区中,设定3个重复,每个小区0.5m×0.5m,统一管理,水肥一致。
1.2 方法
1.2.1 表型性状观测 草层高度:指自然高度,重复3次;叶片长度和宽度:随机抽取直立茎的顶部向下第2片成熟叶片5片,测定其长度和宽度;匍匐茎叶片长度和宽度:随机取5片匍匐茎顶端下第2、3节成熟叶片测定其长度和宽度;匍匐茎的长度和数量,匍匐茎在相同生长时间(一个生长季)的蔓延长度和数量;生殖枝高度:指从地表到总状花穗基部的自然高度,重复5次;穗长度:指花序的基本长度,重复10次;绿色期:以播种的草坪为对照,50%叶片枯黄视为失去观赏性[18]。
1.2.2 总DNA的提取 采用CTAB方法[19],提取新鲜幼嫩叶片总DNA,用紫外分光光度计检测DNA纯度和浓度后置于-20℃下备用。
1.2.3 ISSR标记分析 ISSR体系和PCR程序经反复试验,选择重复性好的反应体系和程序:1×Buffer,2.0mmol·L-1Mg2+,0.2mmol·L-1dNTP,1Utaq(Fermentas,深圳晶美生物工程公司购买),模板DNA 10ng,0.5μmol·L-1引物,加入重蒸水到20μL。PCR程序:94℃预变性4min,然后5个循环,退火温度从60℃梯度降温至56℃,一个循环降1℃,即94℃30s,60℃45s循环到94℃30s,56℃45s,72℃90s,后退火温度在55℃时进行33个循环(个别30个循环);最后72℃延伸10min,4℃保存[20]。反应在BIO-RAD的PTC-100TMPCR仪上进行。
从实验室已有的40条ISSR引物中筛选多态性好、重复性好的引物6条(表1)。
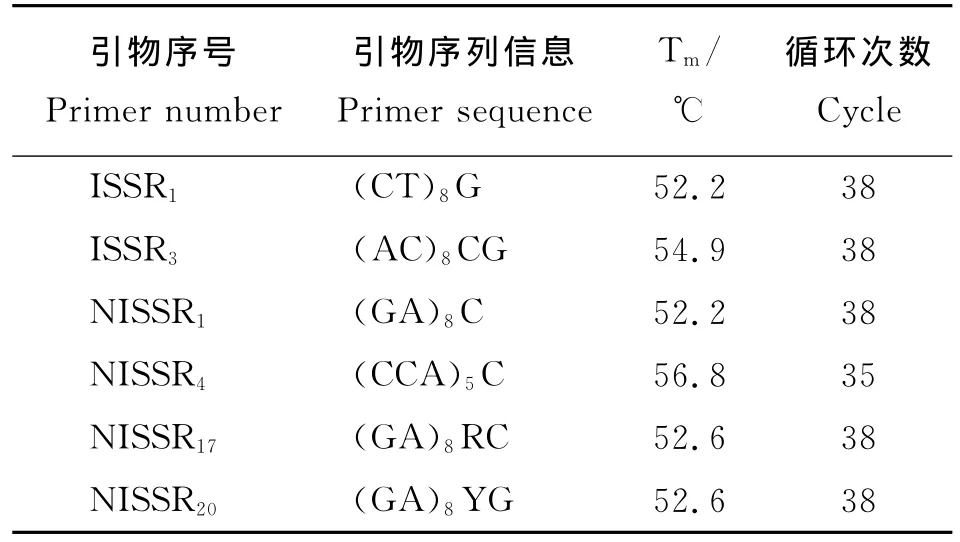
表1 文中ISSR引物信息Table 1 ISSR primers used in this study
1.3 数据处理方法 表型性状于2005年生长季测定,表型性状中数量性状取测量平均值,并利用SPSS 13.0对20个样品做主成分分析,并将这些数据标准化后用NTSYS软件计算遗传距离,利用UPGMA进行聚类分析。PCR扩增产物电泳后在凝胶上具有相同迁移率的位置上有DNA条带的记为1,无DNA条带的记为0。记录的ISSR的表型数据矩阵利用NTSYS软件以Nei’s遗传距离做UPGMA聚类分析,并将表型数据与ISSR表型数据进行相关性分析。
2 结果与分析
2.1 主成分分析各指标之间的关系 通过主成分分析得到各主成分特征值的大小,前5个主成分累计所占的比例为88.40%,可以代表整体(表2)。特征向量分析显示各主成分权重没有占较大优势,前5个主成分权重比较平均。第1主成分与直立茎草层高度、直立茎叶片长度和直立茎叶片宽度具有较高相关性,代表直立茎的表型;第2主成分主要表型指标依次是匍匐茎的总长度、生殖枝高度和匍匐茎数量,主要是匍匐茎的蔓延能力和生殖枝高度;第3主成分的主要指标为穗长及匍匐茎叶片长宽度;第4主成分主要指标是绿色期;第5主成分中匍匐茎叶片长度,穗长和直立茎草层高度为主要指标(表3)。根据各表型在主成分分析中前5个主成分的权重,可以确定能代表变异的重要表型性状:直立茎、匍匐茎的叶片宽度和长度,生殖枝的高度和穗长及绿色期。其中绿色期仅与生殖枝高度相关性相对较高,相关系数为0.34(表4),说明日本结缕草绿色期的表现与生殖器官和表型较营养器官的表型更大。
根据代表整体的前5个主成分的主要表型指标以及各表型指标间的相关系数,10个性状中可剔除直立茎叶片长度和匍匐茎总长度这两个分别与直立草层高度和直立茎叶片长度的相关性极高的指标(表4)。将优选出来的8个表型指标的聚类分析与全部表型指标的聚类分析进行比较,将两种聚类结果做相关性分析,得出相关系数为r=0.94,P=1.000 0,说明优选出来的8个表型完全可以代表整体。
2.2 利用变异系数分析结缕草表型变异 依据表型数据计算变异系数,发现在这些表型性状中最大的是匍匐茎的长度,为57.1%;较小的是匍匐茎叶片宽度,为6.9%(表5)。可见,在调查的这些性状中,匍匐茎和绿色期的变异较大,叶片的长宽变异较小。
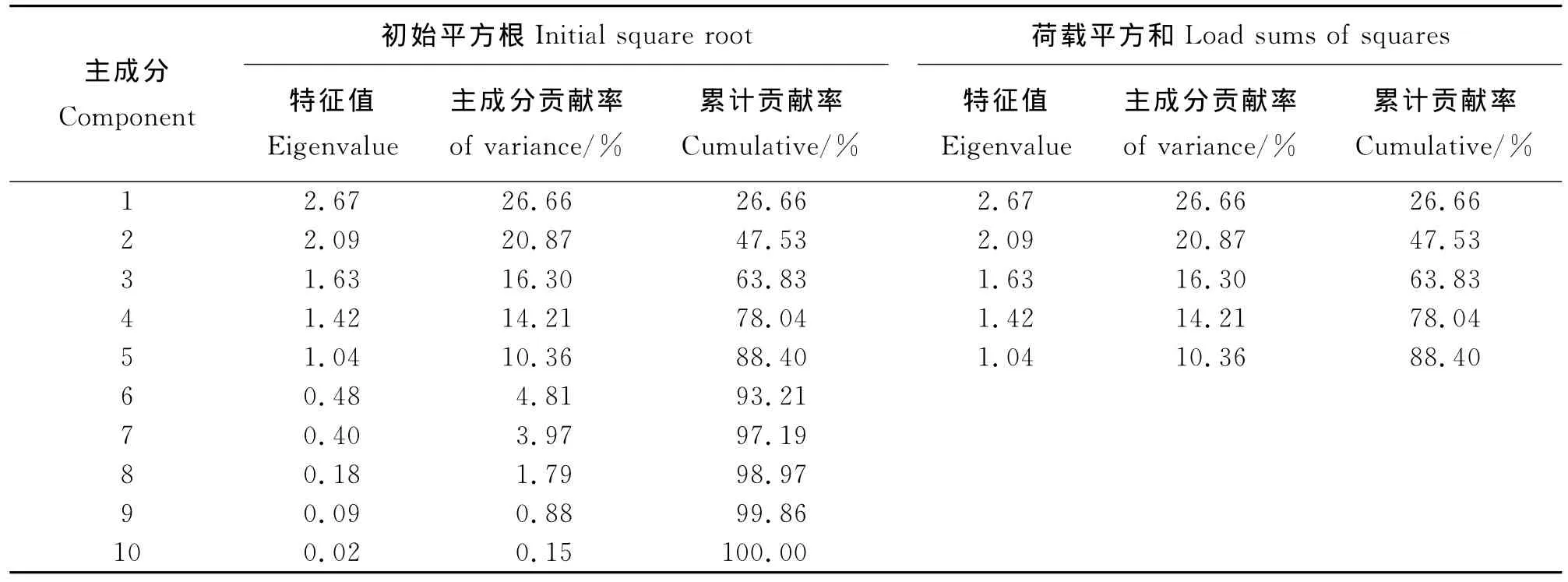
表2 表型主成分分析总方差分析Table 2 Total variance analysis of different phenotype principal component analysis
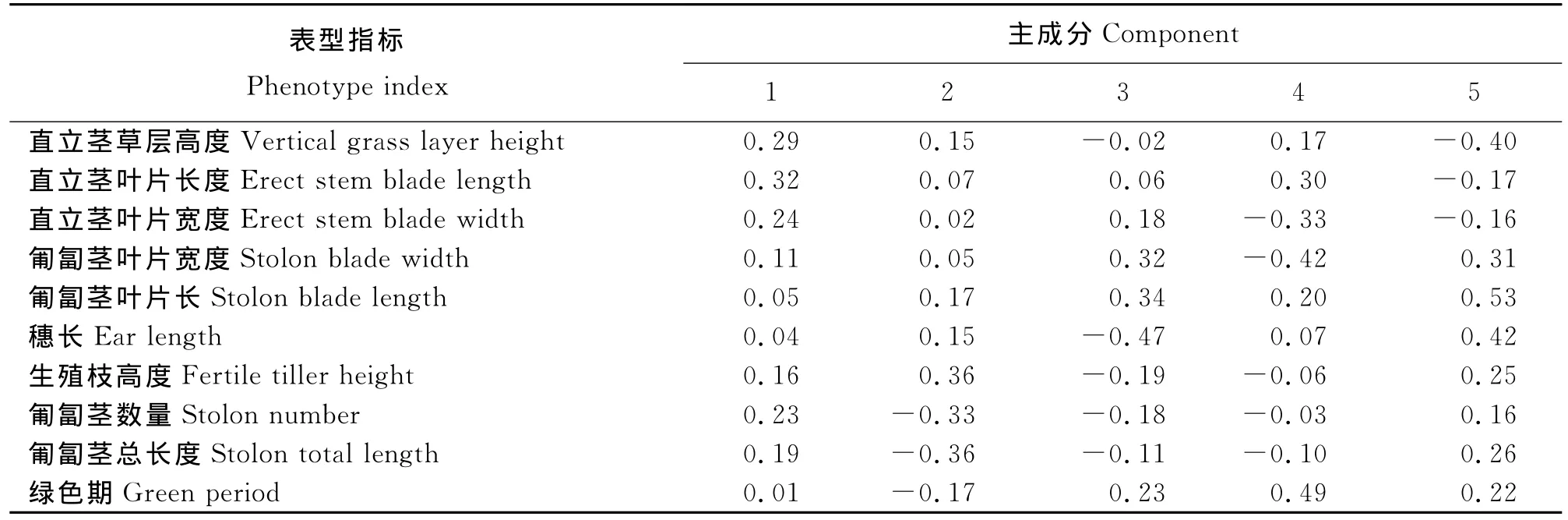
表3 各表型在各主成分的载荷系数Table 3 Load factor of each phenotype in each principal component

表4 各表型性状相关系数矩阵Table 4 Correlation coefficient matrix of Zoysia japonica phenotypes
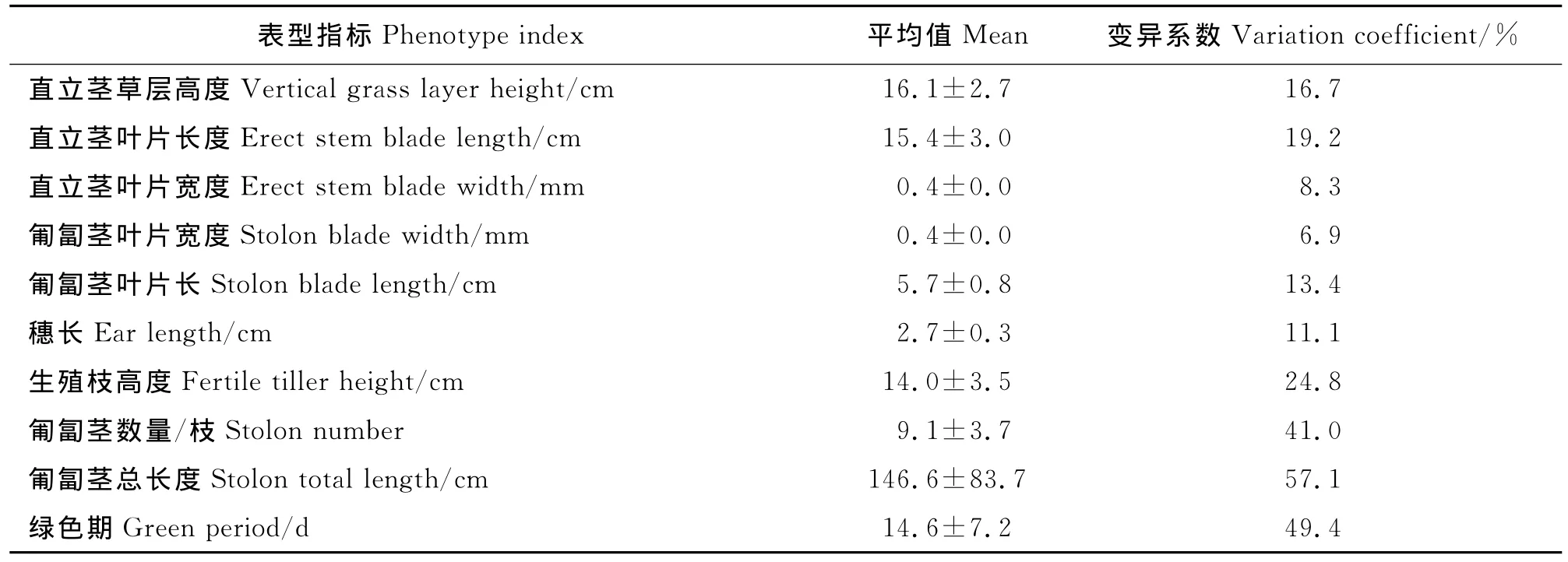
表5 表型指标变异系数分析Table 5 Variation coefficients of phenotype data

表6日本结缕草ISSR引物扩增条带多样性及特异性Table 6 Polymorphism and specificity of ISSR marker amplified Bands
2.3 利用ISSR分析日本结缕草体细胞变异ISSR检测中,6条ISSR引物扩增出73条带,其中多样性条带比例为83.6%,有5条引物多样性条带比例超过80%,适合对日本结缕草进行多态性检测;单个样品的特异带比例为15.1%(表6)。引物ISSR1、NSSR1和NSSR17检测出单个样品具有的特异性条带(表6)。由于所有样品植株来源于同一个种子的愈伤,具有相同遗传背景,这种特异带的检测具有较大的研究意义。
3 讨论
3.1 结缕草体细胞变异的原因分析 植物体细胞无性系变异产生的影响因素有很多,这些因素有生理状态、外植体类型、物种和基因型,再生发生方式,培养基中一些成分如植物生长调节剂和氮素含量以及继代培养的时间。变异频率因因素不同而异。一般来讲,在长期继代培养中,体细胞变异易发生[21-22],且变异频率相对较高。
经过研究发现自然界内的结缕草种内变异现象十分明显[1,16]。宣继平等[23]通过ISSR 标记对野生结缕草属的遗传多样性进行分析,结果显示57.4%的遗传变异存在于种内。利用流式细胞仪对结缕草属植物检测2C核酸的含量,Brian等[24]发现结缕草属植物有较小的基因组,因而在形态学、生长习性、生物与非生物胁迫的反应上存在极端差异。这些发现都揭示结缕草变异是结缕草种的特性决定的。在日本结缕草种子诱导愈伤组织及愈伤长期继代中都加入较高浓度的2,4-D,是促进变异的另一个因素[25]。长期继代培养使愈伤组织处于旺盛的生长状态,细胞不停的分裂,核酸不停的复制。频繁的有丝分裂让错误的频率在短时间内累计,是造成体细胞变异的又一个原因。
3.2 日本结缕草体细胞变异特征分析 本研究显示,日本结缕草的体细胞变异中,匍匐茎的数量和长度、绿色期在体细胞变异中较大。绿色期和草坪草的扩张能力是草坪草质量评价的重要指标,单位时间内能发展较多的匍匐茎数量和长度也意味着更强的覆盖能力,减少杂草的入侵,对于生长速度偏慢和绿色期偏短的结缕草来说匍匐茎的数量和长度这一变异十分重要。变异分析结果预示,有可能通过体细胞变异筛选到绿色期长、匍匐茎发达的优异变异单株。但是叶片宽度变异系数相对较小,说明通过体细胞变异来改变叶片宽度相对困难。
自然界中,结缕草的变异同样非常丰富,具有广泛的地域适应性和丰富的生态型。中国结缕草居群形态变异的研究指出匍匐茎长度是居群表型差异的主要性状之一[26]。宣继平和刘建秀[27]对64份中国野生结缕草生长速度的研究表明,日本结缕草的种内匍匐茎总长度变异最大,变异系数为85.4%。绿色期的研究报道相对较少。Yaneshita等[28]在构建RFLP遗传图谱的基础上,对冬季叶色数量性状基因(Quantitative Trait Locus,QTL)定位,找到了4个与冬季叶色相关的基因位点,并显示绿色期由主效基因控制,同时体细胞变异特点为点突变较多,因而这也可以解释本研究中为何体细胞变异中绿色期变化较大。
体细胞变异与结缕草野生资源有相似之处。对日本结缕草体细胞变异和野生资源叶片性状变异系数进行比较,匍匐茎叶宽变异系数分别为6.9%和15.8%,匍匐茎叶长变异系数分别为13.4%和27.5%,体细胞变异系数低于野生资源的变异。这与体细胞变异本身的特点有关,在分子水平上表现为点突变较多,简单的质量性状的变异相对可能多一些。体细胞变异的表型中,在绿色期和匍匐茎叶片长和宽表现出比自然条件下更大范围的变异,因而具有较高的研究价值。
日本结缕草体细胞变异较大,通过目的性胁迫,诱导筛选优质抗逆性的草坪草植株,是培育育种中间材料或优良品系的方法。在基因型相同的愈伤组织中遗传背景相同的表型变异,是研究表型分子机理的优良材料。同时,其他方式,如射线、化学诱变剂等增加变异的概率的方法,也可以获得更多的供筛选和利用变异。Schwartz等[29]对不同性状遗传力做了研究,结果发现,结缕草草坪性状除了冬季冬眠和返青,其他性状都具有较高的广义遗传力,性状表现受环境影响较小,预示可将多种优良变异的性状合并在一起遗传给F1代,这个研究结果使育种工作中获得结缕草变异变得更有意义。
[1]董厚德,宫莉君.中国结缕草生态学及其资源开发与应用[M].北京:中国林业出版社,2001:3,36.
[2]韩烈保,杨碚,邓菊芬,等.草坪草种及其品种[M].北京:中国林业出版社,1999:155.
[3]翁仁宪,林正斌,许福星.结缕草品系扩张速率之研究[J].台湾杂草学会会刊,1998,19:63-72.
[4]Weng J H,Chen Y C.Variation of salinity tolerance inZoysiaclones collected from different habitats in Taiwan[J].Plant Production Science,2001,4(4):313-316.
[5]谭志坚,刘清益.结缕草属草坪草在中国的名称与应用[J].四川草原,2001(1):40-42.
[6]Tsuruta S,Kobayashi M,Ebina M.Zoysia[A].Kole C.Wild Crop Relatives:Genomic and Breeding Resources,Millets and Grasses[M].Berlin Heidelberg:Springer-Verlag,2011:297-309.
[7]卢少云,郭振飞,陈永传.狗牙根的组织培养及其矮化变异体研究初报[J].园艺学报,2003,30(4):48.
[8]樊晓莉,包满珠.组织培养获得日本结缕草绿色期延长的株系[J].园艺学报,2005,32:467.
[9]梁小红,韩烈保,齐春辉.结缕草耐盐变异体的筛选[J].四川草原,2005(8):18-20.
[10]刘明稀,卢少云,郭振飞.假俭草抗旱变异体的筛选及其生理鉴定[J].草业学报,2012,21(1):126-132.
[11]袁学军,王志勇,郑轶琦,等.假俭草体细胞抗寒突变体的获得及其SRAP分子鉴定[J].草业学报,2011,20(6):237-244.
[12]李培英,孙宗玖,阿不来提.偃麦草种质资源外部性状变异及其形态类型的初步研究[J].草业科学,2010,27(1):71-78.
[13]梁绪振,鄢家俊,白史且,等.斑茅种质资源形态性状的变异研究[J].草业科学,2011,28(7):1307-1314.
[14]张俊卫,唐蜻,包满珠.日本结缕草植株再生体系的研究[J].草业学报,2005,24(2):48-51.
[15]Liu L,Fan X L,Zhang J W,etal.Long-term culturedcallus and the effect factor of high-frequency plantlet regeneration and somatic embryogenesis maintenance inZoysiajaponica[J].In Vitro Cellular & Developmental Biology-Plant,2009,46:673-680.
[16]Weng J H,Fan M J,Lin Y H,etal.Genetic variation ofZoysiaas revealed by Random Amplified Polymorphic DNA (RAPD)and isozyme pattern[J].Plant Production Science,2007,10:80-85.
[17]樊晓莉.日本结缕草植株再生体系优化及根癌农杆菌介导的遗传转化的初步[D].武汉:华中农业大学,2005.
[18]刘建秀,郭爱桂,郭海林.中华结缕草种质资源形态变异及其形态类型[J].草地学报,2003,11(3):189-196.
[19]王关林,方宏筠.植物基因工程[M].北京:科学出版社 ,2002:744.
[20]刘莉.日本结缕草IPT基因遗传转化及野牛草实生群体内遗传多样性研究[D].武汉:华中农业大学,2010:45.
[21]Borchert T,Fuchs J,Winkelmann T,etal.Variable DNA content ofCyclamenpersicumregenerated via somatic embryogenesis:Rethinking the concept of long-term callus and suspension cultures[J].Plant Cell Tissue and Organ Culture,2007,90(3):255-263.
[22]Sangthong R,Mii M,Soonthornchainaksaeng P,etal.Characteristics of the tetraploid plant derived as a so-maclonal variation inLiliumlongiflorum[J].Acta Horticulturae,2005,673:167-174.
[23]宣继萍,周志芳,刘建秀.结缕草属植物种间关系的SSR分析[J].西北植物学报,2008,28(2):249-255.
[24]Brian M,Schwartz,Kevin E,etal.Variation in 2Cnuclear DNA content ofZoysiaspp.as determined by flow cytometry[J].Crop Science,2010,50:1519-1525.
[25]LoSchiavo F,Pitto L,Giuliano G,etal.DNA methylation of embryogenic carrot cell cultures and its variations as caused by mutation,differentiation,hormones and hypomethylating drugs[J].Theoretical and Applied Genetics,1989,77:325-331.
[26]金洪,韩烈保,张永明.中国结缕草居群形态变异分析[J].中国草地,2004,26:50-56.
[27]宣继萍,刘建秀.中国结缕草属植物的生长速度研究[J].草业科学,2007,24:98-100.
[28]Yaneshita M,Kaneko S,Sasakuma T.Genetic analysis of the winter leaf colour ofZoysiaspp.facilitated by molecular markers[J].International Turf Grass Society Research Journal,1997,8:401-408.
[29]Schwartz B M,Kenworthy K E,Engelke M C.Heritability estimates for turfgrass performance and stress response inZoysiaspp[J].Crop Science,2009,49:2113-2118.
