液相色谱梯度洗脱法检测石蒜组织中4种内源激素的方法
2012-12-24付晓陆汪少敏
付晓陆,汪少敏,徐 敏
(1.浙江省余姚市农技总站 农产品质量检测站,浙江 余姚 315400;2.杭州植物园,浙江 杭州 310000)
石蒜属 (Lycoris Herb)植物是著名球根花卉,被誉为中国郁金香。近年来,在城市道路绿化改造以及花园景点绿化改造提升中对石蒜的需求越来越多,但石蒜自然繁殖率低满足不了市场需求,需通过组培快繁才能在短期内达到规模化的种苗,而这需要测定石蒜组织中各激素的动态变化为前提[1]。
植物的内源激素与植物生长发育的基本规律和代谢过程的调节控制都密切相关,因此植物内源激素的准确测定,对植物生命活动和作物遗传育种栽培领域的研究具有重要的意义。植物内源激素的检测主要有气相色谱法[2]、酶联免疫法[3]、放射免疫法[4]和高效液相色谱法 (HPLC)[5-6]等。相对而言,HPLC法具有灵敏度高、专一性强和重复性好等特点,但HPLC定量分析要求上机检测的样品有相当高的纯度,要求必须有适当的前处理方法,否则会直接影响HPLC法的测定结果。不同植物材料的组分差异甚大,因而尚无一种通用的植物材料前处理方法。石蒜球茎中富含多酚类和赤霉素类似物等杂质,如果前处理方法不当,上机检测的样品杂质含量过高,难以对目标组分进行有效的分离,造成定量困难,达不到检测的目的。本方法是在总结前人研究的基础上,结合石蒜组织组成的基本特点,经过实验不断改进总结,能满足石蒜中IAA、ABA、ZT和GA3等4种植物内源激素的分析的要求,方法具有定量准确、能适应复杂基质干扰等特点。
1 材料和方法
1.1 材料试剂
用于本方法研究的石蒜由杭州植物园提供;内源激素标准品均购自SIGMA公司;聚乙烯吡咯烷酮 (PVP)(国药集团试剂公司);二乙基二硫代氨基甲酸 (国药集团试剂公司)。
1.2 仪器和设备
本实验采用的仪器为Waters2695/2478高效液相色谱系统,EMPOWER数据处理软件;TDL-5-A高速离心机 (上海安亭科学仪器厂);DELTA320 pH计 (梅特勒公司);KL512J氮吹仪 (北京康林科技有限责任公司)。
1.3 色谱条件
色谱柱为Dikma DIAMONDSIL C18 250 mm×4.6 mm不锈钢柱;二元流动相,其中流动相A为甲醇,流动相B为0.8%乙酸水溶液;采用双波长检测,检测波长分别为260 nm和210 nm;色谱柱温40℃,采用梯度洗脱,洗脱梯度条件见表1。
1.4 样品前处理方法
石蒜组织中植物内源激素提取和制备方法按以下操作流程进行:称量切碎的石蒜样品5.0 g于研钵中,加入液氮研磨至粉末,加入80%的冷甲醇和30 mg·mL-1抗氧化剂 (二乙基二硫代氨基甲酸)50 μL,在0~4℃的冰箱里放置过夜,将样品和溶液转入离心管,用10 mL甲醇洗涤研钵2次,于5 000 r·min-1离心,去掉残渣取上清液,40℃氮吹至水相,将水相 pH调至6.4,加入0.5 g PVP,超声30 min后于5 000 r·min-1离心,上清液pH调至2.9,用30 mL的乙酸乙酯萃取3次,合并酯相,40℃用氮吹仪吹干,用流动相溶解定容至2 mL,经0.45 nm微孔滤膜过滤,上机检测。
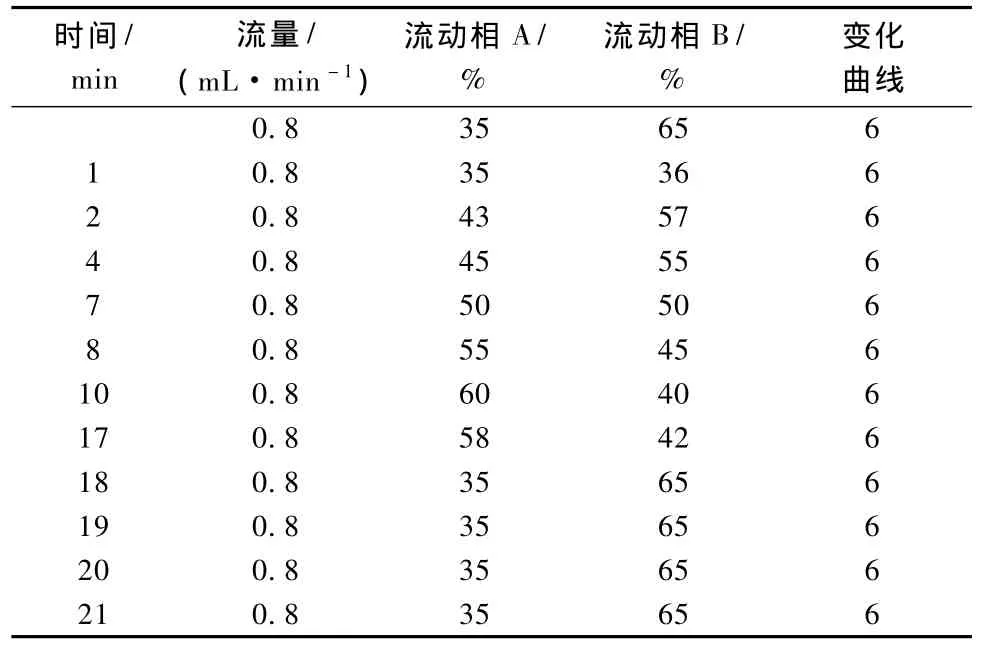
表1 梯度洗脱流量和流动相比率变化
2 结果与分析
2.1 4种内源激素混合标样分离谱图
由图1可见,各目标组分分离度较好,峰形对称,响应值在合适范围内,IAA的保留时间为10.60 min,AB的保留时间为12.5 min,GA3的保留时间为6.53 min,ZT的保留时间为3.5 min。
2.2 石蒜组织中4种内源激素测定图谱
经过前处理的样品,按设定的色谱条件进样20 μL进行检测,其谱图如图2。
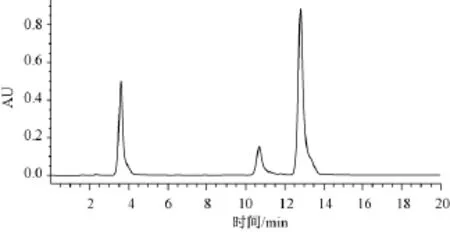
图1 4种内源激素混合标准溶液的色谱图
从图2可见,经过样品前处理后的样品杂质比较少,各组分的分离比较理想,可用于准确定量分析。
2.3 方法回收率实验
通过在捣碎石蒜样品中添加4种内源激素标样,经过1.4样品前处理过程,同时做样品空白,通过检测添加组分的含量,如添加量的比较,计算样品的回收率,回收率结果详见表2。

表2 样品添加的回收率
从表2可知,回收率能达到了植物内源激素分析测定所要求。其中ZT的回收率偏低,这与其较易分解有关,而GA3回收率较高,可能是由于石蒜中类似物干扰造成。
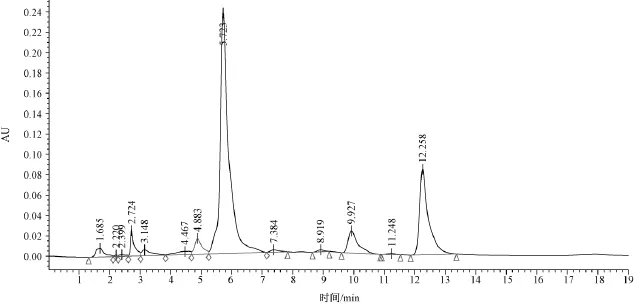
图2 石蒜组织中4种内源激素测定图谱
3 小结和讨论
由于植物样品中富含多酚类、色素类、糖类等复杂基质造成定性和定量分析较为困难,石蒜中虽然不含色素,但含有多酚类和粘度较大的粘性物质,同时还存在许多与赤霉素类物质相近的杂质,给用HPLC法进行多种植物内源激素的分析带来困难,对样品前处理提出了比较高的要求。
样品前处理的关键是尽可能地去除干扰杂质但又保证检测目标的内源激素有较高回收率。通过适当加入了不溶性聚乙烯吡咯烷酮,尽可能减少样品的损失和处理步骤。PVP是一种可通过氢键吸附多酚类和色素类杂质的物质,不溶性的PVP可通过搅拌和高速离心使被测物与吸附有杂质的PVP成功分开。Glenn等[7]采用PVP柱去除杂质,陈昆松等[8]采用抽滤方法去杂。本研究改为用高速离心法既可节约时间,又可同时进行多样品的处理,而又不降低内源激素回收率。
仪器的检测条件在已有文献基础上进行改进[9-10]。由于4种植物内源激素的最大吸收波长不同,其中IAA、ABA、ZT和 GA3的最大吸收波长分别为254,260,270和210 nm,由于相差比较远,特别是GA3的吸收波长靠近石英玻璃和流动相中甲醇的吸收波长,所以单一波长检测难以兼顾,必须选择两波长或多波长进行检测。由于前3种目标物最大吸收波长比较接近,取其中间最大吸收波长260作为检测波长,对GA3则采取其最大吸收波长210 nm单独检测。
本研究建立了可满足石蒜中4种植物内源激素同时测定的样品前处理方法和HPLC色谱检测条件,实验重演性好、回收率较高,而且相对现有的其他HPLC分析方法,本方法的操作时间大为缩短。
[1] 鲍淳松,朱春艳,张海珍,等.施肥对长筒石蒜生长的效应研究 [J].浙江农业科学,2009(6):1092-1095.
[2] 李玲,付种,郭绍川.温度胁迫下杂交稻幼苗内源ABA含量和电解质渗透率变化 [J].植物生理学通讯,1994,30(2):103-105.
[3] 李宗霆,周燮.植物激素及其免疫检测技术 [M].南京:江苏科学技术出版社,1996.
[4] 李春俭.可扩散型吲哚乙酸的测定 [J].植物生理学通讯,1996,32(2):132-134.
[5] 谢君.高效液相色谱测定多种植物内源激素分析方法[J].四川农业大学学报,1997,15(3):297-299.
[6] 陈建华,曹阳,李昌珠,等.板栗内源激素的高效液相色谱测定方法 [J].中南林学院学报,2004,5(24);40-42.
[7] Glenn J L,Kuo C C,Durley R C,et a1.Use of insoluble polyvinylpyrrolidone for purification ofplant extracts and chromatography of plant hormones[J]. Phytochem,1972(11):345-351.
[8] 陈昆松,徐昌杰,李方,等.HPLC法检测果实组织中内源IAA、ABA方法的改进 [J],果树学报,2003,20(1):4-7.
[9] 于玉梅,刘春香,朱妍妍,等.高效液相色谱法在黄瓜果实内源激素测定上的应用及改进 [J].山东农业科学,2008(7):97-99.
[10] 徐爱军,高桂枝,汤莉莉.梯度洗脱测定植物源调节剂中内源激素方法探讨 [J].分析试验室,2007,9(26);51-54.
