结缔组织生长因子在非小细胞肺癌中的表达及相关性研究
2012-12-23天津医科大学总医院徐萧洪宋作庆李世彬
天津医科大学总医院 徐萧洪,宋作庆,李世彬
山东省千佛山医院 刘振3
泸州医学院 王文军5
肺癌是全球范围内最常见的恶性肿瘤之一, 80%以上的肿瘤患者死于肿瘤的侵袭和转移。有研究显示,结缔组织生长因子(connective tissue growth factor, CTGF)可能在肿瘤生长和血管生成中起作用。肿瘤血管的生成为肿瘤的生长提供了充足的营养,加速了肿瘤的生长,而且为肿瘤细胞进入血液循环创造了极为有利的条件,成为促进肿瘤侵袭和转移的重要因素。本课题组采用免疫组织化学的方法检测了CTGF在非小细胞肺癌(non-small cell lung cancer, NSCLC)中的表达情况,并研究了CTGF表达与NSCLC临床病理特征之间的关系及意义。CTGF作为抑制肿瘤侵袭和转移的途径之一,为防治肿瘤转移提供了一个很有前途的新靶点。检测NSCLC患者CTGF的表达,对于手术治疗的范围的选择将具有参考价值,以减少不必要的扩大手术,减少患者的器官功能缺损,提高生活质量;监测术后CTGF的表达水平,将有望成为判断患者的复发、预后的一个新的指标。
1 资料与方法
1.1 研究对象 标本选自泸州医学院附属医院胸外科2006年1月—2007年2月收治的肺癌患者手术后存档石蜡标本,50例患者均有完整的病理资料。所有患者术前均未接受放疗及化疗,术后均经组织病理学确诊,并取10例正常肺组织作为对照。
1.2 肿瘤患者资料 NSCLC患者50例,其中男性36例,女性14例;年龄13~76岁,平均年龄59.6岁;按UICC(1997年)制定的分期标准进行术后病理分期,I期12例,Ⅱ期13例,Ⅲ期20例,Ⅳ期5例。根据WHO标准分型,肺鳞癌20例,肺腺癌18例,混合癌(大细胞+腺鳞癌)12例;其中伴淋巴结转移者35例,不伴淋巴结转移者15例;高分化癌13例,中分化癌20例,低分化癌17例。
1.3 检测方法及结果判定 采用免疫组织化学法(S-P法),以PBS代替一抗作阴性对照。阳性结果判定:CTGF和TGF-β1蛋白表达主要在细胞质中,以棕黄色颗粒为阳性,不着色为阴性。判定标准:切片中阳性细胞率及染色反应强度作为分级标准。即阴性(-)为细胞质不着色或阳性细胞率<10%;弱阳性(+)为细胞质内出现浅棕黄色颗粒和(或)阳性细胞率为10%~25%;阳性(++)为细胞浆内出现棕黄色颗粒和(或)阳性细胞率为26%~50%;强阳性(+++)为细胞浆内出现深棕黄色颗粒和(或)阳性细胞率>51%。以PBS代替一抗作为阴性对照。
1.4 统计处理 采用SPSS13.0统计软件进行统计学分析,四表格资料用Fish精确概率法、χ2检验法分析CTGF表达与临床病理指标的关系;等级资料的两样本比较用秩和检验,双变量资料的等级相关性用Spearman等级相关分析,以P<0.05为差异有统计学意义。
2 结果
2.1 CTGF在NSCLC和正常肺组织中的表达情况的比较 CTGF主要定位于正常细胞的细胞质中,在NSCLC组织中的阳性表达率为32%(16/50),10例正常肺组织中有9例CTGF呈阳性表达,二者差异有统计学意义(图1,P=0.001,χ2=11.534)。
2.2 CTGF表达与NSCLC临床病理特征的关系 CTGF在NSCLC组织中的阳性表达率为30%,CTGF表达水平与NSCLC患者性别、原发肿瘤大小、组织学类型、癌细胞分化程度均无相关性(P>0.05);而与临床分期及淋巴结转移有关 (P值分别为0.002和0.001)。在T N M分期中,其阳性表达率分别为Ⅰ~Ⅱ期(50%);Ⅲ~Ⅳ期(9.09%)。Ⅰ~Ⅱ期与Ⅲ~Ⅳ期比较差异有统计意义。术后证实有淋巴结转移组中CTGF的阳性表达率为17.14%,淋巴结无转移组中CTGF的阳性表达率为66.67%,两组相比差异具有显著的统计学意义(P<0.005)。(表1)
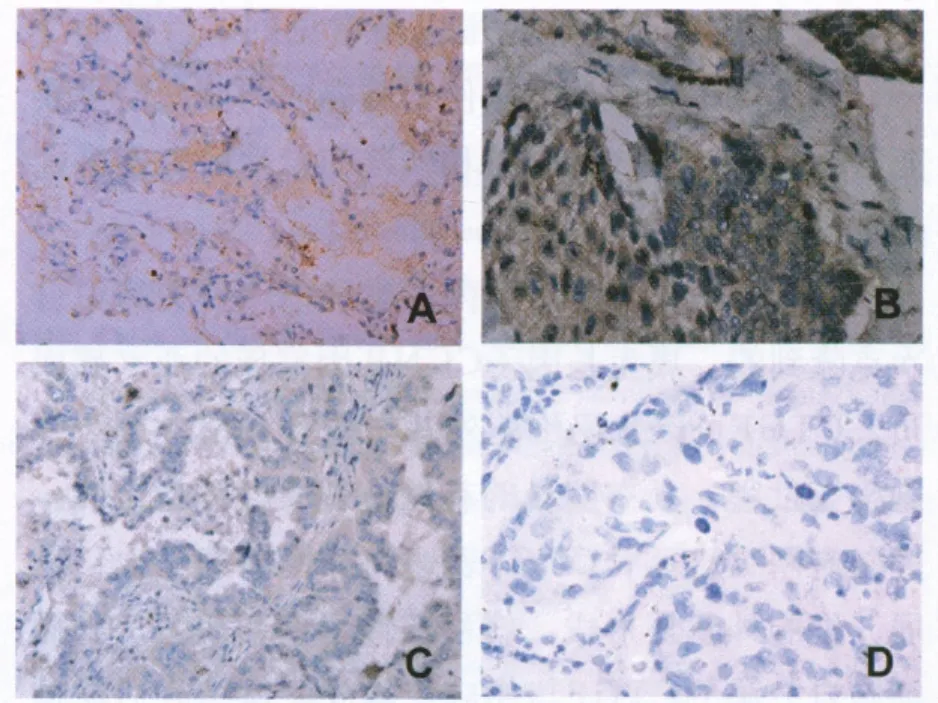
图1 CTGF在正常肺组织和癌组织中的表达情况
3 讨论
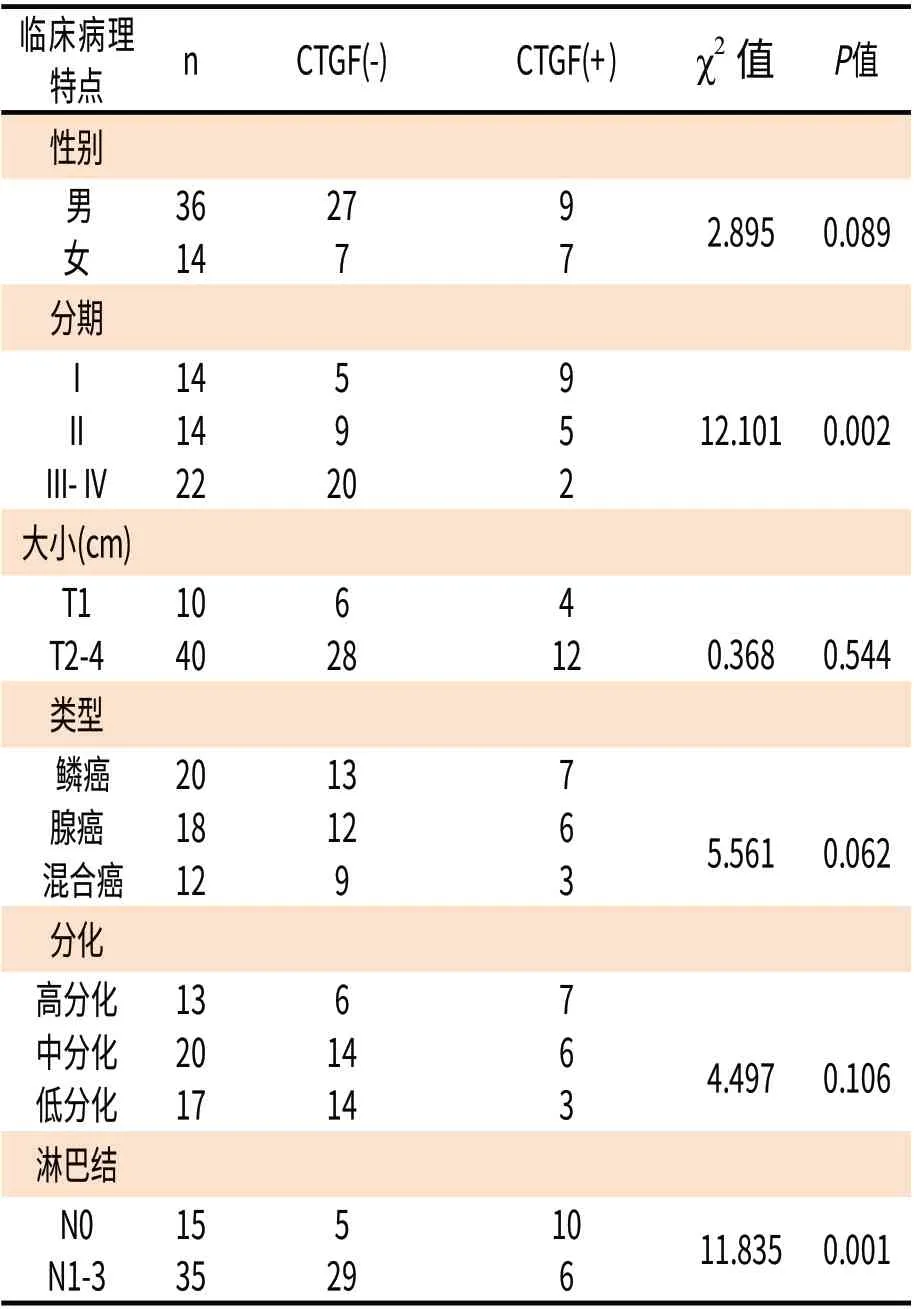
表1 CTGF表达与NSCLC临床病理因素的关系Table 1 Relationship between the expression of CTGF and the different clinicopathologic factors in NSCLC
目前肺癌是全球范围内最常见的恶性肿瘤之一,高发病率和低存活率使得肺癌成为肿瘤的主要死因。因此对肺癌的侵袭和转移的机理研究变得尤为重要。
CTGF是从人脐静脉内皮细胞cDNA文库中首次克隆到的,属生长因子CCN基因家族的亚家族成员。CTGF可以分泌细胞外基质联合蛋白,调节细胞生长过程,具有明显的有丝分裂原性和趋化性。近年有研究表明,CTGF表达与恶性肿瘤发生、进展、细胞外基质形成、转移及预后密切相关,肿瘤细胞自分泌的CTGF与相应受体或配体结合后能抑制肿瘤细胞生长、诱导细胞外基质形成及抑制转移的发生。
本研究中发现,CTGF在NSCLC中为低表达,50例NSCLC标本中CTGF表达减弱,阳性率仅为30%,低于正常肺组织的70%。免疫学证实,其在正常的细支气管上皮组织中大量表达,而在肿瘤细胞却未见表达。这与以往报道[1],CTGF在正常的乳腺上皮细胞内皮细胞和基质细胞呈高表达,而很少在乳腺癌细胞中表达的结果一致。
本研究结果显示,CTGF的表达率在有淋巴结转移者中显著低于无淋巴结转移者,在临床Ⅲ-Ⅳ期NSCLC患者中显著低于Ⅰ-Ⅱ期患者。而CTGF表达水平与NSCLC患者性别、原发肿瘤大小、组织学类型及癌细胞的分化程度均无相关性,所以CTGF表达水平的降低具有提示肿瘤转移的意义。如果能阐明CTGF在肺癌发展过程中的作用机制,可能会为肺癌的治疗寻找新的治疗靶点提供科学依据。笔者认为CTGF在肺癌中抑制肿瘤生长和转移的作用机制可能有以下原因:(1)内皮细胞生长因子(vascular endothelial growth factor,VEGF)是调节肿瘤伴随血管生成的主要细胞调节因子,可以促进肿瘤的生长和转移。有研究显示,CTGF可以和VEGF165相互作用形成复合物[2],从而使CTGF抑制VEGF诱导的血管生成[3],随后进一步抑制NSCLC血管的生成和转移。有实验证明CTGF对VEGF-A基因表达的影响是通过ARD-1 (arrestdefective 1)依赖的乙酰化加速HIF-1α蛋白降解介导的[4]。由此可以说CTGF是一个血管生成的抑制剂,抑制肺腺癌的血管生成和转移。(2)过表达的CTGF在诱导细胞周期停滞在G0/G1期的同时伴随对p53h和p14 [ADP ribosylation factor (ARF)]的诱导。ARF可以调节p53的水平,对抗MDM2并保护p53不被降解[5,6]。在成纤维细胞中,ARF是通过p53诱导细胞周期停滞在G1和G2期。ARF在NSCLC中经常被灭活或不表达[7-9]。本结果表明,CTGF的表达可以增加ARF的表达水平, ARF不能通过DNA损伤剂激活。未调节的E2F1活性能诱导ARF蛋白表达,并依次稳定p53,导致细胞周期停滞及防止不受控制的细胞增殖。
已知C T G F蛋白包含一个胰岛素样生长因子(insulin-like growth factor,IGF)结合蛋白区域。IGF-I依赖的Akt磷酸化和EGF依赖的ERK1/2磷酸化可以被CTGF过量表达而抑制[10]。以往的研究表明,在乳腺癌中WISP3(CCN6)可以调节IGF-I受体信号通过和IGF-1的相互作用[11]。相同的理论对于CTGF,尽管研究证明CTGF对IFG-1有相对低的亲和力。Akt和p53通路形成一个反馈回路,Akt活化导致MDM2磷酸化,最终引起p53的灭活,反之,p53的活化也可以抑制Akt的作用[12]。CTGF的表达可以影响p53通路的这种相互干扰,同时抑制Akt通路。这些细胞的生长停滞可能是由CTGF通过E2F1和ARF诱导p53表达引起的。研究发现,CTGF可以通过一种CRMP-1依赖的基质抑制肺癌的转移和侵袭,CTGF是通过调节整合素偶联小G蛋白,从而影响CRMP-1的表达[13]。整合素是CCN蛋白家族的重要受体,并且受体激活作用可以产生多种。CTGF蛋白可以直接和整合素αvβ3和αⅡbβ3作用。CTGF和整合素αvβ3的相互作用能促进上皮细胞发生黏附和转移,并诱导新生血管的生成。CTGF也可以通过整合α6β1促进人皮肤成纤维细胞转移和增殖[14]。相反的,整合素αvβ3和αvβ5可能只针对CTGF介导的侵袭抑制。
综上所述,CTGF在肺癌组织中呈低表达,而在正常组织中高表达,其可能与肺癌的分期和转移有关。由于NSCLC的发生、发展很可能受多种机制的控制,且CTGF可能通过不同的机制参与了肿瘤的发生和发展。因此CTGF在肺癌中的真正机制仍需进一步研究。
[1] Xie D, Miller CW, O’Kelly J, et al. Breast cancer. Cyr61 is overexpressed,estrogen-inducible, and associated with more advanced disease[J].J Biol Chem,2001,276:1418-14194..
[2] Inoki I, Shiomi T, Hashimoto G, et al. Connective tissue growth factor binds vascular endothelial growth factor (VEGF) and inhibits VEGF-induced angiogenesis[J]. FASEB J,2002,16:219-221.
[3] Hashimoto G, Inoki I, Fujii Y, et al. Matrix metalloproteinases cleave connective tissue growth factor and reactivate angiogenic activity of vascular endothelial growth factor 165[J].J Biol Chem,2002, 277:36288-36295.
[4] Cheng-Chi Chang, Ming-Tsai Lin, Been-Ren Lin, et al. Effect of Connective Tissue Growth Factor on Hypoxia-Inducible Factor 1 Degradation and Tumor Angiogenesis[J]. JNCI Journal of the National Cancer Institute, 2006,98(14):984-995.
[5] Tao W, Levine AJ. P19(ARF) stabilizes p53 by blocking nucleocytoplasmic shuttling of Mdm2[J]. Proc Natl Acad Sci U S A,1999,96:6937-6941.
[6] Zhang Y, Xiong Y. Control of p53 ubiquitination and nuclear export by MDM2 and ARF[J]. Cell Growth Differ,2001,12:175-186.
[7] Park MJ, Shimizu K, Nakano T, et al. Pathogenetic and biologic significance of TP14ARF alterations in nonsmall cell lung carcinoma[J]. Cancer Genet Cytogenet,2003,141:5-13.
[8] Nicholson SA, Okby NT, Khan MA, et al. Alterations of p14ARF, p53, and p73 genes involved in the E2F-1-mediated apoptotic pathways in non-small cell lung carcinoma[J]. Cancer Res,2001,61:5636 -5643.
[9] Mori S, Ito G, Usami N, et al. p53 apoptotic pathway molecules are frequently and simultaneously altered in nonsmall cell lung carcinoma[J]. Cancer,2004,100:1673 -1682.
[10] Chien W, Yin D, Gui D, et al. Suppression of cell proliferation and signaling transduction by connective tissue growth factor in nonsmall cell lung cancer cells[J].Mol Cancer Res, 2006 ,4(8):591-598.
[11] Kleer CG, Zhang Y, Pan Q, et al. WISP3 (CCN6) is a secreted tumorsuppressor protein that modulates IGF signaling in inflammatory breast cancer[J]. Neoplasia,2004,6:179 -185.
[12] Gottlieb TM, Leal JF, Seger R, et al. Cross-talk between Akt,p53, and Mdm2: possible implications for the regulation of apoptosi[J]. Oncogene, 2002,21:1299 -1303
[13] Chang CC,Shih JY,Jeng YM, et al.Connective tissue growth factor and its role in lung adenocarcinoma invasion and metastasis[J].JNail Cancer lnst,2004,96(5):364-375.
[14] Leu SJ, Liu Y, Chen N, Chen CC, Lam SC, Lau LF. Identification of a novel integrin alpha 6 beta 1 binding site in the angiogenic inducer CCN1 (CYR61) [J]. J Biol Chem,2003,278:33801-33808.
