烟酸修饰尾式卟啉的合成及其与人血清白蛋白的相互作用
2012-12-21彭玉苓王树军张成根刘新刚
彭玉苓 王树军 傅 丽 张成根 刘新刚
(廊坊师范学院化学与材料科学学院,河北廊坊065000)
烟酸修饰尾式卟啉的合成及其与人血清白蛋白的相互作用
彭玉苓 王树军*傅 丽 张成根 刘新刚
(廊坊师范学院化学与材料科学学院,河北廊坊065000)
合成了烟酸分子修饰的自由卟啉o-(niacin)C2O-T(3p-OCH3)PP、p-(niacin)C2O-T(3p-OCH3)PP及锌配合物o-(niacin)C2O-T(3p-OCH3)PPZn、p-(niacin)C2O-T(3p-OCH3)PPZn.经元素分析、紫外-可见光谱、核磁共振氢谱(1H NMR)、红外(IR)光谱等对结构进行了表征,并通过量子化学方法计算了锌卟啉的最低能量构型.实验结果表明:o-(niacin)C2O-T(3p-OCH3)PPZn中侧链烟酸基团处于卟啉环上方,烟酸基团中N原子与卟啉环中Zn2+存在着Zn―N间的分子内配位作用,而p-(niacin)C2O-T(3p-OCH3)PPZn中侧链烟酸基团处于卟啉环较远的位置,一个锌卟啉的中心Zn2+与另一个锌卟啉烟酸中N原子之间存在着Zn―N间的分子间配位作用.同时,为模拟金属卟啉的生物功能,采用荧光光谱滴定法测定了金属锌卟啉与人血清白蛋白相互作用的光谱性质.荧光光谱实验结果显示:金属锌卟啉与人血清白蛋白(HSA)之间发生了较强的静态荧光猝灭作用,反应机理是以氢键或van der Waals力结合反应.按照Stern-Volmer方程、Lineweaver-Burk双倒数方程分析和处理实验数据,得到了反应的猝灭常数、结合常数和热力学参数等.
烟酸;锌卟啉;人血清白蛋白;荧光猝灭;热力学参数
1 引言
血清白蛋白是血浆中最为丰富的蛋白质,含有多种可配位基团能与生物体内许多物质作用.在生物体系中,金属卟啉配合物是许多酶的活性中心,1-5在与血清白蛋白相互作用的研究中,卟啉分子可与血清白蛋白结合,其聚集状态及在机体中的分布、代谢等生理过程都受到血清白蛋白的影响.因此,研究金属卟啉与血清白蛋白相互作用的机理已引起了人们的极大兴趣,当前国内外的文献资料6-12中也较多地报道了金属卟啉与牛血清白蛋白之间相互作用的研究成果.
烟酸(维生素B5)是具有生物活性的小分子,文献13-15以烟酸充当弱的电子供体通过1,3-二溴丙烷、1,6-二溴己烷和氨基将烟酸键连到卟啉环,并重点研究了烟酸-卟啉二元化合物的电化学性质.
本文通过1,2-二溴乙烷将烟酸键连到卟啉环并在卟啉环周边苯环上引入甲氧基作为供电子基团合成了自由卟啉化合物o-(niacin)C2O-T(3p-OCH3)PP (H2P1)和p-(niacin)C2O-T(3p-OCH3)PP(H2P2)及对应的锌配合物o-(niacin)C2O-T(3p-OCH3)PPZn(ZnP1)和p-(niacin)C2O-T(3p-OCH3)PPZn(ZnP2),以期实现烟酸分子与卟啉化合物生物活性的叠加.同时,为模拟金属卟啉的生物功能活性,文中采用荧光光谱滴定法研究了锌卟啉与人血清白蛋白(HSA)之间的相互作用,研究结果有利于我们深入认识卟啉衍生物在生物体系中所发挥的重要功能.
2 实验部分
2.1 目标化合物的合成
2.1.1 5-邻(对)羟基苯基-10,15,20-三(4-甲氧基苯基)卟啉的合成
参照文献16的方法合成,取2.8 mL对甲氧基苯甲醛、0.78 mL水杨醛、100 mL丙酸溶于250 mL三颈烧瓶中,加入2.1 mL重蒸吡咯,机械搅拌,回流0.5 h,停止反应,冷却到室温.抽滤得蓝紫色晶体,用蒸馏水洗涤2-3次,晾干.将粗产品用柱色谱进行分离,固定相为氧化铝,先用二氯甲烷为淋洗剂分离出第一色带,再改用以一定比例的二氯甲烷:乙醇(V:V=40:1)配成的混合溶液为淋洗剂,收集主色带,即为5-邻羟基苯基-10,15,20-三(4-甲氧基苯基)卟啉,产率为6.2%.
采用相同的方法合成了5-对羟基苯基-10,15, 20-三(4-甲氧基苯基)卟啉,产率为7.8%.
2.1.2 5-邻(对)(2-溴乙氧基)苯基-10,15,20-
三(4-甲氧基苯基)卟啉的合成
参照文献16的合成方法,在50 mL烧瓶中加入0.1 g 5-邻羟基苯基-10,15,20-三(4-甲氧基苯基)卟啉,15 mL二甲基甲酰胺(DMF),回流使之溶解,加入0.3 mL新蒸的1,2-二溴乙烷和0.3 g新焙烧过的无水碳酸钾,在室温下电磁搅拌36 h,用二氯甲烷进行多次萃取至上层无色,再用蒸馏水多次洗涤,收集萃取液.柱色谱分离,固定相为氧化铝,先用二氯甲烷为淋洗剂分离出第一色带,再改用以一定比例的二氯甲烷:乙醇(V:V=40:1)配成的混合溶液为淋洗剂,收集主色带,即为产品5-邻(2-溴乙氧基)苯基-10,15,20-三(4-甲氧基苯基)卟啉,产率为53.7%.
采用相同的方法合成了5-对(2-溴乙氧基)苯基-10,15,20-三(4-甲氧基苯基)卟啉,产率为56.9%.
2.1.3 H2P1和H2P2的合成
在100 mL圆底烧瓶中加入40 mg烟酸钠(参考文献16合成)和100 mg 5-邻(2-溴乙氧基)苯基-10,15, 20-三(4-甲氧基苯基)卟啉,并加入20 mL DMF,用75°C水浴加热搅拌反应,待反应完全停止后冷却,加入60 mL饱和食盐水使产物析出,过滤、洗涤、干燥.粗产品以硅胶为固定相,进行柱色谱分离,先用二氯甲烷为淋洗剂分离第一色带,再改用以一定比例的二氯甲烷:乙醚(V:V=25:1)配成的混合溶液为淋洗剂,收集主色带,旋干得紫色晶体,产率为65.7%.
1H NMR(CDCl3,400 MHz),δ:-2.852(s,2H,pyrrole N―H),1.540(s,9H,3OCH3),3.931-3.942(t,J=4.4 Hz,2H,―CH2),4.154-4.173(t,J=7.6 Hz,2H,―CH2), 6.277-6.303(m,J=10.4 Hz,1H,Py-2-H),7.296-7.317(d,J=8.4 Hz,1H,ArO-o-H),7.417-7.430(m,J= 5.2 Hz,6H+3H,3Ar-m-H+ArO-m,p-H),7.856-7.872 (t,J=6.4 Hz,1H,Py-4-H),8.030-8.063(t,J=13.2 Hz, 1H,Py-6-H),8.139-8.157(m,J=7.2 Hz,6H,3Ar-o-H),8.295-8.302(d,J=2.8 Hz,1H,Py-5-H), 8.816-8.845(m,J=11.6 Hz,8H,Pyrrole).C55H43N5O6· H2O元素分析实测值(理论计算值)(%):C 74.01 (74.41),H 4.97(5.07),N 7.59(7.89).
采用相同的方法合成了H2P2,产率为75.1%.1H NMR(CDCl3,400 MHz),δ:-2.755(s,2H,pyrrole N-H),1.542(s,9H,3OCH3),4.631-4.642(t,J=4.4 Hz, 2H,―CH2),4.914-4.933(t,J=7.6 Hz,2H,―CH2), 7.261-7.283(m,J=8.8 Hz,1H,Py-2-H),7.337-7.360 (m,J=9.2 Hz,8H,4Ar-m-H),7.441-7.452(t,J=4.4 Hz,1H,Py-4-H),7.903-8.043(t,J=16.0 Hz,1H, Py-6-H),8.119-8.157(m,J=15.2 Hz,8H,4Ar-o-H), 8.305-8.312(d,J=2.8 Hz,1H,Py-5-H),8.836-8.865 (m,J=11.6 Hz,8H,pyrrole).C55H43N5O6元素分析实测值(理论计算值)(%):C 74.51(75.95),H 4.71 (4.95),N 7.81(8.06).
2.1.4 ZnP1和ZnP2的合成
将76 mg H2P1化合物溶于20 mL CH2Cl2中,加入过饱和的乙酸锌甲醇溶液10 mL,避光,微微回流1 h,产物由紫色逐渐变成紫红色,冷却,水洗,再用二氯甲烷萃取,旋干.以一定比例的二氯甲烷:乙醚(V:V=25:1)配成的混合溶液为淋洗剂,硅胶为固定相,将粗产品进行分离,收集主色带,旋干蒸发得到紫红色晶体,产率为92.6%.产物的合成路线见示意图1.
1H NMR(CDCl3,400MHz),δ:1.562(s,9H, 3OCH3),2.943-2.960(t,J=6.8 Hz,2H,―CH2),4.444-4.463(t,J=7.6 Hz,2H,―CH2),5.567-5.593(m,J= 10.4 Hz,1H,Py-2-H),6.896-6.917(d,J=8.4 Hz,1H, ArO-o-H),7.177-7.220(m,J=17.2 Hz,6H+3H,3Arm-H+ArO-m,p-H),7.956-7.972(t,J=6.4 Hz,1H,Py-4-H),8.040-8.053(t,J=5.2 Hz,1H,Py-6-H),8.132-8.164(m,J=12.8 Hz,6H,3Ar-o-H),8.195-8.201(d, J=2.4 Hz,1H,Py-5-H),8.836-8.855(m,J=7.6 Hz, 8H,Pyrrole).C55H41N5O6Zn元素分析实测值(理论计算值)(%):C 70.46(70.82),H 4.60(4.40),N 7.09 (7.51).
采用相同的方法合成了ZnP2,产率为95.1%.1H NMR(CDCl3,400 MHz),δ:1.261(d,J=11.6 Hz, 9H,3OCH3),3.901-3.922(t,J=8.4 Hz,2H,―CH2), 4.154-4.173(t,J=7.6 Hz,2H,―CH2),6.274-6.303 (m,J=11.6 Hz,1H,Py-2-H),7.386-7.421(d,J=14.0 Hz,1H,Py-4-H),7.727-7.760(m,J=13.2 Hz,8H, 4Ar-m-H),8.010-8.033(t,J=9.2 Hz,1H,Py-6-H), 8.199-8.237(m,J=15.2 Hz,8H,4Ar-o-H),8.295-8.299(d,J=1.6 Hz,1H,Py-5-H),8.816-8.835(m,J= 7.6 Hz,8H,Pyrrole).C55H41N5O6Zn元素分析实测值(理论计算值)(%):C 70.53(70.82),H 4.75(4.40),N 7.24(7.51).
2.2 主要仪器与试剂
Perkin-Elemer 240元素分析仪(美国);Shimadzu-2550紫外-可见分光光度计(日本岛津);WGY-10型荧光分光光度计(天津港东科技发展有限公司); Varian 400 M核磁共振仪(TMS,CDCl3,美国);傅里叶变换红外光谱仪(Prestige-21,日本岛津);石英比色皿.
对甲氧基苯甲醛、水杨醛、对羟基苯甲醛、吡咯、丙酸、1,2-二溴乙烷、烟酸、二甲基亚砜(DMSO)、乙醇、二氯甲烷、乙酸锌、三(羟甲基)氨基甲烷,中性Al2O3(100-200目),硅胶(200-300目),以上试剂均为分析纯;人血清白蛋白(HSA,购于中生北控生物科技股份有限公司).实验用水为二次去离子水.
2.3 实验方法
紫外-可见光谱的测定:以二氯甲烷为溶剂,分别配制一定浓度的H2P1、H2P2和ZnP1、ZnP2溶液,进行Q谱带和Soret谱带的测定,紫外-可见吸收光谱见图1、图2,数据见表1.
荧光光谱的测定:人血清白蛋白(相对分子质量68000)储备液:1.176×10-5mol·L-1水溶液,工作液为2.50×10-6mol·L-1;三(羟甲基)氨基甲烷(Tris)-HCl缓冲溶液:0.1 mol·L-1水溶液(pH=7.40).以DMSO为溶剂,配制浓度为2.0×10-4mol·L-1的ZnP1和ZnP2储备液,工作液浓度范围为1.0×10-6-3.0×10-5mol· L-1.于10 mL容量瓶中依次加入 pH=7.40的Tris-HCl缓冲溶液1 mL、2.0 mL 2.50×10-6mol·L-1的HSA和不同体积的ZnP1或ZnP2溶液,定容,于一定温度恒温水浴中恒温10 min,扫描各体系的荧光光谱图.测试条件:样品池为1 cm×1 cm×4 cm石英池,激发狭缝10 nm,发射狭缝10 nm,激发波长为286 nm,负高压:145 V,扫描范围:275-450 nm.温度为15、25、35及45°C.
红外光谱采用溴化钾压片法,在4000-400 cm-1范围内摄谱,主要吸收峰光谱数据列于表2.
2.4 计算方法
量子化学计算采用从头算Hartree-Fock方法和密度泛函理论B3LYP方法,运用6-31G(d)计算基组.17,18先在Hartree-Fock/6-31G(d)级别上进行初步优化,再在B3LYP/6-31G(d)级别上进行构型优化、频率分析确定稳定构型,全部计算用Gaussian 03程序包完成.

示意图1 ZnP1和ZnP2配合物的合成路线图Scheme lSynthesis routes of ZnP1and ZnP2complexes
根据Stern-Volmer方程:19F0/F=1+Kqτ0[Q]=1+ KSV[Q],计算体系的猝灭常数.式中:Kq为双分子猝灭过程速率常数(L·mol-1·s-1);τ0为无猝灭剂时生物大分子的平均寿命(τ0=10-8s);KSV为Stern-Volmer猝灭常数(L·mol-1);F0为未加入猝灭剂时人血清白蛋白的荧光强度;F为金属卟啉与人血清白蛋白相互作用时体系的荧光强度;[Q]为淬灭剂金属卟啉的浓度(mol·L-1).
利用猝灭公式:(F0-F)-1=F0-1+(KF0[Q])-1,19作不同温度下的Lineweaver-Burk曲线,由直线斜率求得不同温度下金属卟啉与HSA的结合常数K.
由vanʹt Hoff方程:20lnK0=-ΔrHm0/RT+ΔrSm0/R,以不同温度下反应体系的lnK0对1/T作线性回归,求出反应的熵变ΔrSm0、焓变ΔrHm0和自由能变ΔrGm0.
3 结果与讨论
3.1 合 成
文中通过经典的Alder-Longo法合成了基础原料5-邻羟基苯基-10,15,20-三(4-甲氧基苯基)卟啉和5-对羟基苯基-10,15,20-三(4-甲氧基苯基)卟啉,合成过程中加热时间不易过长,以微回流控制温度,反应体系保持高速搅拌,否则易产生黑色高聚物. H2P1、ZnP1的合成与H2P2、ZnP2的合成相比,产率较低,这可能是受空间位阻效应的影响所致.另从H2P1、H2P2及ZnP1、ZnP2的合成表征数据可以看出,自由卟啉和金属卟啉的元素分析数据与理论值都非常接近,初步确定所得产物为目标化合物.
3.2 紫外-可见吸收光谱
图1是H2P1、ZnP1在二氯甲烷溶液中浓度分别为2.0×10-6、2.0×10-5mol·L-1时测得的Soret带(图1曲线a和b)和Q带(图1曲线c、d)的紫外吸收光谱.图2是H2P2在浓度分别为2.0×10-6、2.0×10-5mol·L-1时测得的Soret带(图2曲线b)、Q带(图2曲线e)的紫外吸收光谱和ZnP2浓度分别在1.0×10-7、2.5×10-6、4.0×10-6mol·L-1时测得的Soret带(分别为图2曲线a、c、d)及浓度在1.0×10-7mol·L-1时测得的Q带(图2曲线f)的紫外吸收光谱.
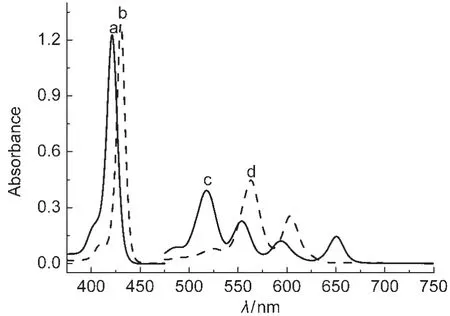
图1 H2P1和ZnP1的紫外-可见吸收光谱Fig.1 UV-Vis absorption spectra of H2P1and ZnP1(a)H2P1-Soret band;(b)ZnP1-Soret band;(c)H2P1-Q band; (d)ZnP1-Q band
结合图1、图2和表1中数据可以看出:(1)H2P1和H2P2的紫外-可见吸收光谱均有一个Soret带和四个Q带.根据Gouterman的四轨道模型,21在421.2和421.9 nm处的强吸收是Soret带,由a1μ(π)-eg(π*)电子跃迁产生,归属于卟啉π-π*跃迁的第二电子激发态;吸收光谱在500-650 nm之间的吸收带是Q带,由a2μ(π)-eg(π*)电子跃迁产生,归属为卟啉π-π*跃迁的第一电子激发态;(2)H2P1、H2P2络合锌离子形成ZnP1、ZnP2后,紫外吸收光谱中QI、QIV带消失.分析引起吸收光谱发生变化的原因,Zn2+是d10组态的金属离子,当锌离子配位于自由卟啉化合物后,卟啉环内形成Zn―N键,配合物的对称性发生了变化,由配体的D2h变为配合物的D4h,且能级靠近,分子轨道的分裂程度减少,简并度增加,由a2μ(π)-eg(π*)电子跃迁产生的Q带数目相应减少,表现为QI、QIV谱带消失,同时Soret谱带发生一定程度的位移,这符合金属卟啉紫外-可见光谱的吸收特征;22(3)对于ZnP1来说,与H2P1相比Soret谱带发生了较大程度的位移,一般情况下自由卟啉络合Zn2+形成锌卟啉后, Soret谱带红移5-6 nm,而ZnP1红移了近10 nm,原因可能是存在分子内的配位作用,我们16曾合成报道的o-(niacin)C2O-TPPZn配合物中即存在着卟啉环内Zn离子与侧链吡啶环中N原子间的分子内配位作用;对于ZnP2而言,在浓度为1.0×10-7mol·L-1时测得的Soret带图谱发生了一定程度的裂分,且随着溶液浓度增大到4.0×10-6mol·L-1时(图2曲线a-d),Soret带图谱裂分的程度越来越清晰,这是因为当卟啉大环中心络合锌离子后,一个锌配合物的中心锌离子与另一个锌配合物烟酸上N原子之间形成了配位作用,也就是说ZnP2分子之间形成了配位作用,师同顺等23合成的5-(4-烟酸酰亚胺基)苯基-10,15,20-三苯基卟啉锌配合物中也存在着侧链烟酸中N原子与另一锌卟啉中锌离子间的配位作用,形成了二聚体,导致锌卟啉配合物Soret带图谱的裂分.
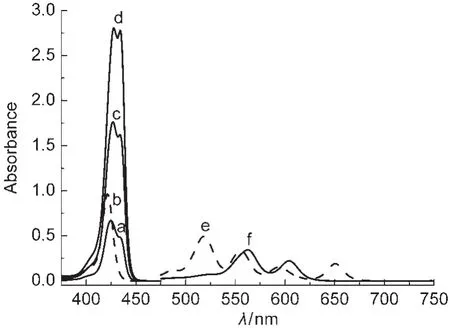
图2 H2P2和ZnP2的紫外-可见吸收光谱Fig.2 UV-Vis absorption spectra of H2P2and ZnP2(a,c,d)ZnP2-Soret band;(b)H2P2-Soret band; (e)H2P2-Q band;(f)ZnP2-Q band
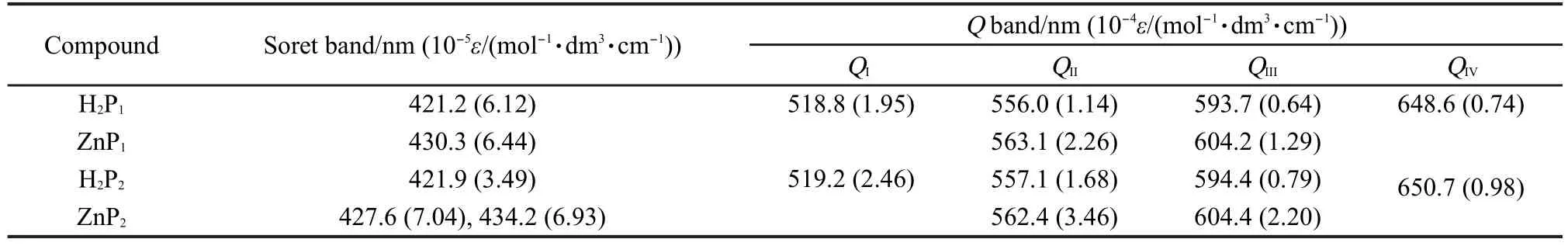
表1 H2P1、H2P2、ZnP1及ZnP2在二氯甲烷中的紫外-可见吸收光谱数据Table 1 Data of UV-Vis spectra of H2P1,H2P2,ZnP1,and ZnP2in CH2Cl2
3.3 核磁共振氢谱
根据实验结果,并参照文献16对自由卟啉H2P1、ZnP1和H2P2、ZnP2的核磁共振氢谱进行了归属,数据列于2.1节的合成部分.由测试数据可以看出:(1)自由卟啉H2P1和H2P2卟啉环中N―H键的化学位移分别在-2.852和-2.755处,而在ZnP1和ZnP2中该处峰均消失,说明确实形成了金属锌卟啉配合物;(2) H2P1和H2P2吡啶环中H的化学位移分别在6.277-6.303、7.856-7.872、8.030-8.063、8.295-8.302及7.261-7.283、7.441-7.452、7.903-8.043、8.305-8.312处,与锌离子配位形成ZnP1和ZnP2后吡啶环中H的化学位移分别在5.567-5.593、7.956-7.972、8.040-8.053、8.195-8.201及 6.274-6.303、7.386-7.421、8.010-8.033、8.295-8.299处,而文献24中烟酸负离子中H的化学位移在7.41、8.15、8.49、8.83处.与之对比,金属卟啉中吡啶环上H的化学位移均向高场进行了移动,这是因为ZnP1和ZnP2中Zn2+除与卟啉环中N原子配位外,还与吡啶环中N原子形成了配位作用,这使得卟啉环的a2μ(π)轨道能量增加,与eg(π*)间的能量差减小,激发能降低,因此跃迁吸收谱带明显向长波长方向移动,从而造成Soret带的红移.23,25-27
3.4 红外光谱
根据文献16对自由卟啉及其锌配合物的红外特征吸收光谱进行了经验归属,数据列于表2中.由表2可以看出,H2P1和H2P2中羰基的特征吸收峰分别出现在1720.45、1718.58 cm-1处,在1350.17、1347.94 cm-1处分别有酯键的典型特征吸收峰,表明烟酸负离子以成酯的方式与卟啉侧端的乙氧链相连接生成了新的化合物.
再观察表2,H2P1和H2P2中的N-H伸缩振动吸收带分别出现在3410.15、738.74 cm-1及3420.42、735.79 cm-1处,在其所对应的锌配合物ZnP1和ZnP2中,这两条谱带均消失,同时分别在993.34、995.68 cm-1处生成了一个新的强伸缩振动吸收峰,该峰归属于卟啉环内Zn―N配位键的振动吸收峰.这些实验数据表明,卟啉环内的两个氢原子被锌离子取代后形成了稳定的金属卟啉配合物.
3.5 量子化学计算
通过频率分析计算得出势能面上的稳定构型见图3.表3中列出了金属锌卟啉稳定构型的能量、前线轨道数据(最高占据轨道(HOMO)、最低空轨道(LUMO))以及二者的能级差ΔELUMO-HOMO=ELUMO-EHOMO)及中心金属离子Zn2+和侧链基团吡啶环中N原子上的电荷.
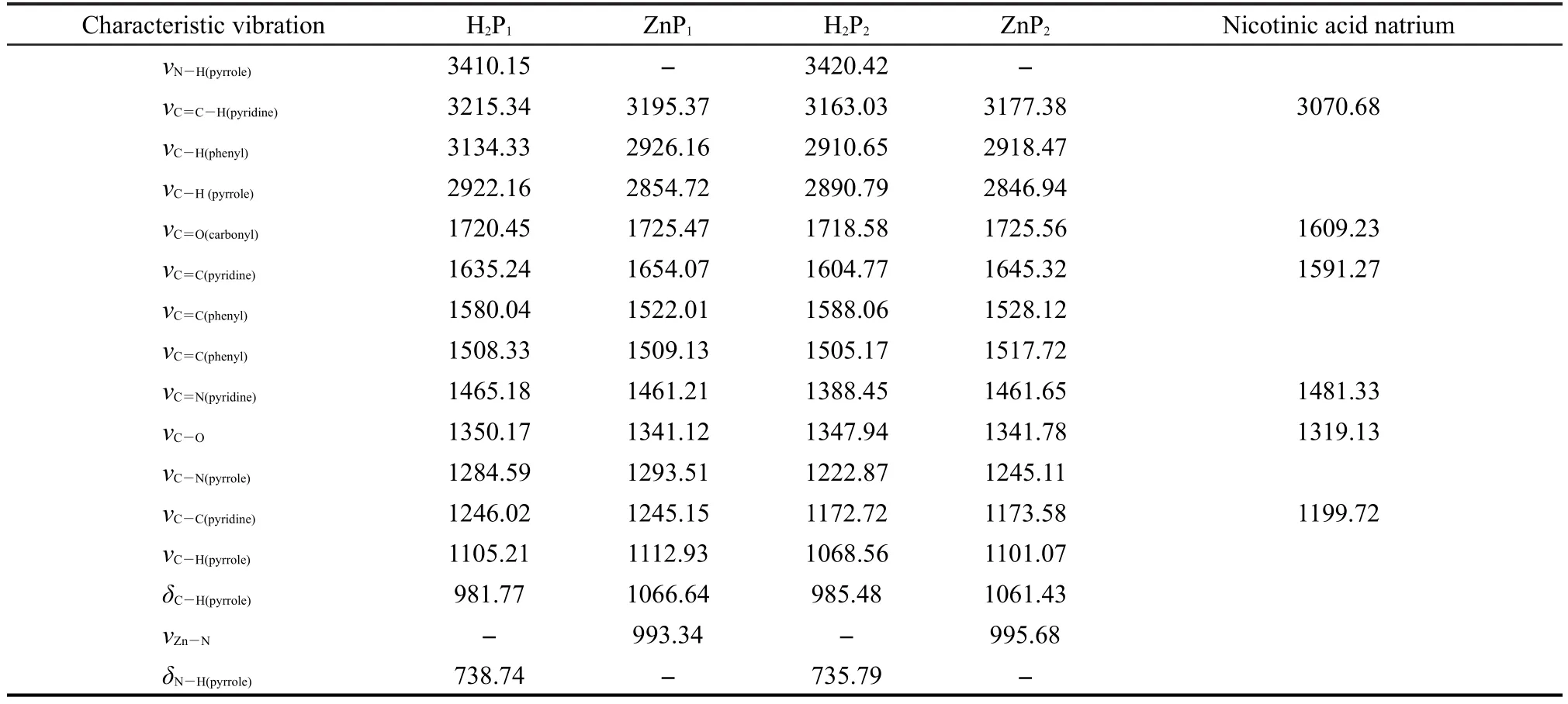
表2 红外特征吸收光谱数据(cm-1)Table 2 Data of IR spectroscopy(cm-1)
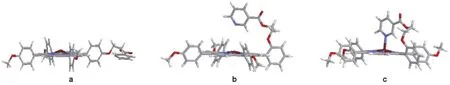
图3 金属卟啉的稳定构型Fig.3 Stable configurations of metalloporphyrins(a)ZnP2;(b)ZnP1-1;(c)ZnP1-2
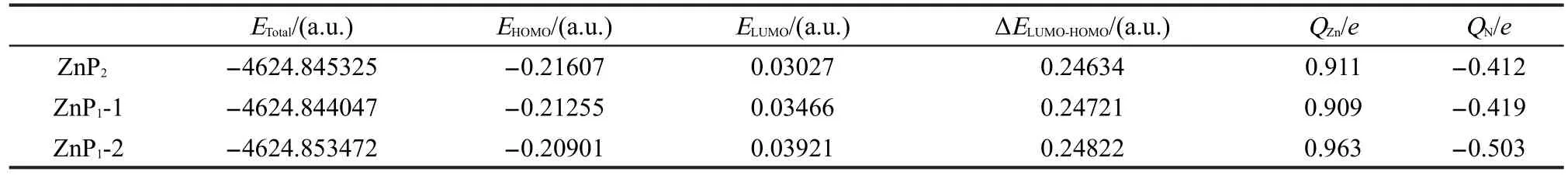
表3 量子化学计算结果Table 3 Calculation results of quantum chemistry
图3a是ZnP2的稳定构型.由稳定构型可以看出,侧链基团远离卟啉环平面.结合ZnP2的实验合成方法,侧链基团中吡啶环是通过柔性链―CH2―CH2―与卟啉环连接,吡啶环中N原子具有与另一锌卟啉分子中的锌离子形成分子间配位的空间结构特点.
图3b是ZnP1中侧链与卟啉环之间没有相互作用时的稳定构型(标记为ZnP1-1);图3c是ZnP1中侧链吡啶环中N原子与卟啉环中锌离子之间形成分子内配位作用时的稳定构型(标记为ZnP1-2).结合表3中数据,图3c构型比图3b构型的能量低(24.75 kJ·mol-1),表明图3c构型更稳定.根据前线轨道理论,体系的LUMO和HOMO的能量差ΔELUMO-HOMO越大,则体系越稳定.28图3c构型中ΔELUMO-HOMO比图3b构型中ΔELUMO-HOMO大,由此确定图3c构型比图3b构型更稳定,这与能量的分析结果是一致的.
从电荷分布的角度考虑,与图3b构型相比,图3c构型中的Zn2+带更多的正电荷,而侧链烟酸中N原子上带更多的负电荷,说明Zn2+和N原子能够形成稳定的化学键,测量的键长为0.2201 nm,表明Zn2+和N原子具有很强的相互作用,这种配位作用降低了整个体系的能量,从而使体系更稳定.由此可进一步确定ZnP1中Zn2+除与卟啉环中四个N原子配位之外,还存在着与侧链基团吡啶环中N原子之间的配位作用,也就是说ZnP1中Zn2+形成了五配位.
综合分析紫外-可见吸收光谱、核磁共振氢谱和量子化学计算结果,ZnP1中侧链烟酸基团键连在卟啉环的邻位,处于卟啉环上方,形成了分子内配位,而ZnP2中侧链烟酸基团键连在卟啉环的对位,处于卟啉环较远的位置,形成了分子间配位.
3.6 荧光光谱滴定实验
3.6.1 ZnP1对HSA的荧光猝灭机理
图4是25°C条件下不同浓度的ZnP1滴定一定浓度的HSA所得到的荧光光谱变化曲线图.以λex= 286 nm激发,HSA在349.0 nm处有很强的荧光蜂(图4曲线a),而ZnP1的荧光峰位处于630.4、667.8 nm.由图可以看出,当不同浓度的ZnP1滴定一定浓度的HSA时,反应体系的荧光曲线与HSA和ZnP1相比,荧光强度均发生了较大变化,说明ZnP1与HSA之间存在着一定的相互作用;并且随着加入ZnP1浓度的不断增加,所形成体系的荧光曲线呈现出不断降低的趋势,即产生了荧光猝灭效应.在15、35及45°C条件下,不同浓度的ZnP1滴定一定浓度的HSA所得到的荧光光谱也有相同的变化趋势.
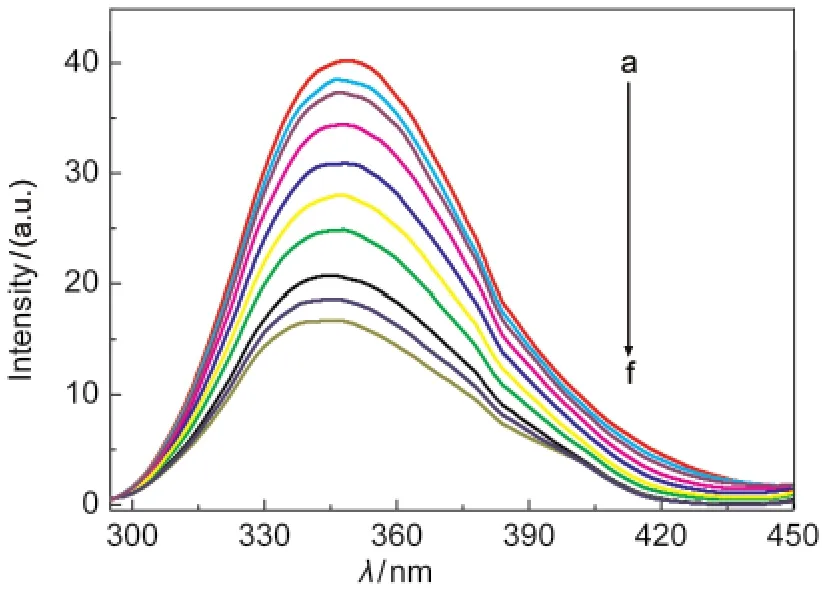
图4 25°C时ZnP1与HSA相互作用的荧光光谱图Fig.4 Fluorescence spectra between ZnP1and HSAat 25°C(a)HSA,2.50×10-6mol·L-1;[ZnP1]/(mol·L-1)(b)1.0×10-6; (c)2.0×10-6;(d)4.0×10-6;(e)6.0×10-6;(f)1.0×10-5;(g)1.5×10-5; (h)2.0×10-5;(i)2.5×10-5;(j)3.0×10-5;λex=286 nm
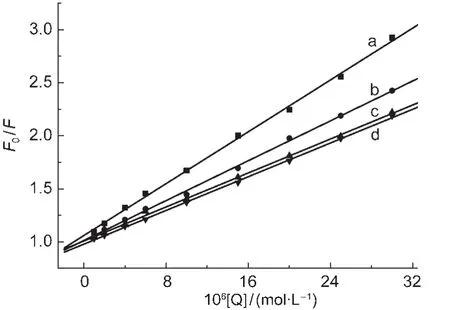
图5 HSA荧光猝灭的Stern-Volmer曲线图Fig.5 Stern-Volmer curves of fluorescence quenching of HSAT/°C:(a)15;(b)25;(c)35;(d)45
3.6.2 荧光猝灭理论
蛋白质分子中因含有色氨酸、酪氨酸等氨基酸而产生较强的荧光.当蛋白质等荧光体与其他物质相互作用而导致荧光体荧光强度降低的现象称为荧光猝灭作用.荧光猝灭过程通常有动态猝灭和静态猝灭两类.静态猝灭过程遵从Stern-Volmer方程[F0/F=1+KSV[Q]=1+Kqτ0[Q]]和Lineweaver-Burk双倒数函数曲线方程[(F0-F)-1=F0-1+(KF0[Q])-1].29
3.6.3 猝灭常数和结合常数的计算
为了判断ZnP1对HSA荧光的猝灭机理,根据温度为15、25、35和45°C时ZnP1与HSA相互作用的荧光光谱图,利用Stern-Volmer方程以F0/F-[Q]作图得到了不同温度下ZnP1对人血清白蛋白的荧光猝灭Stern-Volmer曲线(见图5).由图5可以看出,在不同温度下得到的Stern-Volmer曲线均有良好的线性关系,这是静态猝灭的迹象之一.同时,根据Stern-Volmer方程计算也得到了不同温度下的荧光猝灭常数Kq,数值列于表4中.不同温度下ZnP1对HSA荧光猝灭速率常数远大于各类猝灭剂对生物大分子的最大猝灭速率常数Kq值2.0×1010L·mol-1· s-1,并且随温度的升高,ZnP1对HSA的荧光猝灭速率常数呈现出了不断下降的趋势.综合这些因素, ZnP1对HSA的荧光猝灭是分子间形成复合物而引起的静态猝灭.29
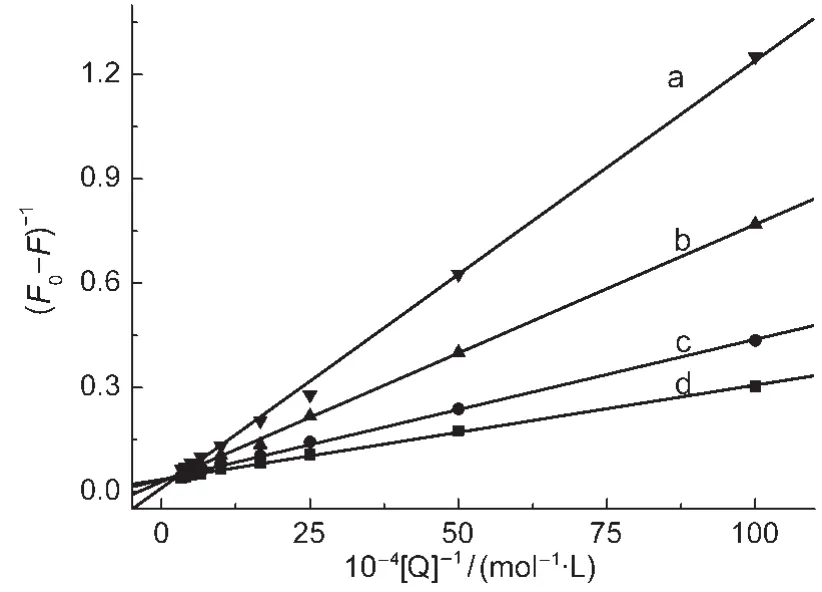
图6 HSA荧光猝灭的Lineweaver-Burk曲线图Fig.6 Lineweaver-Burk curves of fluorescence quenching of HSAT/°C:(a)45;(b)35;(c)25;(d)15
再利用Lineweaver-Burk双倒数函数曲线方程以作图,得到了不同温度下ZnP1对 HSA的荧光猝灭Lineweaver-Burk曲线(见图6),并根据Lineweaver-Burk方程计算出了ZnP1与HSA之间的结合常数K,数据列于表4中,K值的大小表明二者之间的结合作用较强,说明合成的ZnP1可以在体内被蛋白质储存和运输.
3.6.4 热力学参数的计算
由vanʹt Hoff方程以不同温度下反应体系的lnK0对1/T作线性回归(线性相关系数r=0.9996),求得熵变ΔrSm0=-10.58 J·K-1、焓变ΔrHm0=-30.47 kJ·moL-1和自由能变ΔrGm0=-27.32 kJ·moL-1.这些热力学函数数据说明两者之间发生了化学反应,且反应能自发进行.再根据Ross等30总结出的判断生物大分子与小分子结合力性质的热力学规律:ΔH>0、ΔS>0时,属于疏水作用力;ΔH<0、ΔS<0时,属于氢键或van der Waals力;ΔH≈0、ΔS>0时,属于静电引力.文中研究体系的ΔH和ΔS均小于0,由此得出结论:所合成的ZnP1与HSA主要是以氢键或van der Waals力结合反应的,也就是说ZnP1进入了HSA的疏水腔.
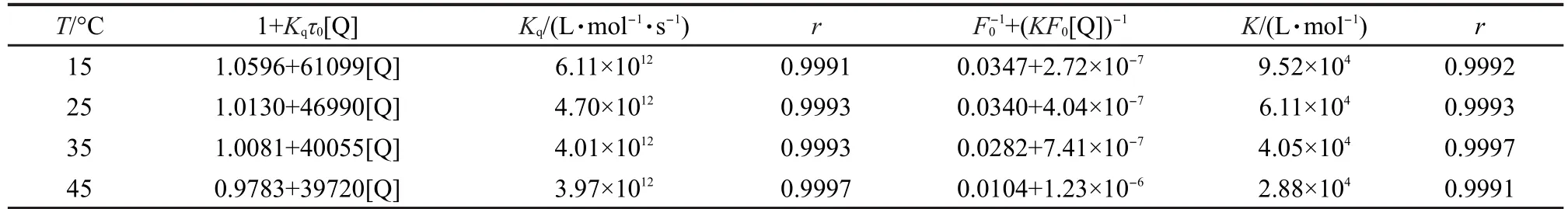
表4 不同温度下ZnP1对HSA的荧光猝灭常数Kq、结合常数K及线性相关系数rTable 4 Quenching constants Kq,binding constants K,and linear correlation coefficient r between ZnP1and HSAat different temperatures
-F)-1versus[Q]-1.
对于ZnP2与人血清白蛋白相互作用时的猝灭常数、结合常数及热力学参数等数据与ZnP1相比没有出现较大的变化,由此看来相同基团键连卟啉环位置的差异对与人血清白蛋白的相互作用未造成较大的影响.
4 结论
通过亲核取代反应合成了含有烟酸分子修饰的自由卟啉o-(niacin)C2O-T(3p-OCH3)PP、p-(niacin) C2O-T(3p-OCH3)PP及锌配合物o-(niacin)C2O-T(3p OCH3)PPZn、p-(niacin)C2O-T(3p-OCH3)PPZn.经元素分析、紫外-可见光谱、核磁共振氢谱、红外光谱等多种谱图对结构进行了表征.实验数据显示,o-(niacin)C2O-T(3p-OCH3)PPZn存在着分子内的Zn-N配位作用,而p-(niacin)C2O-T(3p-OCH3)PPZn中存在着分子间的Zn-N配位作用.荧光光谱滴定实验显示,具有生物活性功能的烟酸分子修饰合成的金属锌卟啉对人血清白蛋白的荧光具有良好的猝灭作用,该猝灭过程为静态猝灭,锌卟啉与HSA之间是以氢键或van der Waals力结合反应.这些研究结果为获取蛋白质分子的信息,了解卟啉类药物在体内的作用机理,提供了一些具有理论和应用价值的信息.
(1) Sara,M.A.P.;Mirtha,A.O.L.;Mario,J.F.C.;Artur,R.A.; Mario,T.S.R.;Hugh,D.B.;Mariette,M.P.Inorg.Chem.2011, 50,7916.
(2) Venkata,K.;Andrey,T.;Joseph,S.;Christopher,H.F.;Michael, J.T.;Kent,B.J.J.Am.Chem.Soc.2010,132(32),11083.
(3) Bart,M.J.M.S.;Duncan,M.T.;Martin,L.;Anthony,L.S.; Leonardus,W.J.;Gerard,V.K.;Robertus,J.M.K.G.J.Org. Chem.2010,75(5),1534.
(4) Marco,G.;Claudio,C.;You,C.C.J.Phys.Chem.A 2008,112 (15),3376.
(5)Wang,R.M.;Zhu,Y.F.;He,Y.F.;Li,Y.;Mao,C.W.;He,N.P. Progress in Chemistry 2011,22(10),1952. [王荣民,朱永峰,何玉凤,李 岩,毛崇武,何乃普.化学进展,2011,22(10), 1952.]
(6) Shimshon,B.D.;Irena,B.;Hana,W.;Kevin,M.S.;William,G. O.N.;Peter,A.J.;Benjamin,E.Eur.Biophys.J.2009,38,847.
(7) Roelants,M.;Van Cleynenbreugel,B.;Lerut,E.;Van Poppel, H.;Witte,P.A.M.Photochem.Photobiol.Sci.2011,10,151.
(8) Divakar,K.;Sujatha,V.;Barath,S.;Srinath,K.;Gautam,P. Analytical Sciences 2011,27(1),101.
(9) Marina,K.K.;Hazel,A.C.;Milan,B.;Emma,D.;James,A.L.; Nicolas,S.;Klaus,S.;Mikhail,D.;Nikolay,S.M.;Aleksander, R.;Harry,L.A.;David,P.Org.Biomol.Chem.2009,7,889.
(10) Zhou,B.;Zhang,Z.;Zhang,Y.;Li,R.;Xiao,Q.;Liu,Y.;Li,Z. Y.Journal of Pharmaceutical Sciences 2009,98(1),105.
(11) Lü,Y.Y.;Zhai,Q.G.;Li,X.;Chen,W.X.Chinese Journal of Spectroscopy Laboratory 2010,27(3),1168.[吕艳阳,翟秋阁,李 雪,陈伟霞.光谱实验室,2010,27(3),1168.]
(12) Hu,Z.Z.;Chen,F.Chemical World 2010,51(9),527.[胡珍珠,陈 芳.化学世界,2010,51(9),527.]
(13) Wang,D.;Cheng,X.L.;Shi,Y.H.Solid State Sciences 2009,11 (1),195.
(14) Jiang,G.F.;Gao,F.;Zhang,M.S.;Liu,C.;Guo,C.C.Chem.J. Chin.Univ.2008,29(9),1724. [江国防,高 峰,张满生,刘 畅,郭灿城.高等学校化学学报,2008,29(9),1724.]
(15) Cheng,X.L.;Chen,Z.X.;Sun,E.J.;Shi,Y.H.;Shi,T.S. Chem.J.Chin.Univ.2007,28(3),402.[程秀利,陈正霞,孙二军,师宇华,师同顺.高等学校化学学报,2007,28(3),402.]
(16)Wang,S.J.;Peng,Y.L.;Zhou,X.W.Chin.J.Inorg.Chem. 2010,26(5),793. [王树军,彭玉苓,周学文.无机化学学报, 2010,26(5),793.]
(17) Feng,X.T.;Yu,J.G.;Lei,M.;Fang,W.H.;Liu,S.B.J.Phys. Chem.B 2009,113(40),13381.
(18) Patrik,R.;Lars,O.J.Phys.Chem.A 2009,113(43),11949.
(19) Yang,M.M.;Yang,P.;Zhang,L.W.Chinese Science Bulletin 1994,39(1),31 [杨曼曼,杨 频,张立伟.科学通报,1994, 39(1),31.]
(20) Wang,S.J.;Zang,N.;Ruan,W.J.;Zhu,Z.A.Acta Phys.-Chim. Sin.2008,24(3),507.[王树军,臧 娜,阮文娟,朱志昂.物理化学学报,2008,24(3),507.]
(21) Gouterman,M.J.Chem.Phys.1959,30,1139.
(22) Sun,E.J.;Wang,D.;Cheng,X.L.;Shi,Y.H.;Shi,T.S.Chem. J.Chin.Univ.2007,28(7),1208.[孙二军,王 栋,程秀利,师宇华,师同顺.高等学校化学学报,2007,28(7),1208.]
(23) Zhang,C.F.;Sun,Y.Y.;Wang,Y.F.;Shi,J.H.;Shi,Y.H.;Shi, T.S.Acta Chimical Sinica 2010,68(22),2319.[庄长福,孙园园,王运方,石建慧,师宇华,师同顺.化学学报,2010,68(22), 2319.]
(24) Yi,P.G.;Yu,X.Y.;Zhang,J.;Zheng,B.S.;Huang,H.W.; Zeng,Y.L.;Chen,Z.Acta Chimical Sinica 2008,66(20),2203. [易平贵,于贤勇,张 峻,郑柏树,黄昊文,曾云龙,陈 忠.化学学报,2008,66(20),2203.]
(25) James,P.C.;Miroslav,R.;Martin,B.J.Am.Chem.Soc.1999, 121(6),1387.
(26) Christopher,A.H.;Robert,K.H.Angew.Chem.Int.Edit.1996, 35(17),1936.
(27) Everly,B.F.;Amy,M.S.Inorg.Chem.1991,30,3763.
(28)Wang,S.J.;Luo,D.B.;Ruan,W.J.;Zhu,Z.A.;Ma,Y.Acta Phys.-Chim.Sin.2005,21(8),834.[王树军,罗代兵,阮文娟,朱志昂,马 毅.物理化学学报,2005,21(8),834.]
(29) Zhang,Y.;Yan,X.L.;Lei,Y.C.;Shen,X.F.;Pan,J.H.;Liu,D. S.Spectroscopy and Spectral Analysis 2005,25(8),1274. [张 勇,燕新梁,雷亚春,沈晓芳,潘景浩,刘滇生.光谱学与光谱分析,2005,25(8),1274.]
(30) Ross,D.P.;Sabramanian,S.Biochemistry 1981,20,3096.
November 29,2011;Revised:February 1,2012;Published on Web:February 22,2012.
Synthesis of Tailed Porphyrin Modified with Nicotinic Acid and Interactions with Human Serum Albumin
PENG Yu-Ling WANG Shu-Jun*FU Li ZHANG Cheng-Gen LIU Xin-Gang
(College of Chemistry&Material Science,Langfang Teachers College,Langfang 065000,Hebei Province,P.R.China)
Free porphyrins,namely o-(niacin)C2O-T(3p-OCH3)PP and p-(niacin)C2O-T(3p-OCH3)PP,their complexes,o-(niacin)C2O-T(3p-OCH3)PPZn and p-(niacin)C2O-T(3p-OCH3)PPZn modified with nicotinic acid,were designed,synthesized,and characterized by elementary analysis,and UV-Vis,1H nuclear magnetic responance(1H NMR),and infrared(IR)spectroscopies.The conformations of the Zn porphyrins were calculated using a quantum-chemical method.The experimental results showed the following.It was found that the nicotinic acid group was on the porphyrin plane in o-(niacin)C2O-T(3p-OCH3)PPZn and Zn―N intramolecular coordination interactions which existed between the N atom of the nicotinic acid group in the side-chain and the Zn2+in the porphyrin plane.The nicotinic acid group was far from the porphyrin plane in p-(niacin)C2O-T(3p-OCH3)PPZn and Zn―N intermolecular coordination interactions which existed between the N atom of the nicotinic acid group in one Zn porphyrin and the Zn2+in the other porphyrin plane.The fluorescence properties of the interactions between Zn porphyrins and human serum albumin (HSA)were studied using fluorescence spectroscopy.There is a large quenching interaction between the Zn porphyrins and human serum albumin.The mechanism of the combination reaction is hydrogen bonding or van der Waals interactions between the Zn porphyrins and human serum albumin.The fluorescence quenching data were analyzed using the Stem-Volmer equation and a double-reciprocal equation,and the quenching constant,binding constant,and thermodynamic parameters were obtained.
Nicotinic acid;Zn porphyrin;Human serum albumin;Fluorescence quenching; Thermodynamic parameter
10.3866/PKU.WHXB201202222
∗Corresponding author.Email:d022036@mail.nankai.edu.cn;Tel:+86-13930694702.
The project was supported by the Natural Science Foundation of Hebei Province,China(B2010001803)and Specialized Research Fund for the Program of Langfang Teachers College,China(LSZZ201003).
河北省自然科学基金(B2010001803);廊坊师范学院科学研究项目重点专项基金(LSZZ201003)资助
O641;O621.22;O621.24
