Pt/TiO2光催化甲烷重整水气制氢
2012-12-21李曹龙上官文峰
李曹龙 陈 威 袁 坚 上官文峰,*
(1上海交通大学燃烧与环境技术中心,上海200240;2中国药科大学基础部无机化学教研室,南京211169)
Pt/TiO2光催化甲烷重整水气制氢
李曹龙1,2陈 威1袁 坚1上官文峰1,*
(1上海交通大学燃烧与环境技术中心,上海200240;2中国药科大学基础部无机化学教研室,南京211169)
在室温下以太阳能替代传统的高温高压热反应条件,在固定床装置中实现连续动态光催化甲烷重整水气(PSRM)制氢反应:CH4+2H2O(g)→4H2+CO2.产物的主成分是H2和CO2,同时检测到微量或痕量的C2H6、C2H4和CO.重点考察了以光沉积法负载Pt的TiO2(p-Pt/TiO2)为光催化剂,该反应体系在不同CH4/H2O进料摩尔比、进料的总流速、光照波长、催化剂用量以及贵金属的负载方式等的实验条件对氢气产率的影响.最优化的反应条件为:CH4/H2O进料摩尔比为4;进料总流速为0.5 mL·min-1;光沉积负载要优于浸渍法;相同的负载方式Pd和NiOx为比较优异的助催化剂;最佳催化剂用量为20 mg·cm-2.最后循环实验结果表明,p-Pt/TiO2及反应体系都具有比较高的稳定性.
光催化重整;氢气;甲烷;水气;TiO2
1 引言
基于环境保护和能源的可持续发展考虑,以可再生资源生产氢能是一个具有发展潜力的新途径. 1972年Honda-Fujishima效应1的发现,揭开了光催化分解水制氢气的序幕.Sakata和Kawai2报道从混有牺牲剂的水中更能有效地产生氢气.牺牲剂主要是一些含碳的固体物质(活性碳、2糖、淀粉、纤维素、3焦炭、柏油沙4)和含碳的化学物质(MeOH、5EtOH、6C2H4、7CO、8甘油9).虽然EtOH、糖、淀粉、纤维素被认为是可再生资源,但到目前为止还没有系统的实际应用.
在众多的牺牲剂中,以甲烷(CH4)作为牺牲剂光解水产氢很少有报道.甲烷在自然界中分布很广,是天然气、沼气、油田气及煤矿坑道气的主要成分.10CH4是所有碳氢化合物中H/C比最高的物质.目前全球氢产量中的相当一部分来自于天然气和水的重整制氢.然而,甲烷-水(水气)重整反应是一个强吸热反应,即便是在催化剂作用下也要在750-920°C的高温下反应才能进行,能耗极高.近来,日本Yoshida小组11-15在研究CH4作为牺牲剂光解水产氢时对不同的反应产物进行检测,发现生成物中H2/CO2的摩尔比大约为4,与传统的甲烷-水气热重整反应计量比一致,说明该热重整反应可以通过光催化得以实现.因此,光催化甲烷水气重整(PSRM)制氢是从可再生资源及自然能源中提取氢气的一项具有前景的氢能源技术,反应式如下:
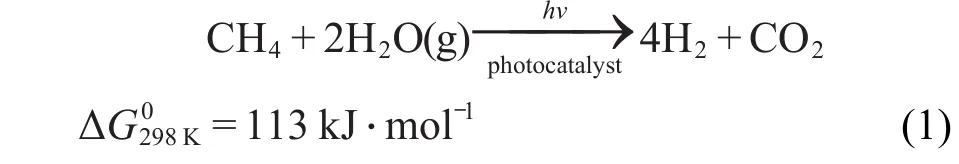
本文研究了以光沉积法负载Pt的TiO2(p-Pt/ TiO2)为光催化剂,在固定床装置中连续动态条件下甲烷重整水气制氢反应.同时考察了不同参数和实验条件对氢气产率的影响,以期得出最优化的实验条件.
2 实验
试剂:所有试剂均为分析纯.P25(TiO2,德国,德固赛公司);氯铂酸(H2PtCl6·6H2O,上海化学试剂一厂);醋酸钯(Pd(O2CCH3)2,上海诚心化工有限公司);氯铑化钠(Na3RhCl6,国药集团化学试剂有限公司);氯化钌(RuCl3·3H2O,国药集团化学试剂有限公司);氯金酸(HAuCl4·4H2O,国药集团化学试剂有限公司).
以Pt/TiO2为光催化剂的制备:(1)将P25粉末浸渍在氯铂酸溶液中,通过光沉积法制备负载Pt的质量分数为0.3%的p-Pt/TiO2光催化剂;(2)负载不同贵金属量为1%的Ag(Ru,Pd,Pt,Au,Rh)/TiO2制备:①将P25粉末分别浸渍在不同贵金属前驱物溶液中,搅拌30 min后烘干;②300°C条件下50%(体积分数)H2/He混合气氛中还原2 h,得到还原法制备的贵金属负载P25光催化剂;(3)NiOx含量为1%的NiOx/TiO2催化剂的制备:① 将P25粉末浸渍在Ni(NO3)2溶液中,搅拌30 min后烘干;②350°C空气气氛中焙烧1 h;③400°C条件下50%(体积分数) H2/He混合气氛中还原2 h,冷却至室温;④200°C条件下50%(体积分数)O2/Ar混合气氛中氧化2 h,制备出NiOx负载P25光催化剂;(4)RuO的质量分数为1%的RuO/TiO2制备:将P25粉末浸渍Ru盐溶液中,搅拌30 min后烘干,在400°C空气气氛中焙烧4 h.
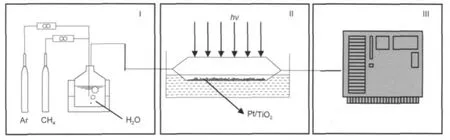
图1 连续式光催化重整甲烷-水气制氢评价示意图Fig.1 Sketch of the experimental set up for photocatalytic steam reforming of methaneI:feeding system,II:photo-catalyzed reaction equipment,III:production detection part
连续式光催化重整甲烷-水气制氢评价装置见图1.该套测试装置包括三个部分:I为供料系统, CH4由气瓶提供,水气发生器提供水气,混合反应物的流量由质量流量计调节;II为光催化反应装置,催化剂平铺在石英反应器底部,光源由上部照到催化剂表面,反应器用水冷却;III为产物检测部分,由在线气相色谱仪分析产物组成及其产量.气体产物从反应器中流入自动取样器中被Ar带出,进入色谱的碳分子筛TDX-01填充柱分离,然后进入热导检测器(TCD),测H2、O2和N2的含量.从TCD出来的气体和高纯氢气混合后,一起进入甲烷转化器,将CO、CO2转化成甲烷,最后进入氢火焰离子化检测器(FID)检测甲烷含量,从而测定CO、CO2的含量.不同气体产物的检测灵敏度(体积分数)大约是:H2,≥100×10-6;C2H6、C2H4、CH4,≥1×10-6;CO、CO2,≥2× 10-6.光催化甲烷水蒸气重整制氢反应是在一个连续式固定床系统中进行.光催化反应前,通入Ar气对系统进行排空处理,除去系统中的空气.光催化反应在接近室温条件下进行.反应过程中通过控制水气发生器的温度,改变水的饱和蒸气压,获得不同的反应物的摩尔比,使得进料配比可以调节.
3 结果与讨论
3.1 光催化反应
图2为光催化重整甲烷-水气制氢反应产物随时间的变化曲线图.从图2可以看出,开始反应时H2和CO2产率都比较低,而且波动比较大,随着反应时间的延长,产率都增大,1200 min后趋于稳定,氢气产率可达0.13 μmol·min-1,CO2产率可达0.07 μmol· min-1,H2/CO2摩尔比基本稳定在1.8,相比方程(1)的理论化学计量比4要低.另外还检测到微量或者痕量的C2H6、C2H4和CO存在,说明该体系中反应式(1)是主反应,同时还存在其它的竞争反应.
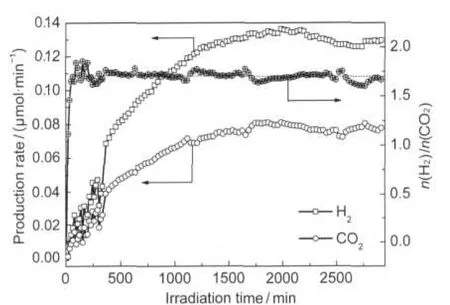
图2 产物的产率及H2/CO2摩尔比随时间的变化曲线Fig.2 Time course of the production rate and the molar ratio of H2/CO2catalyst:p-Pt/TiO2;total flow rate of materials:0.5 mL·min-1; n(CH4)/n(H2O)=13;λ>200 nm
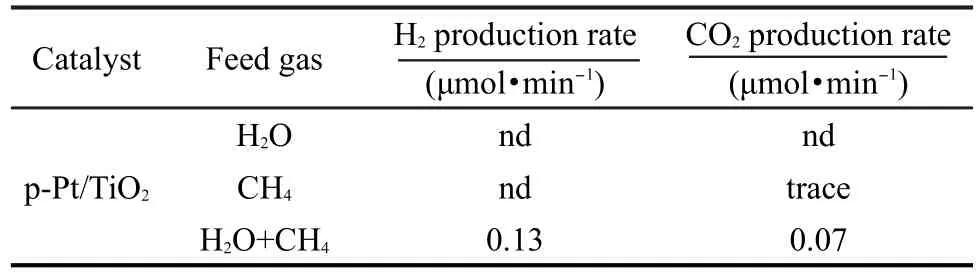
表1 不同进料条件下的氢气产率Table 1 H2production rate in various feed gas conditions
为了验证CH4在该催化反应中的作用,不同的进料下氢气的产率结果见表1.如果只有水气进入光反应器中,没有检测到(用nd表示)H2与CO2存在;进气只有CH4,只能检测到微量CO2和C2H6.微量的C2H6可能来自光催化甲烷偶联反应.16,17结合上面的结果可以看出,CH4的加入促进了光分解水反应,使得重整甲烷-水气制氢反应通过光催化也能得以实现,且热力学上该反应的吉布斯自由能也比水分解的低.
3.2 CH4/H2O摩尔比对氢气产率的影响
不同CH4/H2O进料摩尔比对氢气产率的影响随时间的变化曲线见图3.由图3可以看出不同的进料比对氢气产率有很大的影响,但氢气产率随时间的变化趋势基本一致,都是渐渐增加,最后基本达到稳定.随着CH4/H2O进料摩尔配比减小,氢气产率提高,说明H2O量的增加促进反应向右进行,有利于氢气的生成.另外,发现CH4量对副产物CO和C2H6影响很大,高浓度会促进CO生成,降低C2H6生成.再结合图4的氢气产率和H2/CO2比值随进料摩尔比变化的曲线,当CH4/H2O进料摩尔比为4时对应的H2/ CO2比值和氢气产率为最高,故可以认为CH4/H2O进料摩尔比为4时最优.
3.3 总流速对氢气产率的影响
图5给出了总进料流速对氢产率的影响随时间的变化曲线.
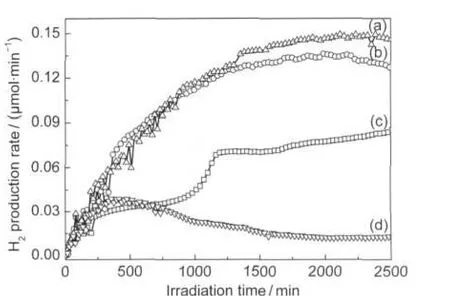
图3 不同CH4/H2O进料摩尔比对氢气产率的影响随时间的变化曲线Fig.3 Time course of H2production rate in various molar ratio of CH4/H2On(CH4)/n(H2O):(a)1,(b)4;(c)43,(d)13;catalyst:p-Pt/TiO2; total flow rate of materials:0.5 mL·min-1,λ>200 nm
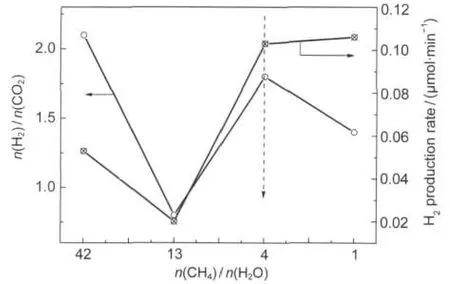
图4 CH4/HO2的进料摩尔比对氢气产率和生成物H2/CO2摩尔比的影响Fig.4 Effect of molar ratio of CH4/H2O on H2production rate and molar ratio of H2/CO2
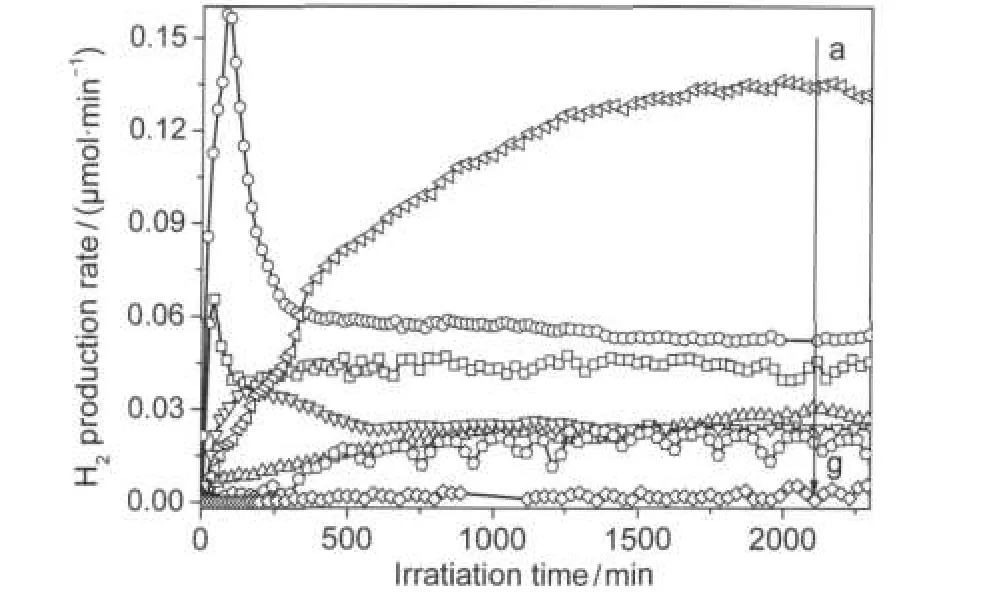
图5 不同流速对氢气产率的影响随时间的变化曲线Fig.5 Time course of H2production rate in various flow ratesflow rate/(mL·min-1):(a)0.5,(b)5,(c)10,(d)2.5,(e)1, (f)0.2,(g)0.05;catalyst:p-Pt/TiO2;n(CH4)/n(H2O)=13;λ>200 nm
从a→g对应的流速分别为0.5、5、10、2.5、1、0.2和0.05 mL·min-1.不同流速下氢气产率随时间的变化趋势一致:先增加,反应一段时间达到平衡.但流速为0.05和0.2 mL·min-1时,氢气产率波动很大,可能由流速太低固定床系统不稳定导致.而流速为5和10 mL·min-1时,氢气开始快速增加再回落达到平衡,可能由于高流速使产生的氢气很快从催化剂表面脱附.
反应物与催化剂的接触时间为流速的倒数,即流速越大,接触时间越短,因此反应时间缩短,反应物还来不及进行反应就离开了催化剂,从而使得氢气产率下降;在较低流速下,反应物与催化剂表面形成的边界层较厚,传质速率较低,反应受气固间传质所控制,使得氢气产率下降.综合图6氢气产率和H2/CO2摩尔比随总流速的变化曲线,流速为0.5 mL·min-1时对应的氢气产率和H2/CO2比值最佳.
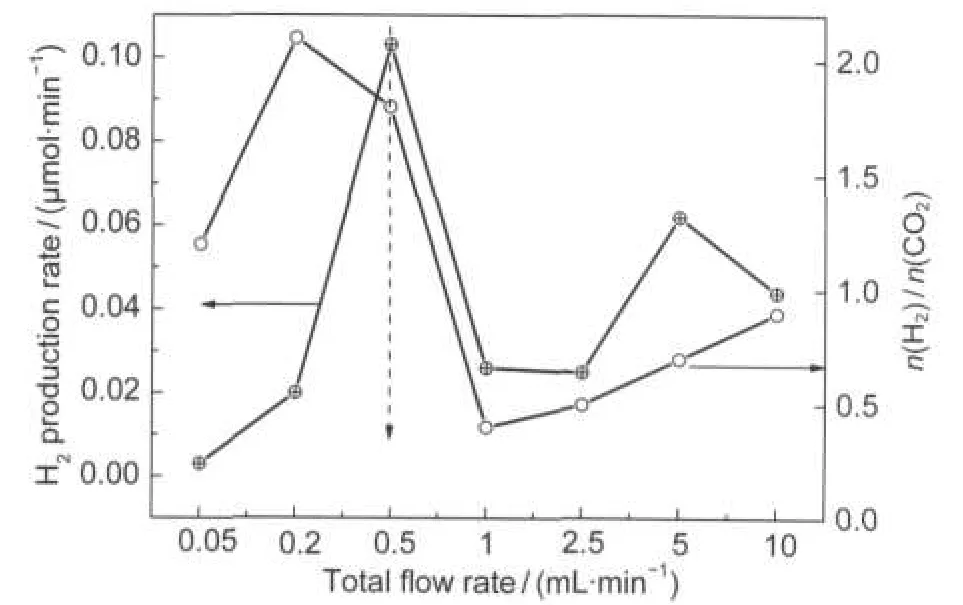
图6 总流速对氢气产率和生成物H2/CO2摩尔比的影响Fig.6 Effect of the total flow rate on H2production rate and molar ratio of H2/CO2
3.4 助催化剂的影响
为了研究助催化剂对光催化重整甲烷-水气制氢反应的影响,制备了不同的贵金属和金属氧化物负载在P25上的光催化剂.助催化剂对重整反应影响很大,结果见图7.以Ru和Rh为助催化剂时基本检测不到H2存在,Ru/TiO2的副产物CO比较大,有意义的是C2H4的产率随着反应时间的延长逐渐提高,而C2H6变化规律是缓慢提高,当C2H4降到最低达到平衡时,C2H6也趋于平衡,可以推测在Ru作为助催化剂时,主要的反应可能是光催化非氧化偶联反应.18Ag、Pt为助催化剂时,发现氢气的产率很低,相对于光沉积负载Pt而言,要低于3个数量级,说明助催化剂负载的方式影响很大,光还原法能使金属Pt颗粒粒径比较小而且均匀分散在TiO2表面,能够有效地获得TiO2导带上的光生电子.12浸渍还原法导致金属Pt颗粒团聚,粒径变大且不均匀分散在TiO2表面,故光沉积负载贵金属方式优于浸渍还原法.
Pd作为助催化剂时,氢气的产率最高,重要的是没有产生使催化剂中毒的CO,可能与Pd对甲烷的强吸附相关.对于贵金属单质而言,氢气的产率大小顺序为Pd>Au>Pt≈Ag>Rh、Ru,这一规律与文献19报道光催化重整生物质葡萄糖基本一致.NiOx和RuO2作为助催化剂时,氢气的产率相近,相对于Pt来说要高2个数量级,生成C2H4的竞争反应对整个光催化反应的贡献比较大.另外,在浸渍还原法制备的所有光催化剂中发现生成物H2/CO2的摩尔比远小于主反应的化学计量比4.可推测不同的助催化剂下,存在以下反应和主反应间的竞争:

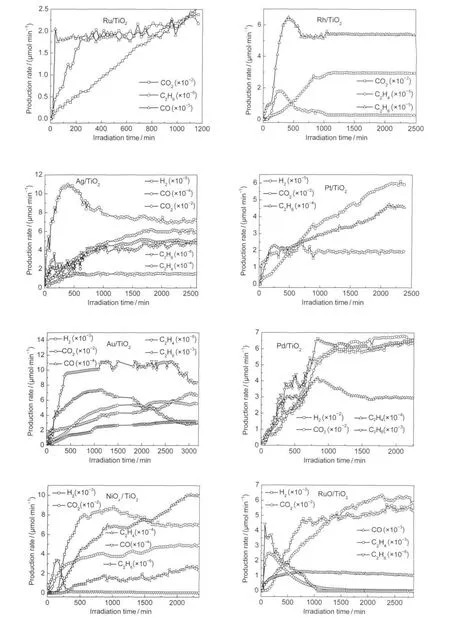
图7 助催化剂的影响Fig.7 Effect of co-catalysts
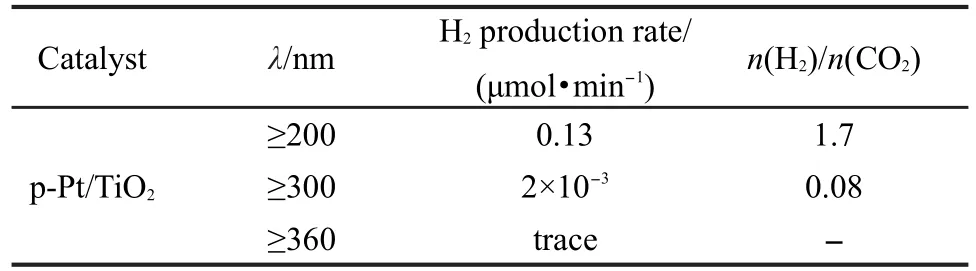
表2 入射光波长对氢气产率的影响Table 2 Effect of irradiation light wavelength on H2production rate
3.5 入射光波长对氢气产率的影响
入射光波长对氢气产率的影响如表2所示.本实验的光源是300 W紫外加强氙灯.通过滤波片把小于360 nm波长的光滤去,结果只有痕量的H2和CO2产生,说明大于360 nm波长的光不能促进光催化重整甲烷-水气制氢反应进行.而滤去波长小于300 nm的光,反应稳定后氢气的产率约为2×10-3μmol·min-1,生成物H2/CO2摩尔比只有0.08,说明主反应在大于300 nm波长的竞争反应中所占比例很小.大于200 nm波长光照射时氢气的产率可以达到0.13 μmol·min-1,H2/CO2摩尔比可达1.7.故重整反应起到激发作用的光的波长主要在200-300 nm之间,且小于TiO2紫外-可见光吸收边(380 nm),说明p-Pt/TiO2起到了光催化作用.
3.6 催化剂量对氢气产率的影响
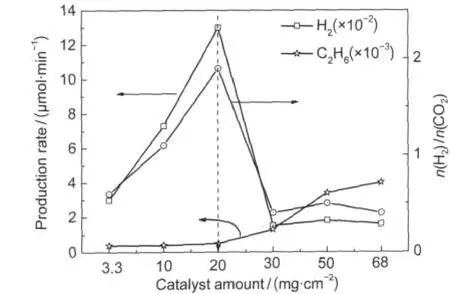
图8 催化剂用量对氢气产率和生成物H2/CO2摩尔比的影响Fig.8 Effect of amount of catalyst on H2production rate and molar ratio of H2/CO2catalyst:p-Pt/TiO2;total flow rate of materials:0.5 mL·min-1; n(CH4)/n(H2O)=13,λ>200 nm
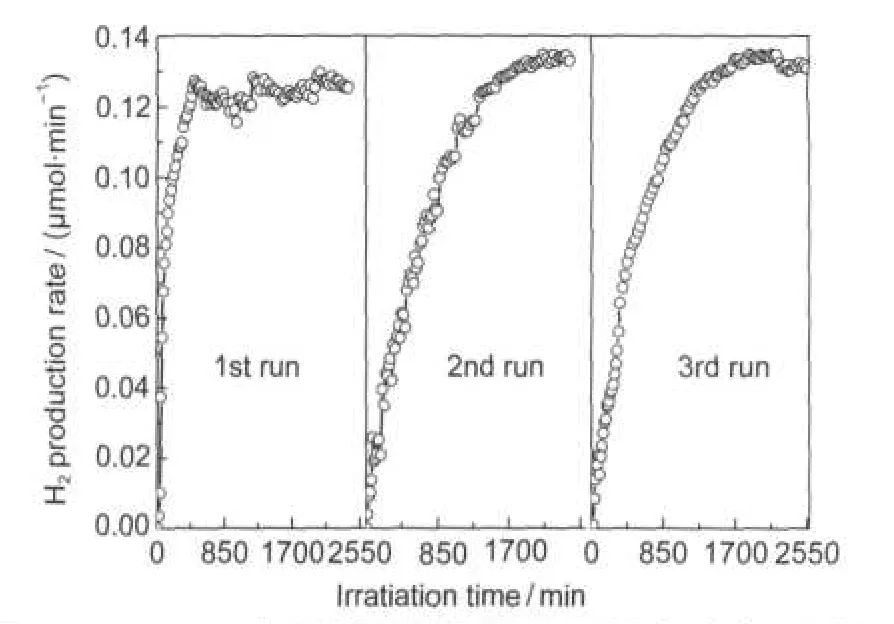
图9 p-Pt/TiO2光催化剂的循环使用对氢气产率的影响Fig.9 Recycling efficiency of the p-Pt/TiO2photocatalyst on H2production ratecatalyst:p-Pt/TiO2;total flow rate of materials:0.5 mL·min-1; n(CH4)/n(H2O)=13;λ>200 nm
图8为催化剂用量对氢气产率的影响.固体床反应器是底面60 nm×50 nm平底石英反应器,催化剂平铺在底面上.随着催化剂的用量增加氢气产率提高,催化剂的量为20 mg·cm-2时达最大,再随催化剂量增加氢气产率减小,基本保持稳定.H2/CO2摩尔比与氢气产率有相同的变化趋势.可以认为随催化剂量的增加光照面积也增大,相同量的反应物和催化剂的接触点增多,同样光催化活性位也增多,故氢气产率增大.但是催化剂用量的进一步增加不能继续提高氢气产率,原因主要为光在催化剂表面的照射深度达到了极限值.当催化剂的用量达到30 mg·cm-2以后,发现氢气的产率反而下降到基本保持一个稳定值.这一现象可能是由于催化剂量的增加,催化剂表面的水气冷凝,气固两相反应变成了多相反应.副产物C2H6随着催化剂用量的增加逐渐增大,再趋于稳定.由于CH4不会在催化剂表面冷凝,光催化甲烷偶联竞争反应比重增大.故最优催化剂用量为20 mg·cm-2.
3.7 催化剂的循环使用对氢气产率的影响
本文对光催化重整甲烷-水气制氢反应所采用的p-Pt/TiO2催化剂进行重复使用,所得结果见图9.
在催化剂重复使用实验中,每次实验达到平衡后继续反应到2550 min后关灯,色谱继续测试出口端氢气浓度的变化,一直到检测不到氢气为止,再开灯继续下一轮实验.由图9可见,该催化体系具有良好的稳定性.虽然第二轮和第三轮反应平衡时间相对于第一轮反应要长,但随着催化剂重复使用次数的增加,反应达平衡后氢气的产率并未受到明显的影响,这表明催化剂的稳定性很好,具有较好的应用前景.
4 结论
研究了以光沉积法负载Pt的TiO2(p-Pt/TiO2)为光催化剂,室温下在固定床装置中实现连续动态光催化甲烷重整水气制氢反应CH4+2H2O(g)→4H2+ CO2,并考察了不同的实验参数对反应的影响,得出最优化的实验条件.p-Pt/TiO2的催化活性要优于浸渍法负载Pt的TiO2催化剂,相同的浸渍法负载不同的助催化剂时,其中以Pd和NiOx为比较优异的助催化剂.另外,以p-Pt/TiO2为催化剂时,CH4/H2O进料摩尔比为4时,产物中氢气产率及H2/CO2摩尔比值达到最高;0.5 mL·min-1的总流速为最佳进料流速;对主反应起到激发的主要波长在200-300 nm之间;固定床装置的最佳催化剂用量为20 mg·cm-2.最后循环实验结果表明p-Pt/TiO2及反应体系都具有比较高的稳定性.
(1) Fujishima,A.;Honda,K.Nature 1972,238,37.
(2) Sakata,T.;Kawai,T.Nature 1979,282,283.
(3) Li,Y.X.;Gao,D.;Peng,S.Q.;Lu,G.X.;Li,S.B.Int.J. Hydrog.Energy 2011,36,4291.
(4) Luo,N.J.;Jiang,Z.;Shi,H.H.;Cai,F.H.;Xiao,T.C.; Edwards,P.P.Int.J.Hydrog.Energy 2009,34,125.
(5) Chiarello,G.L.;Forni,L.;Selli,E.Catal.Today 2009,144,69.
(6) Strataki,N.;Bekiari,V.;Kondarides,D.I.;Lianos,P.Appl. Catal.B 2007,77,184.
(7) Sato,S.;White,J.M.Chem.Phys.Lett.1980,70,131.
(8) Sato,S.;White,J.M.J.Catal.1981,69,128.
(9) Bowker,M.;Philip,R.D.;Al-Mazroai,L.S.Catal.Lett.2009, 128,253.
(10) Geert,L.;Anne,B.T.;Luc,D.B.;Willy,V.;Birgitte,K.A. Environ.Sci.Technol.2004,38,3418.
(11) Shimura,K.;Yoshida,H.Energy Environ.Sci.2010,3,615.
(12) Yoshida,H.;Hirao,K.;Nishimoto,J.;Shimura,K.;Kato,S.; Itoh,H.;Hattori,T.J.Phys.Chem.C 2008,112,5542.
(13) Shimura,K.;Kato,S.;Yoshida,T.;Itoh,H.;Hattori,T.;Yoshida, H.J.Phys.Chem.C 2010,114,3493.
(14) Yoshida,H.;Kato,S.;Hirao,K.;Nishimoto,J.I.;Hattori,T. Chem.Lett.2007,36,430.
(15) Shimura,K.;Yoshida,T.;Yoshida,H.J.Phys.Chem.C 2010, 114,11466.
(16)Yuliati,L.;Yoshida,H.Chem.Sco.Rev.2008,37,1592.
(17) Yuliati,L.;Hamajima,T.;Hattori,T.;Yoshida,H.J.Phys. Chem.C 2008,112,7223.
(18) Yuliati,L.;Hattori,T.;Itoh,H.;Yoshida,H.J.Catal.2008,257, 396.
(19) Fu,X.L.;Long,J.L.;Wang,X.X.;Fu,X.Z.Int.J.Hydrog. Energy 2008,33,6484.
August 5,2011;Revised:December 6,2011;Published on Web:December 14,2011.
Hydrogen Evolution by Photocatalytic Steam Reforming of Methane over Pt/TiO2
LI Cao-Long1,2CHEN Wei1YUAN Jian1SHANGGUAN Wen-Feng1,*
(1Research Center for Combustion and Environment Technology,Shanghai Jiao Tong University,Shanghai 200240,P.R.China;2Department of Inorganic Chemistry of Basic Courses,China Pharmaceutical University,Nanjing 211169,P.R.China)
Photocatalytic reaction of CH4gas with H2O vapor over Pt/TiO2at around room temperature(ca 323 K)was examined in a flow reactor.H2and CO2were the main products,and only trace amounts of C2H6,C2H4,and CO were observed.After an induction period,the molar ratio of H2to CO2in the outlet gas became close to 1.7.Thus,the main reaction is suggested to be:CH4+2H2O(g)→4H2+CO2,which can be referred to as photocatalytic steam reforming of methane(PSRM).The reaction would be promoted by photoexcited electrons and holes,which were generated by band gap photoexcitation of the TiO2photocatalyst.In addition,the effects of reaction parameters,such as molar ratio of CH4to H2O,total flow rate,noble-metal cocatalysts,wavelength of irradiating light,amounts of catalysts,and recycling efficiency of the p-Pt/TiO2photocatalyst via light deposition of preformed Pt nanoparticles on P25,on the hydrogen evolution were investigated.
Photocatalytic reforming;Hydrogen;CH4;Steam;TiO2
10.3866/PKU.WHXB201112141
*Corresponding author.Email:shangguan@sjtu.edu.cn;Tel:+86-21-34206020.
The project was supported by the National Natural Science Foundation of China(20973110)and National Key Basic Research Program of China(973) (2009CB220000).
国家自然科学基金(20973110)及国家重点基础研究发展规划项目(973)(2009CB220000)资助
O643
