从2AlCl3/Et3NHCl离子液体中电沉积制备Ni和Ni-Al合金
2012-12-21高丽霞王丽娜
高丽霞 王丽娜 齐 涛,* 余 江
(1中国科学院过程工程研究所,湿法冶金清洁生产技术国家工程实验室,北京100190; 2北京化工大学化学工程学院,环境科学与工程系,北京100029)
从2AlCl3/Et3NHCl离子液体中电沉积制备Ni和Ni-Al合金
高丽霞1,2王丽娜1齐 涛1,*余 江2,*
(1中国科学院过程工程研究所,湿法冶金清洁生产技术国家工程实验室,北京100190;2北京化工大学化学工程学院,环境科学与工程系,北京100029)
在含Ni2+的2AlCl3/Et3NHCl离子液体中的铜电极上通过恒电位电沉积制备出金属Ni和Ni-Al合金.采用循环伏安和计时电流方法,揭示铜电极上沉积金属Ni的成核机理,研究了电沉积Ni-Al合金的机理,以及恒电位沉积Ni-Al合金工艺条件对沉积Ni-Al合金表面形貌和电流效率的影响.结果表明:在铜电极上电沉积金属Ni的成核机理为受扩散控制的三维瞬时成核过程.在电量≥3.0 C时,电沉积Ni-Al合金的组成基本不再变化. Ni-Al合金的电沉积机理为,Ni的电沉积受扩散控制,同时进行Al的欠电位沉积,在Ni-Al合金电沉积过程中某些Ni-Al合金相的沉积可能受动力学限制而使Ni-Al合金的组成偏离热力学预测结果.在电沉积Ni-Al合金的沉积电流小且平稳,电沉积速率慢条件下,Ni-Al合金表面形貌致密均一,反之就会出现瘤节.电沉积Ni-Al合金的电流效率>90%.电沉积物的组成接近于Ni3Al合金.
离子液体;AlCl3/Et3NHCl;恒电位;电沉积;镍铝合金
1 引言
Ni-Al合金(例如Ni3Al)具有熔点高(1385°C)、抗腐蚀性高、高温抗氧化性强、机械性能好等优良性能,航空航天领域采用热喷涂技术1将Ni-Al合金(丝状或粉状)喷涂到飞机尾喷管等部位形成可磨耗涂层,但该项技术需先制备出Ni-Al合金丝或Ni-Al合金粉,而Ni-Al合金粉是采用包覆法2,3制备,再采用高温喷涂方法对飞机零部件进行喷涂形成Ni-Al合金涂层,工序复杂.
电沉积是制备合金的常用方法.但以水溶液为电解质进行电沉积,氢在铝沉积之前先释放出来,使得电沉积铝或者铝合金的过程变得复杂.因此,必须使用质子惰性的非水溶液或者熔盐体系来电沉积合金.现有文献报道所使用的无机氯铝熔盐,主要是酸性AlCl3-NaCl熔盐电沉积过渡金属-Al合金,如Cr-Al、4Mn-Al、5Ni-Al、6Nb-Al、7Ti-Al、8Al-Cr-Ni9等.但这种以碱金属氯化物为基础的氯铝熔盐存在缺点,即在高温下会因Al2Cl6挥发而具有大的蒸汽压(>1.3×104Pa,154°C),而使其应用产生困难.相对于以上两种电解质,酸性氯化铝型离子液体可以在室温下操作,没有蒸汽压,而且具有大量可还原成金属铝的物种,即离子.使用酸性氯化铝型离子液体电沉积过渡金属-Al合金已有一些文献报道,如Ag-Al、10Co-Al、11-14Cr-Al、15Cu-Al、16,17La-Al、18Mo-Al、19Mn-Al、20Ti-Al、21,22Zr-Al、23Al-Mo-Ti、24Al-Mo-Mn25等.
如果采用离子液体电沉积技术直接将Ni-Al合金沉积到零部件的表面形成Ni-Al合金涂层,这样可以简化工序.由作者前期工作26可知,相对于其它氯化铝型离子液体,2AlCl3/Et3NHCl离子液体具有成本低、熔点低、电导率高的优势,故本论文进一步采用2AlCl3/Et3NHCl离子液体进行电沉积Ni-Al合金的研究,以探讨离子液体中电沉积Ni-Al合金应用于航空航天领域的耐热耐腐蚀的合金涂层的可能性.系统考察了电位、电流密度及Ni2+浓度对电沉积Ni-Al合金的组成及形貌的影响,并探讨了离子液体中电沉积Ni-Al合金的机理.
2 实验部分
2.1 原 料
无水三氯化铝(AlCl3),北京化学试剂公司,分析纯;三乙胺盐酸盐(Et3NHCl),国药集团化学试剂公司,化学纯;氯化镍(NiCl2·6H2O),北京化学试剂公司,分析纯.需经脱水干燥后使用;盐酸、硫酸、丙酮和苯等常用试剂购自北京化学试剂公司,分析纯.
2.2 离子液体合成
实验均在真空手套箱(ZKX2型,南京大学仪器厂)中进行.将Et3NHCl与无水AlCl3按摩尔比为1:2的比例分别准确称取.将Et3NHCl加入洁净的三口烧瓶中,在搅拌中将无水AlCl3分次缓慢加入,并在室温下搅拌30 min.其后将温度升到80°C,在此温度下连续搅拌约2-3 h,形成离子液体,冷却后为浅棕色液体,不需其它处理就可直接使用,置于手套箱中待用.
含Ni2+的离子液体就是将一定量的无水NiCl2加到一定量的2AlCl3/Et3NHCl离子液体中,在80°C下加热搅拌24 h,使其完全溶到离子液体中.
2.3 循环伏安和计时电流实验
使用三电极电解槽(聚四氟乙烯制),采用电化学工作站(IM6e electrochemistry workstation,ZAHNER eletrik,Germany)开展循环伏安和计时电流实验研究,电解质为含NiCl2的2AlCl3/Et3HCl离子液体.工作电极为直径0.40 mm的铜丝(99.95%),对电极为直径0.80 mm的镍环(99.95%),参比电极为直径0.50 mm的铂丝(99.95%).工作电极和对电极经金相砂纸打磨,用丙酮清洗,高纯水清洗处理.参比电极依次放在30%-50%硫酸溶液、2%-30%盐酸、水、丙酮和苯中清洗2-10 min.
2.4 Ni及Ni-Al合金的电沉积实验和表征
恒电位电沉积实验使用CMBP-1型双恒电位仪(江苏江分电分析仪器有限公司),电沉积时用磁力搅拌并保持恒定搅拌速度.电解槽和电解质同2.3节给出;工作电极为5 mm×6 mm铜片(99.9%),其处理方法同2.3节中工作电极的处理方法,非工作一面用环氧树脂封住;对电极和参比电极及其处理方法同2.3节.每次电沉积结束,工作电极用高纯水彻底清洗并晾干.用冷场发射扫描电子显微镜(JSM 6700F型,日本)测试样品形貌;用H-8100透射电子显微镜(日本)配DX-4能谱仪测试沉积Ni的纯度;合金的组成用ICP-OES(Perkin Elmer Optima 5300 DV,美国Perkin Elmer公司)测试.
电流效率(ηI)=96485×(沉积Al的摩尔量×3+沉积Ni的摩尔量×2)/电沉积电量×100%.
3 实验结果和讨论
3.1 循环伏安
图1为含0.10 mol·L-1NiCl2的2AlCl3/Et3NHCl离子液体在室温下铜电极上的一系列循环伏安图,考察了转换电位对循环伏安曲线的影响.转换电位Eb=-1.50 V时的CV曲线,只在-1.30 V处有一个还原峰C1,相应的只在-0.57 V处有一个氧化峰Pa3.由图1可知,纯离子液体的循环伏安曲线在C1处没有峰.另外,由表1的TEM结果可知,在-1.30 V下电沉积得到沉积物中Ni含量达到95.27%(x),电沉积物组成基本接近纯Ni,故还原峰C1为Ni2+还原为金属Ni,相应的氧化峰Pa3为沉积金属Ni的氧化峰.

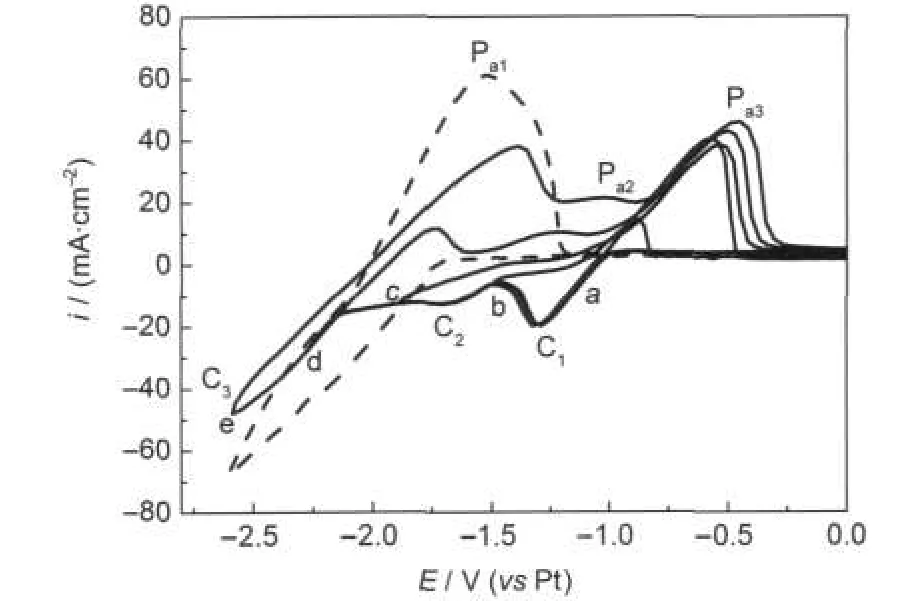
图1 含0.10 mol·L-1NiCl2摩尔比(m/o)为2:1的AlCl3-Et3NHCl(2AlCl3/Et3NHCl)离子液体在室温下转换电位对循环伏安曲线的影响Fig.1 Effectof switching potentialon the cyclic voltammogramsin2:1molarratio(m/o)AlCl3-Et3NHCl containing0.10mol·L-1NiCl2at room temperature(—)ionic liquid containing 0.10 mol·L-1NiCl2,(--)pure ionic liquid;switching potential/V:(a)-1.10,(b)-1.50,(c)-1.90, (d)-2.30,(e)-2.60;working electrode:Cu;sweep rate:100 mV·s-1
随着转换电位负移,在-1.45--1.80 V出现了更加宽的还原峰C2,在此峰下选两个电位电沉积结果列于表2中,Al含量大于20%(x),故还原峰C2为Ni-Al合金沉积峰,相应的Pa2为沉积Ni-Al合金的氧化峰.沉积Ni-Al合金可用下面通式表示,其中0<x<1.
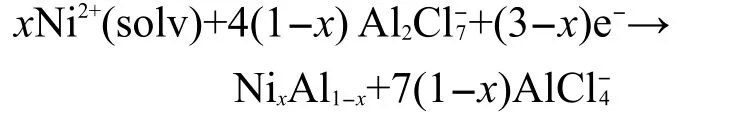
随着转换电位负移到小于-2.15 V,出现峰C3/Pa1,与图中纯离子液体2AlCl3/Et3NHCl在Cu电极上的循环伏安曲线上出现的峰位大致一致,故峰C3/Pa1为热力学可逆的氧化还原峰,即Al3+/Al.
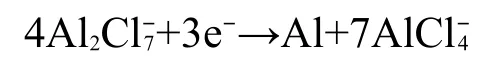
由于峰C2出现在峰C3之前,所以峰C2为Al的欠电位沉积形成的合金峰.
从图1中可看出,在含NiCl2的2AlCl3/Et3NHCl离子液体中,Al的沉积峰要比在纯2AlCl3/Et3NHCl离子液体中峰位更加负移.Ni2+在酸性离子液体中以非络合状态存在,27游离出的Cl-与结合生成反应如下:与比例的改变,导致Al的沉积电位比纯离子液体中更加负移,因为纯离子液体中几乎无存在.含NiCl2的离子液体中的减少及Ni-Al合金的沉积都会使纯Al电沉积受到抑制.
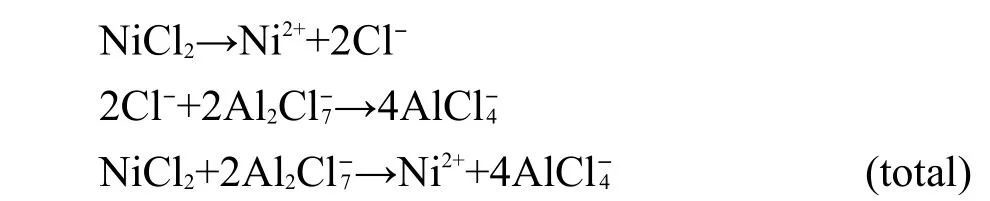
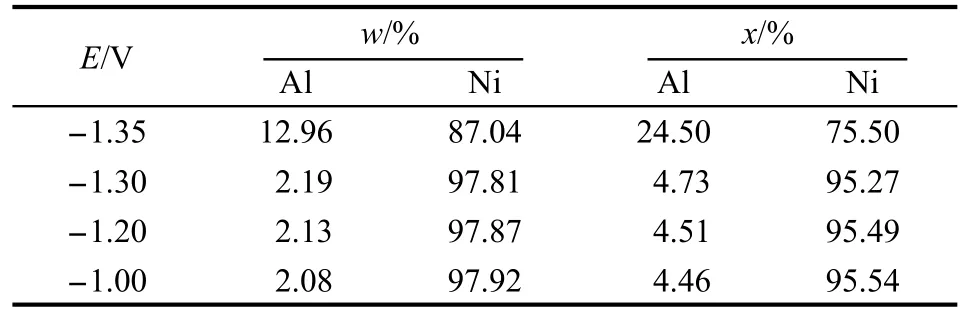
表1 电沉积含0.10 mol·L-1NiCl2的2AlCl3/Et3NHCl离子液体电沉积物质的TEM结果Table 1 TEM results of the electrodeposition in 2:1 molar ratio(m/o)AlCl3-Et3NHCl ionic liquid containing 0.10 mol·L-1NiCl2
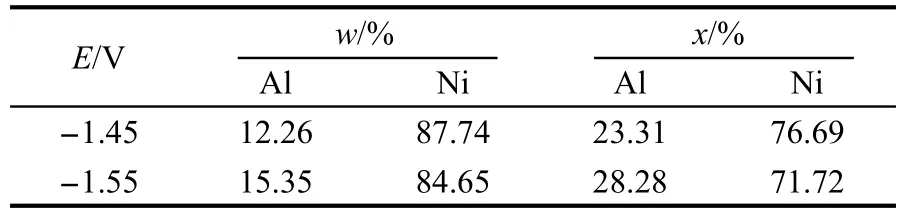
表2 电沉积含0.10 mol·L-1NiCl2的2AlCl3/Et3NHCl离子液体电沉积物质的电感耦合等离子体(ICP)结果Table 2 Inductively coupled plasma(ICP)results of the electrodeposition in 2:1 m/oAlCl3-Et3NHCl ionic liquid containing 0.10 mol·L-1NiCl2
3.2 Ni的电沉积
由表1和表2可知,在含0.10 mol·L-1NiCl2的2AlCl3/Et3NHCl离子液体中进行电沉积,当沉积电位≥-1.30 V时,电沉积物中Al含量只有4%(x)左右,可认为是接近纯金属Ni.为研究金属Ni的结晶过程速率及机理,在此含Ni的离子液体中进行计时电流实验,从没有Ni电沉积反应发生的电位阶跃到足以使Ni晶核生长的电位,图2为不同电位下瞬时电流密度随时间的变化趋势.瞬态电流最初减小,是电极双电层充电;接着电流增大,由于独立Ni晶核生长和/或晶核数量增加会造成电活性区域增大,从而使电流增大.在晶核生长阶段,晶核在自己的周围发展成半球形扩散区域,随着这些区域叠加,半球形物质扩散区域变成线性物质扩散,达到现有的有效电极表面,从而电流经过最大值(im,tm),随着电位负移,im增大,tm减小.
电沉积金属三维成核过程的两个边界过程,三维瞬时成核过程和三维连续成核过程的理论表达式分别为式(1)和(2).28
(i/im)2=1.9524(t/tm)-1{1-exp([-1.2564(t/tm)]}2(1)
(i/im)2=1.2254(t/tm)-1{1-exp([-2.3367(t/tm)2]}2(2)式中,(t,i)是指在一定电位下镍沉积时间达到t时的瞬时电流密度为i;(tm,im)是指在一定电位下镍沉积时间达到tm时的最大电流密度为im.
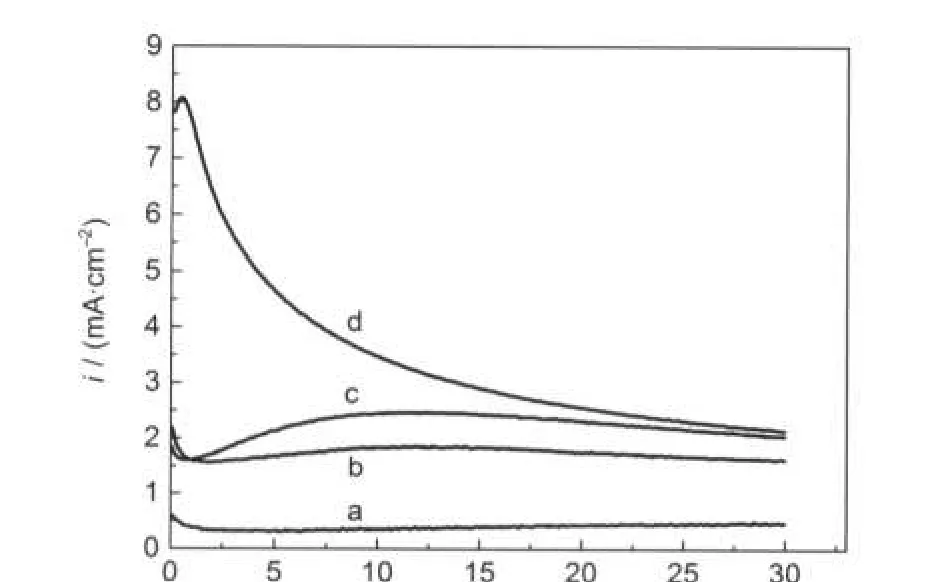
图2 室温下含0.10 mol·L-1NiCl2的2AlCl3/Et3NHCl离子液体中铜电极上电流密度-时间暂态曲线图Fig.2 Current density-time transients resulting frompotential step experiments on Cu electrodes in 2:1 m/o AlCl3-Et3NHCl ionic liquid containing 0.10 mol·L-1NiCl2at room temperature E/V(vs Pt):(a)-1.00,(b)-1.05,(c)-1.175,(d)-1.20
图3为根据图2得到的无因次实验数据与理论值对比图,可以看出,与理论三维瞬时成核过程大致符合,说明Ni在2AlCl3/Et3NHCl离子液体中在铜电极上的成核机理为三维瞬时成核过程.Ni在 2AlCl3/[BPy]Cl离子液体中在Pt电极上、29在ZnCl2/ [EMim]Cl离子液体中在多晶W电极上,30也为三维瞬时成核过程.而Ni在2AlCl3/[EMim]Cl离子液体中在玻碳电极上为在有限活性位上进行三维连续成核过程、31在EMI-DCA离子液体中在玻碳和多晶Cu电极上,32均为三维连续成核过程.可见Ni的成核机理受离子液体及电极影响.
对于三维瞬时成核过程,在不同电位下,形成晶核的结晶数量密度可通过计时电流的im和tm计算,对式(1)进行微分可得以下两式:
tm=1.2564/(NπkD) (3)
im=0.6382zFDc(kN)1/2(4)其中D为扩散系数,N为生长中心密度,z指沉积每个Ni原子所需转移的电子数,则z取2,F为法拉第常数(96485 C·mol-1),c为Ni2+的浓度,k为影响扩散区域生长速率的无因次常数(k=(8πcM/ρ)1/2,其中M为沉积金属Ni的相对分子质量).对于三维瞬时成核过程,通过式(3)和(4)的im和tm得到扩散系数D及结晶活性位密度N0,得到以下两式:
im2tm=0.1629(zFc)2D (5)
N0=0.065(zFc/imtm)2/k (6)表3为通过式(5)中im2tm的得到值扩散系数D,在含0.10 mol·L-1NiCl2的2AlCl3/Et3NHCl离子液体中, Ni2+的平均扩散系数D为7.43×10-7cm2·s-1,这比Ni2+在2AlCl3/[EMim]Cl离子液体中的D值(2.8×10-6cm2·s-1)、31在EMI-DCA离子液体中的D值(2.1× 10-6cm2·s-1)、30在2AlCl3/NaCl熔盐中的D值(3.54× 10-6cm2·s-1)6小,比Ni2+在1.38AlCl3/[Emim]Cl离子液体中的D值(2.1×10-7cm2·s-1)33大.在电位-1.05、-1.175和-1.20 V下,结晶活性位密度N0的值分别为3.84×105、2.92×105及1.427×107cm-2,即过电位不同,N0值也不同.
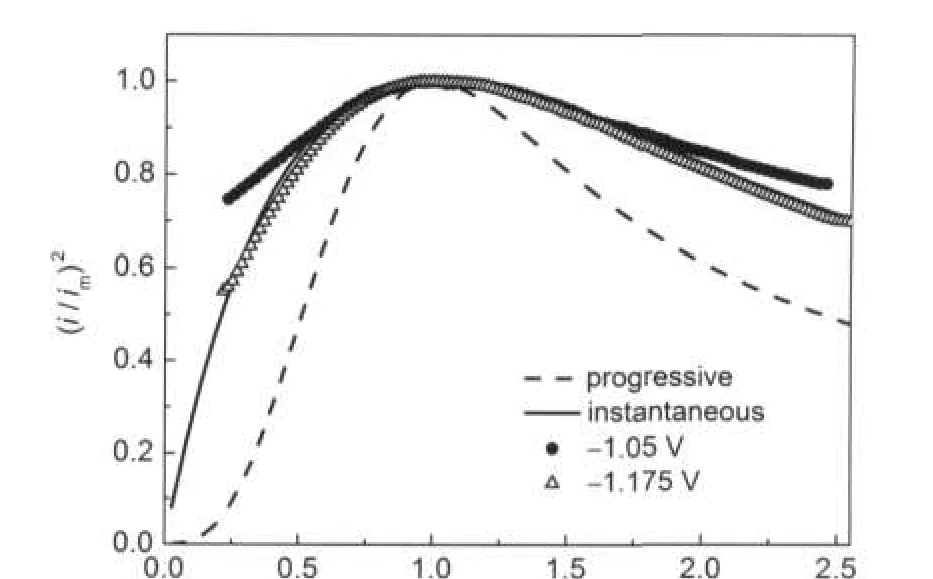
图3 由图2得到的电流密度-时间暂态无因次实验数值与扩散控制三维结晶的理论模型对比曲线图Fig.3 Comparison of the dimensionless experimental current density-time transients,derived from the data in Fig.2 with the theoretical models for three-dimensional nucleation with diffusion-controlled growth

表3 由计时电流计算得到的室温下含0.10 mol·L-1NiCl2的2AlCl3/Et3NHCl离子液体中Ni2+的扩散系数(D)Table 3 Diffusion coefficient(D)of Ni2+calculated from chronoamperometry in 2:1 m/oAlCl3-Et3NHCl ionic liquid containing 0.10 mol·L-1NiCl2at room temperature
图4为室温下在含0.10 mol·L-1NiCl2的2AlCl3/ Et3NHCl离子液体中铜电极上电沉积金属Ni的SEM图.由表1的TEM结果可知,在这两个电位下沉积的金属可看作接近纯金属Ni.在这两个电位下电沉积Ni的形貌相似,沉积物均为灰白色,且能很好地附着在电极表面上.

图4 室温下在含0.10 mol·L-1NiCl2的2AlCl3/Et3NHCl离子液体中铜电极上不同电位下恒电位电沉积金属Ni的SEM图Fig.4 SEM images of nickle ectrodeposits prepared on Cu substrates from 2:1 m/oAlCl3-Et3NHCl ionic liquid containing 0.10 mol·L-1NiCl2under potentiostatic electrolysis with different potentials at room temperature E/V(vs Pt):(a)-1.20,(b)-1.30
综合以上结果可知,在含0.10 mol·L-1NiCl2的2AlCl3/Et3NHCl离子液体中铜电极上,在电位大于-1.30 V时电沉积的金属可看作接近纯Ni,电沉积Ni的机理为受扩散控制的三维瞬时成核过程;在含0.10 mol·L-1NiCl2的2AlCl3/Et3NHCl中,Ni2+的扩散系数约为7.43×10-7cm2·s-1;过电位不同,结晶活性位密度N0值也不同.
3.3 Ni-Al合金沉积
3.3.1 Ni-Al合金电沉积条件及机理
图5为沉积电量(也就是沉积合金质量)对电沉积Ni-Al合金组成影响.从图5中可以看出,在电量≥3.0 C时,电沉积合金的组成基本不再变化.有关这种现象的原因还不很清楚.有可能是在含Ni2+离子液体中,电沉积合金中的Al在很薄的沉积层中热力学上不稳定,只有在沉积层足够厚的情况下,铝的流失才不会影响沉积层的组成.故以下的电沉积都是在电量≥3.0 C的条件下进行.
图6为在含有不同浓度Ni2+的2AlCl3/Et3NHCl离子液体中电沉积Ni-Al合金的组成随电位变化关系,图中的所有数据均是在电量为3.0 C下得到的结果.图6中虚线为理论上合金组成依赖于电位的变化关系.在热力学处理中,34-37采用由Kaufman等34导出的一系列公式来计算在25°C下面方立心(fcc)晶体的自由能.公式如下:
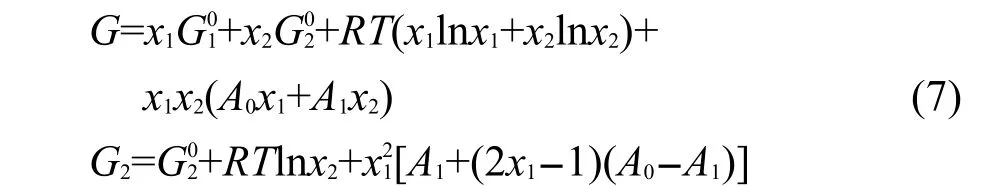
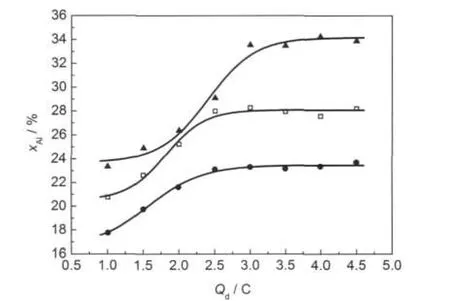
图5 在含Ni2+的2AlCl3/Et3NHCl离子液体中电沉积Ni-Al合金的组成随电量Qd变化关系Fig.5 Variation of the Ni-Al alloy composition as a function of the deposition charge,Qd,during controlled-potential in the 2:1 m/oAlCl3-Et3NHCl ionic liquid containing Ni2+(●)E=-1.45 V,cNi2+=0.10 mol·L-1;(□)E=-1.55 V,cNi2+=0.10 mol· L-1;(▲)E=-1.45 V,cNi2+=0.05 mol·L-1
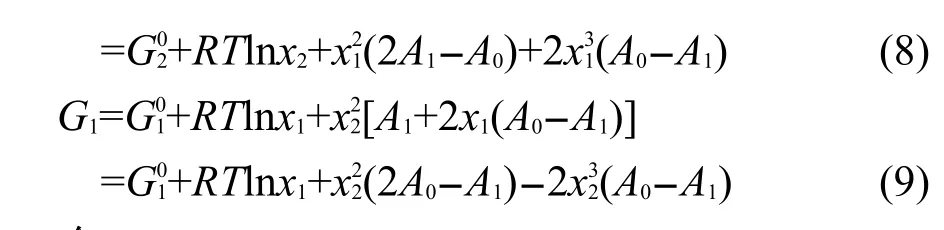
令xNi=x1,xAl=x2
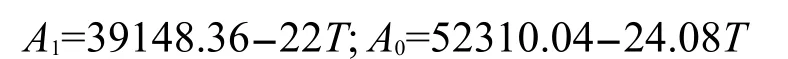
(26323.36-4.16T),活度系数α=exp(-GAl/RT).使用估算的活度系数α及铝电沉积反应式的Nernst方程计算沉积不同组成合金的平衡电位.由室温下2AlCl3/Et3NHCl的ρ=1.298 g·mL-1估算及的浓度分别为3.21和0.00193 mol·L-1.
由图6可知,合金中Al的含量在一定Ni2+浓度下与沉积电位成线性正比关系,但低于理论预测结果,在一定电位下与Ni2+浓度成反比关系.而在AlCl3-NaCl熔盐中,在150°C下电沉积Ni-Al合金组成与Ni2+浓度无关且与理论预测结果一致.6可见两者的结论不一致.这是因为在AlCl3-NaCl熔盐中,在扩散控制沉积金属Ni同时进行金属Al的欠电位沉积,Al的欠电位沉积速度很快,导致合金组成由形成合金的自由能决定.
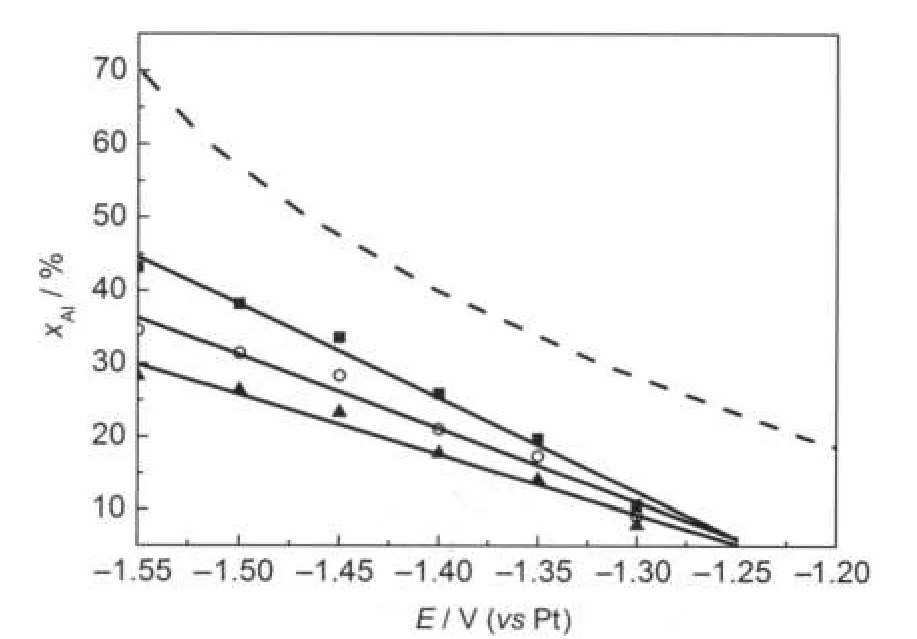
图6 在含有不同浓度Ni2+的2AlCl3/Et3NHCl离子液体中电沉积Ni-Al合金组成随电位变化关系Fig.6 Variation of the composition of Ni-Al alloy electrodeposits with potential in the 2:1 m/oAlCl3-Et3NHCl ionic liquid containing different concentrations of Ni2+cNi2+/(mol·L-1):(■)0.05,(○)0.075,(▲)0.10.The dotted line represents the theoretical composition assuming an fcc lattice at 25°C.
为了考察在酸性2AlCl3/Et3NHCl离子液体中, Al在Ni电极上的电沉积,在纯2AlCl3/Et3NHCl离子液体中在Ni电极上进行循环伏安实验,结果见图7.在电位小于-2.02 V时,Al的沉积峰和相对应的溶解峰很明显,在Al的沉积峰之前,即在电位-1.29 V处有一个小还原峰,相对应在-0.96 V处有一个氧化峰,由于在纯离子液体中,不会有其他峰存在,只能是Al的还原峰,说明是Al在Ni电极上是欠电位沉积.基于以上分析可知,在2AlCl3/Et3NHCl离子液体中,Ni-Al合金的形成可能是在Ni沉积同时进行Al的欠电位沉积.但是,Ni-Al合金的组成偏离热力学预测结果,且依赖于Ni2+浓度,说明形成某些Ni-Al合金相过程中受动力学限制.
在含0.10 mol·L-1NiCl2的2AlCl3/Et3NHCl离子液体中Cu电极上进行的一系列电位阶跃实验得到的电流-时间暂态结果中提取的脉冲伏安图见图8.如果电沉积Ni是唯一的还原反应,这个伏安图并没有表现出有限的电流,而是随着电位负移电流持续增加.图8中Al和Ni的分电流是利用图6中含0.10 mol·L-1NiCl2离子液体中电沉积Ni-Al合金组成随电位变化关系的结果估算出来的,分电流表明,在电位小于-1.40 V时,电沉积Ni的分电流保持不变,这说明Ni的电沉积达到扩散限制电流;但随着电位负移,电沉积Al的分电流持续增长,没有达到扩散限制电流,这说明Al的电沉积受扩散和电荷转移共同控制,与Ni进行共沉积.
综合以上分析可知,在含NiCl2的2AlCl3/ Et3NHCl离子液体中电沉积Ni-Al合金,在电量≥3.0 C时,电沉积Ni-Al合金组成基本不再变化;Ni-Al合金中的Al含量与电位变化成线性关系;Ni-Al合金的沉积机理为Ni的电沉积受扩散控制,Al同时进行欠电位沉积,在Ni-Al合金电沉积过程中某些Ni-Al合金相的电沉积可能受动力学限制,而使Ni-Al合金的组成偏离热力学预测结果.
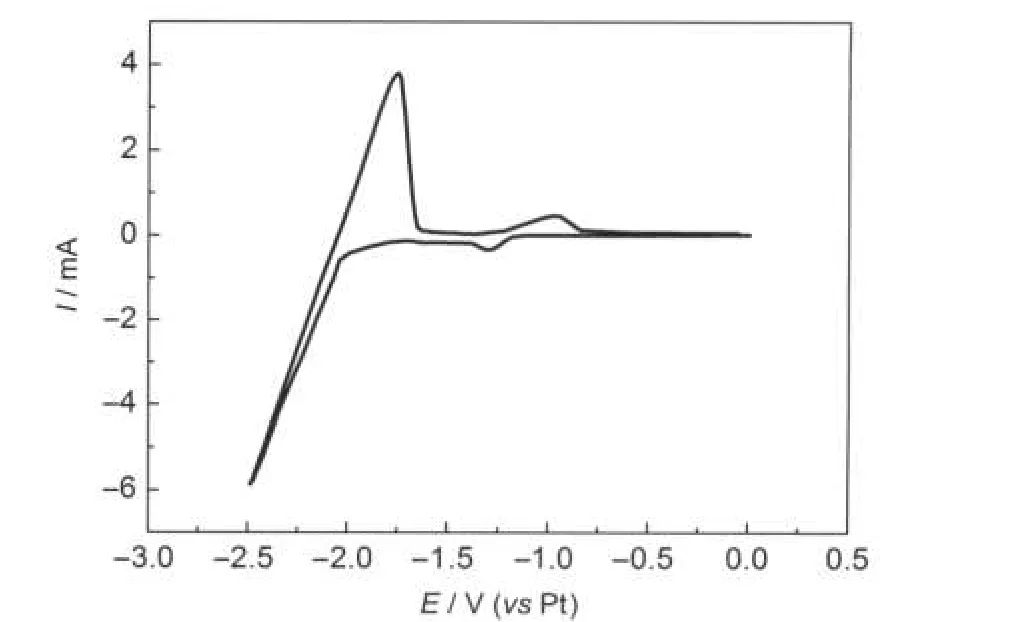
图7 Ni电极在纯2AlCl3/Et3NHCl离子液体中的循环伏安图Fig.7 Cyclic voltammogram of a nickle electrode in pure 2AlCl3/Et3NHCl ionic liquidscan rate:100 mV·s-1
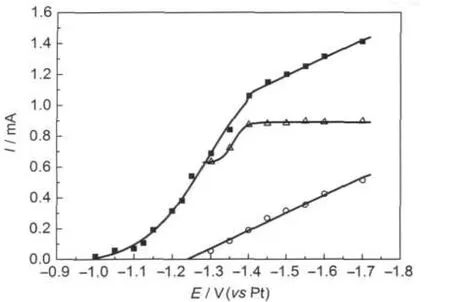
图8 从一系列电位阶跃实验得到的电流-时间暂态结果中提取的脉冲伏安图Fig.8 Pulse voltammogram constructed from the current-time transients resulting from a series of potential-step experimentsat a stationary Cu electrode in a 0.10 mol·L-1solution of Ni2+in the 2:1 m/oAlCl3-Et3NHCl ionic liquid.(■)total current,(△)partial current for the electrodeposition of nickel,(○)partial current for the electrodeposition of aluminum.The total current was sampled from the maximum current of each potential pulse.
3.3.2 Ni-Al合金表征
图9为在含有不同浓度Ni2+的2AlCl3/Et3NHCl离子液体中Cu电极上沉积Ni-Al合金的SEM图,电沉积的电量均为3.0 C.图10为电沉积Ni-Al合金的电流-时间曲线图.由图10可知,在含0.05 mol·L-1NiCl2离子液体中电沉积的电流最小,使得电沉积速率慢,且电流平稳,说明电沉积过程中沉积表面没有明显变化,Ni-Al合金表面形貌致密均一,如图9 (a,b)所示.随着Ni2+离子浓度增大,电沉积电流增大,电沉积速率加快,电流没有在含0.05 mol·L-1Ni2+离子液体中电沉积时的电流平稳,电沉积表面开始出现瘤节,继而沿着电沉积表面缺陷生长,不过瘤节尺寸较均一,图9d中的瘤节要比图9c中的瘤节大,且有些瘤节还有孔洞,导致表面形貌没有图9 (a,b)中的致密均一.随着Ni2+离子浓度增大,电沉积表面颜色加深,由银白色到灰白色.
图11为在含有0.10 mol·L-1NiCl2的2AlCl3/ Et3NHCl离子液体中不同电位下电沉积Ni-Al合金的SEM图,电沉积的电量均为3.0 C.由图10可知,在电位-1.35 V下电沉积(图11a)的电流最小,使得电沉积速率慢,且电流平稳,电极表面小,瘤节要比-1.45 V下电沉积(图11c)的小很多,沿着电极表面缺陷生长,形成排列较整齐的斜直线,直线之间有沟槽.在电位-1.40 V下(图11b),电流虽小但不平稳,电极表面的瘤节也很小,但排列无规则,没有沟槽,形貌要比图11a中的致密些.随着沉积电位负移(-1.45,-1.50,-1.55 V),电沉积的电流增大,且不平稳,电沉积速率加快,瘤节增大,且局部瘤节开始出现堆积(图11(d,e)),致使表面形貌不致密.

图9 电沉积电量均为3.0 C时在含有不同浓度Ni2+的2AlCl3/Et3NHCl离子液体中Cu电极上沉积Ni-Al合金的SEM图Fig.9 SEM morphologies of the Ni-Al alloy electrodeposited on Cu substrates with deposition charges of 3.0 C from stirred 2:1 m/oAlCl3-Et3NHCl ionic liquid containing different concentrations of Ni2+(a)0.05 mol·L-1,-1.35 V;(b)0.05 mol·L-1,-1.45 V;(c)0.075 mol·L-1,-1.45 V;(d)0.10 mol·L-1,-1.45 V
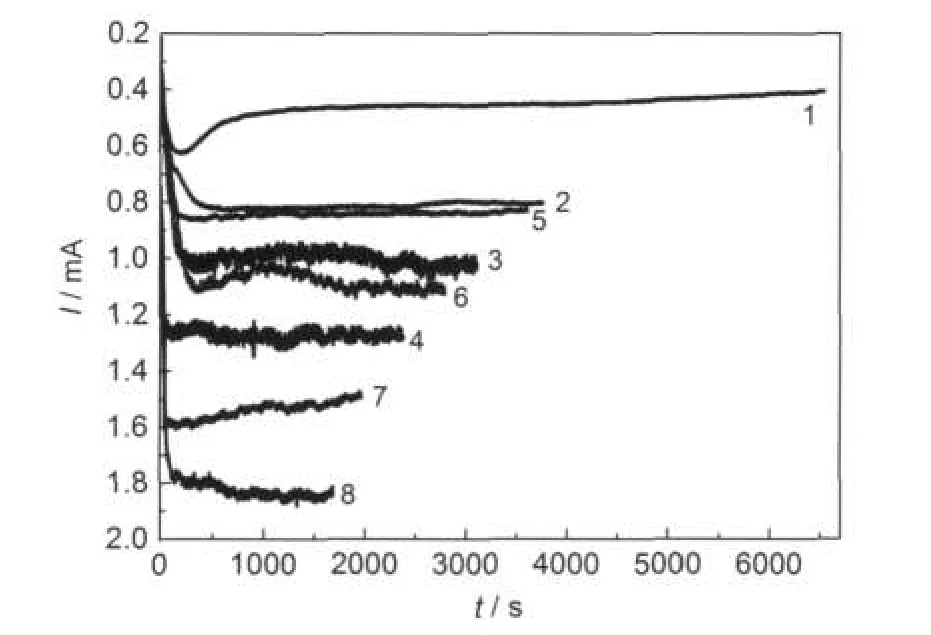
图10 室温下在含Ni2+的2AlCl3/Et3NHCl离子液体中铜电极上电沉积Ni-Al合金的电流-时间曲线图Fig.10 Current-time curves recorded during the potentiostatic electrolysis experiments at Cu electrodes in stirred 2:1 m/oAlCl3-Et3NHCl ionic liquid containing Ni2+ at room temperature(1)0.05 mol·L-1,-1.35 V;(2)0.05 mol·L-1,-1.45 V;(3)0.075 mol· L-1,-1.45 V;(4)0.10 mol·L-1,-1.45 V;(5)0.10 mol·L-1, -1.35 V;(6)0.10 mol·L-1,-1.4 V;(7)0.10 mol·L-1,-1.5 V; (8)0.10 mol·L-1,-1.55 V
图12为在含有0.1 mol·L-1NiCl2的2AlCl3/ Et3NHCl离子液体中Cu电极上不同电量条件下沉积Ni-Al合金的SEM图,均在-1.45 V下电沉积.随着电沉积的电量增加,也就是电沉积的合金量越来越多,沉积物在沉积表面逐渐叠加,瘤节有堆积现象,见图12.
图13为在含有不同浓度Ni2+的2AlCl3/Et3NHCl离子液体中不同电位下电沉积Ni-Al合金的电流效率图,图14为在含0.10 mol·L-1NiCl2的2AlCl3/ Et3NHCl离子液体中在-1.45 V不同电量下电沉积Ni-Al合金的电流效率图.由图13和14可知,电流效率均>90%.随着电量增加,电流效率降低,但幅度不大,可能是电沉积的电量增加,也就是电沉积合金质量增加,由于本实验规模较小,在处理样品时,小部分样品的流失会造成电流效率的降低.可见,在含有Ni2+的2AlCl3/Et3NHCl离子液体中电沉积Ni-Al合金的表面形貌与电沉积的电流大小、电流平稳程度相关;电流效率均>90%.
3.4 Ni-Al合金物相测定
由于电沉积合金很薄,采用XRD测定物相时,测定结果均为铜电极的峰,测不出合金的物相,只能用ICP测试结果进行估算.由图5可知,在含0.10 mol·L-1NiCl2的2AlCl3/Et3NHCl离子液体中,在-1.45、-1.55 V下电沉积,电沉积的电量大于3.0 C,电沉积物的组成基本上接近于Ni3Al.

图11 电沉积电量均为3.0 C时在含有0.10 mol·L-1NiCl2的2AlCl3/Et3NHCl离子液体中Cu电极上不同电位下沉积Ni-Al合金的SEM图Fig.11 SEM images of the Ni-Al electrodeposits prepared on Cu substrates with deposition charges of 3.0 C at different potentials in the 2:1 m/oAlCl3-Et3NHCl ionic liuid containing 0.10 mol·L-1NiCl2E/V(vs Pt):(a)-1.35,(b)-1.40,(c)-1.45,(d)-1.50,(e)-1.55

图12 在含有0.10 mol·L-1NiCl2的2AlCl3/Et3NHCl离子液体中Cu电极上在-1.45 V电沉积不同电量条件下沉积Ni-Al合金的SEM图Fig.12 SEM image of the Ni-Al alloy electrodeposited on Cu substrates with different deposition charges at-1.45 V(vs Pt) in the 2:1 m/oAlCl3-Et3NHCl ionic liquid containing 0.10 mol·L-1NiCl2Q/C:(a)3.0,(b)4.0,(c)5.0,(d)6.0
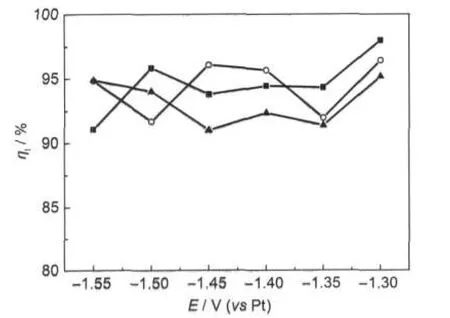
图13 在含有不同浓度Ni2+的2AlCl3/Et3NHCl离子液体中不同电位下沉积Ni-Al合金的电流效率Fig.13 Current efficiency of Ni-Al alloy electrodeposited on Cu substrates in the 2:1 m/oAlCl3-Et3NHCl ionic liquid containing different concentrations of Ni2+with different potentialscNi2+/(mol·L-1):(■)0.05,(○)0.075,(▲)0.10. The deposition charge is 3.0 C.
铝镍在高温喷涂过程中迅速、完全地反应生成成分均匀的金属间化合物——Ni3Al和NiAl.由上面讨论可知,在2AlCl3/Et3NHCl离子液体中电沉积有可能得到耐热、耐腐蚀合金涂层所需的Ni3Al合金成分,本文只是初步探索Ni-Al合金的电沉积,如何使其合金成分可控,尚有待于进一步研究.
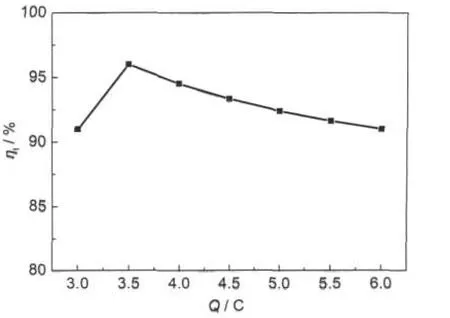
图14 在含有0.10 mol·L-1NiCl2的2AlCl3/Et3NHCl离子液体中在-1.45 V不同电量下电沉积Ni-Al合金的电流效率Fig.14 Current efficiency of Ni-Al alloy electrodeposited on Cu substrates at-1.45 V(vs Pt)in the 2:1 m/o AlCl3-Et3NHCl ionic liquid containing 0.10 mol·L-1NiCl2 with different charges
4 结论
(1)在含0.10 mol·L-1NiCl2的2AlCl3/Et3NHCl离子液体中铜电极上,在电位大于-1.30 V时电沉积的金属可看作接近纯Ni,电沉积Ni的机理为受扩散控制的三维瞬时成核过程.在含0.1 mol·L-1NiCl2的2AlCl3/Et3NHCl离子液体中,Ni2+的扩散系数约为7.43×10-7cm2·s-1;过电位不同,结晶活性位密度N0的值也不同.
(2)在含NiCl2的2AlCl3/Et3NHCl离子液体中电沉积Ni-Al合金,在电量≥3.0 C时,电沉积Ni-Al合金的组成基本不再变化;Ni-Al合金的电沉积机理为Ni的电沉积受扩散控制,同时进行Al的欠电位沉积,在Ni-Al合金电沉积过程中某些Ni-Al合金相的沉积可能受动力学限制而使Ni-Al合金的组成偏离热力学预测结果.
(3)在含NiCl2的2AlCl3/Et3NHCl离子液体中电沉积Ni-Al合金,合金表面形貌与电沉积的电流大小、电流平稳程度相关,电流越小越平稳,电沉积速率慢,表面致密均一,反之就会出现瘤节.电沉积Ni-Al合金的电流效率>90%.电沉积物的组成接近于Ni3Al合金.
(1)Wu,Z.J.;Wu,X.F.;Yang,J.Machinist Metal Forming 2009, No.18,23.[吴朝军,吴晓峰,杨 杰.金属加工(热加工), 2009,No.18,23.]
(2)Yin,C.L.;Yu,Y.G.;Zeng,K.L.;Ren,X.J.The Chinese Journal of Process Engineering 2004,4,156. [尹春雷,于月光,曾克里,任先京.过程工程学报,2004,4,156.]
(3)Yu,Y.G.;Zeng,K.L.;Song,X.J.;Xu,G.G.;Chen,S.Y.;Xie, J.G.Al-Coated-Ni Composite Powder Coated by Ultramicroor-NanoAl Powder and its Preparation Method.CN.Patent 02100588.5,2005-07-06.[于月光,曾克里,宋希剑,许根国,陈舒予,谢建刚.超微或纳米铝粉包覆的铝包镍复合粉末及其制备方法:中国,02100588.5[P].2005-07-06.]
(4)Moffat,T.P.J.Electrochem.Soc.1994,141,L115.
(5)Uchida,J.;Tsuda,T.;Yamamoto,Y.;Seto,H.;Abe,M.;Shibuya, A.ISIJ Int.1993,33,1029.
(6) Moffat,T.P.J.Electrochem.Soc.1994,141,3059.
(7)Stafford,G.R.;Haarberg,G.M.Plasmas&Ions 1999,2,35.
(8)Stafford,G.R.J.Electrochem.Soc.1994,141,945.
(9)Ueda,M.;Kigawa,H.;Ohtsuka,T.Electrochim.Acta 2007,52, 2515.
(10) Zhu,Q.;Hussey,C.L.;Stafford,G.R.J.Electrochem.Soc. 2001,148,C88.
(11) Carlin,R.T.;Trulove,P.C.;DeLong,H.C.J.Electrochem.Soc. 1996,143,2747.
(12)Zell,C.A.;Freyland,W.Langmuir 2003,19,7445.
(13) Mitchell,J.A.;Pitner,W.R.;Hussey,C.L.;Stafford,G.R. J.Electrochem.Soc.1996,143,3448.
(14) Ali,M.R.;Nishikata,A.;Tsuru,T.Electrochim.Acta 1997,42, 1819.
(15) Ali,M.R.;Nishikata,A.;Tsuru,T.Electrochim.Acta 1997,42, 2347.
(16) Tierney,B.J.;Pitner,W.R.;Mitchell,J.A.;Hussey,C.L.; Stafford,G.R.J.Electrochem.Soc.1998,145,3110.
(17)Zhu,Q.;Hussey,C.L.J.Electrochem.Soc.2001,148,C395.
(18) Tsuda,T.;Nohira,T.;Ito,Y.Electrochim.Acta 2002,47,2817.
(19) Tsuda,T.;Hussey,C.L.;Stafford,G.R.J.Electrochem.Soc. 2004,151,C379.
(20) De Long,H.C.;Mitchell,J.A.;Trulove,P.C.High Temp. Mater.Processes(New York)1998,2,507.
(21)Aravinda,C.L.;Mukhopadhyay,I.;Freyland,W.Phys.Chem. Chem.Phys.2004,6,5225.
(22) Pradhan,D.;Reddy,R.;Lahiri,A.Metall.Mater.Trans.B 2009, 40,114.
(23) Tsuda,T.;Hussey,C.L.;Stafford,G.R.;Kongstein,O. J.Electrochem.Soc.2004,151,C447.
(24)Tsuda,T.;Arimoto,S.;Kuwabata,S.;Hussey,C.L. J.Electrochem.Soc.2008,155,D256.
(25) Tsuda,T.;Hussey,C.L.;Stafford,G.R.J.Electrochem.Soc. 2005,152,C620.
(26)Gao,L.X.;Wang,L.N.;Qi,T.;Li,Y.P.;Chu,J.L.;Qu,J.K. Acta Physico-Chimica Sinica 2008,24,939.[高丽霞,王丽娜,齐 涛,李玉平,初景龙,曲景奎.物理化学学报,2008,24, 939.]
(27) Gale,R.J.;Gilbert,B.;Osteryoung,R.A.Inorg.Chem.1979, 18,2723.
(28) Lee,J.J.;Miller,B.;Shi,X.;Kalish,R.;Wheeler,K.A. J.Electrochem.Soc.2000,147,3370.
(29)Ali,M.R.;Nishikata,A.;Tsuru,T.J.Electroanal.Chem.2001, 513,111.
(30) Gou,S.P.;Sun,I.W.Electrochim.Acta 2008,53,2538.
(31) Pitner,W.R.;Hussey,C.L.;Stafford,G.R.J.Electrochem.Soc. 1996,143,130.
(32)Deng,M.J.;Sun,I.W.;Chen,P.Y.;Chang,J.K.;Tsai,W.T. Electrochim.Acta 2008,53,5812.
(33)Mann,O.;Freyland,W.J.Phys.Chem.C 2007,111,9832.
(34)Kaufman,L.CALPHAD;Pergamon Press:New York,1977; Vol.1,pp 1-89.
(35) Lupis,C.H.P.Chemical Thermodynamics of Materials,North-Holland:New York,1983;p 581.
(36) Shi,L.Alloy Thermodynamics,1st ed.;China Machine Press: Beijing,1992;pp 285-348.[石 霖.合金热力学.第一版.北京:机械工业出版社,1992:285-348.]
(37)Ye,D.L.Handbook of Thermodynamic Data for Applied Inorganic Material,2nd ed.;Metallurgical Industry Press: Beijing,2002;pp 43-46,270-272.[叶大伦.实用无机物热力学数据手册.第二版.北京:冶金工业出版社,2002:43-46, 270-272.]
August 12,2011;Revised:October 15,2011;Published on Web:November 8,2011.
Preparation of Ni and Ni-Al Alloys from 2AlCl3/Et3NHCl Ionic Liquid by Electrodeposition
GAO Li-Xia1,2WANG Li-Na1QI Tao1,*YU Jiang2,*(1National Engineering Laboratory for Hydrometallurgical Cleaner Production Technology,Institute of Process Engineering, Chinese Academy of Sciences,Beijing 100190,P.R.China;2College of Chemical Engineering,Beijing University of Chemical Technology,Beijing 100029,P.R.China)
Nickel and nickel-aluminum alloy were successfully electrodeposited on Cu electrodes from 2: 1 molar ratio aluminum chloride(AlCl3)/triethylamine hydrochloride(Et3NHCl)ionic liquids containing Ni2+by constant potential electrolysis.The nucleation mechanism of nickel electrodeposition on Cu was investigated by cyclic voltammograms and chronoamperometry.The mechanism and the influence of experimental conditions on the current efficiency and the surface morphology of nickel-aluminum alloy electrodeposition on Cu electrodes were studied.The electrodeposition of nickel on Cu electrodes was controlled by three-dimensional instantaneous nucleation with diffusion-controlled growth.The Ni-Al alloy composition did not become independent of the deposition charge until at least 3.0 C had been accumulated.The mechanism of Ni-Al alloy formation appears to involve the underpotential deposition of aluminum on the developing nickel deposit and alloy formation must be kinetically hindered because the aluminum content is always less than that predicted from theoretical considerations.The Ni-Al alloy that was obtained on the Cu electrode was dense,continuous,and well adherent when the deposition current was small and stationary.If these conditions were not met,a nodule surface morphology appeared.The current efficiency of the Ni-Al alloy electrodeposition was greater than 90%and the deposition composition was close to that of the Ni3Al alloy.
Ionic liquid;Aluminum chloride/Triethylamine hydrochloride;Constant potential; Electrodeposition;Nickel-aluminum alloy
10.3866/PKU.WHXB201228111
*Corresponding authors.QI Tao,Email:tqgreen@mail.ipe.ac.cn;Tel:+86-10-62631710.YU Jiang,Email:jyu0017@yahoo.com.cn;
Tel:+86-10-64438933.
The project was supported by the National Key Basic Research Program of China(973)(2007CB613501),Knowledge Innovation Program of the
ChineseAcademy of Sciences(082814),National Natural Science Foundation of China(21076019),Fundamental Research Funds for the Central
Universities,China(ZY1130),and China Postdoctoral Science Foundation Funded Project(2011M500224).
国家重点基础研究发展规划项目(973)(2007CB613501),中国科学院知识创新项目(082814),国家自然科学基金(21076019),中央高校基本科研业务费专项资金(ZY1130)及中国博士后科学基金项目(2011M500224)资助
O646
