集流体对可充镁电池电解液电化学性能的影响
2012-12-11努丽燕娜凯丽比努尔克日木王久林
陈 强 努丽燕娜 杨 军 凯丽比努尔·克日木 王久林
(上海交通大学化学化工学院,上海200240)
集流体对可充镁电池电解液电化学性能的影响
陈 强 努丽燕娜*杨 军 凯丽比努尔·克日木 王久林
(上海交通大学化学化工学院,上海200240)
系统研究了铂、镍、不锈钢(SS)、铜、铝五种金属集流体和碳纤维、石墨箔、碳布三种碳纸集流体对“一代”(Mg(AlCl2BuEt)2/THF)、“二代”((PhMgCl)2-AlCl3/THF)可充镁电池电解液阳极氧化分解电位和镁沉积-溶出性能的影响.金属镍、不锈钢、铜、铝作为可充镁电池正极的集流体时,充电至一定电压时自身均会发生腐蚀.其中,镍和不锈钢可用作充电电压在2.1 V(vs Mg/Mg2+)以下正极材料的集流体;铜可用作充电电压在1.8 V(vs Mg/Mg2+)以下正极材料的集流体.碳集流体比金属集流体具有更高的稳定性,其中,碳布作为集流体,适用于充电电压在2.25 V(vs Mg/Mg2+)(对“一代”电解液)和2.95V(vs Mg/Mg2+)(对“二代”电解液)以下的正极材料.
可充镁电池;集流体;金属;碳纸;电解液
1 引言
随着人类对能源需求的日益增长和对社会经济可持续发展要求的不断提高,高性能、低成本的绿色电源越来越受到人们的重视.金属镁由于具有较高的电极电位(-2.375 V)、低密度(1.738 g·cm-3)、高熔点(649°C)等优点,是一种很有发展前景的负极材料.1与金属锂相比,镁虽然理论比容量较低(锂为3862 mAh·g-1,镁为2205 mAh·g-1),在便携式电子设备用的小型充电电池中不占优势,但镁价格低廉、加工容易、安全性更高,在大型电能储存设备和电动汽车用动力电池方面具有潜在优势.2,3
可充镁电池的发展一直受到两个主要因素的制约:2-6第一,虽然镁离子半径(0.066 nm)与锂离子半径(0.068 nm)相差不大,但二价镁离子的溶剂化作用较强,很难嵌入到一般的基质材料中,难以找到适合用作可充镁电池的正极材料;第二,即使在质子惰性的溶剂中,镁电极表面也易形成一层致密的钝化膜,二价镁离子很难通过这层钝化膜,使镁难以进行可逆地溶解和沉积,限制了电解液的选择范围.
目前最为成功的电解液是由以色列科学家Aurbach等2,7-11在2000年左右开发出的Mg (AlCl2BuEt)2/四氢呋喃(THF)体系(其中Bu为丁基, Et为乙基),被Aurbach小组命名为“一代电解液”,这一新型配合物可以看做是由Lewis碱Mg(Bu)2和Lewis酸AlEtCl2反应得到的.0.25 mol·L-1Mg(AlCl2BuEt)2/THF电解液在Pt电极上的阳极氧化分解电位为2.5 V(vsMg/Mg2+)左右,大大拓宽了镁电池电解液的电化学窗口,具有里程碑式的意义. 2007年底,Aurbach小组又提出将烷基卤铝络合物中的有机基团全部换为苯基,成功合成出全苯基镁铝卤络合物/THF的电解液体系,12-14并称之为“二代电解液”.该电解液由Lewis碱PhMgCl(Ph为苯基)和Lewis酸AlCl3按2:1摩尔比在THF中反应制得.其电化学性能相对于“一代电解液”有很大提高, 0.40 mol·L-1(PhMgCl)2-AlCl3/THF在Pt电极上的阳极氧化分解电位可达到3 V(vs.Mg/Mg2+),且镁沉积的过电位(<0.2 V)降低了约60 mV,电导率也有显著提高(约为4-5 S·cm-1).
集流体是电池的重要组成部分,它既为正负极活性材料的载体,又是电子的收集与传输体,电极活性材料在其上的粘附性,它与电解液的相容性及界面电化学行为直接影响到电池的性能.15当电池过充的时候,会有多种副反应的发生,包括电解液自身的分解、16,17电极材料不可逆的相转变、18,19集流体的腐蚀或溶解等.20,21集流体一旦发生腐蚀或溶解,会导致与电极活性物质间的电子导电性降低,电极与活性物质的接触电阻变大;溶解的金属离子还会造成电解液的污染,导致电池性能下降.22因此,研究集流体对电解液电化学性能的影响,对于提高电池的性能具有重要意义.
目前锂离子电池常用的集流体主要包括铝箔、铜箔、不锈钢网、泡沫镍等.23,24碳纤维纸(碳纸)是燃料电池的关键材料之一,作为燃料电池的气体扩散层来使用,在锂离子电池的集流体中也有一定的应用.25
在本文,我们首先通过三电极体系的循环伏安测试比较了不同金属电极Pt、Ni、SS(不锈钢)、Cu、Al上“一代”、“二代”可充镁电池电解液的电化学窗口.然后通过恒电流沉积-溶出测试进一步比较了不同金属集流体对电解液镁沉积-溶出循环性能的影响,并通过扫描电镜(SEM)观察了它们在电解液中的腐蚀情况.为了寻找更稳定的集流体,选取了三种不同的碳纸,研究了它们对可充镁电池电解液电化学窗口和循环性能的影响.
2 实验部分
2.1 试剂与仪器
二丁基镁(1.0 mol·L-1的庚烷溶液)、乙基二氯化铝(0.9 mol·L-1的庚烷溶液)购于百灵威科技,苯基氯化镁(2.0 mol·L-1的四氢呋喃溶液)、镁带(≥99.5)购于Sigma-Aldrich(中国),无水三氯化铝(AlCl3)购于TCI,无水四氢呋喃由实验室自组装设备重蒸纯化制得.所有试剂放置于氩气气氛手套箱(MBRAUN,德国UNILAB)中备用.
铂、铝、铜、镍盘电极购买于上海仙仁仪器仪表有限公司,不锈钢片购于东莞市明诺金属材料有限公司,碳纤维购于Toray Industries,Inc.(日本),石墨箔购于AlfaAesar.
实验扣式电池(CR2016)和三电极测试体系的组装均在氩气气氛手套箱中进行.利用扫描电子显微镜(SEM,FEI SIRION,美国)拍摄金属表面形貌. CHI660C电化学工作站(上海辰华仪器有限公司)上进行循环伏安扫描测试.LAND-CT2001A系统测试不同电解液中镁在不同基质材料上的恒电流电化学沉积-溶出过程.
2.2 电解液的配制
2.2.1 0.25 mol·L-1Mg(AlCl2EtBu)2/THF电解液
在氩气气氛手套箱内将二丁基镁与乙基二氯化铝溶液以1:2摩尔比混合后,搅拌48 h,彻底蒸除溶剂后,得到白色沉淀.加入适量无水THF溶解,配制成无色透明0.25 mol·L-1Mg(AlCl2EtBu)2/THF电解液.
2.2.2 0.4 mol·L-1(PhMgCl)2-AlCl3/THF电解液
在氩气气氛手套箱内将苯基氯化镁与无水三氯化铝按照2:1的摩尔比混合搅拌,加入适量无水THF配制成黄色透明0.4 mol·L-1(PhMgCl)2-AlCl3/ THF电解液.
2.3 测 试
2.3.1 循环伏安测试
在氩气气氛手套箱中进行三电极循环伏安测试,工作电极分别采用铂、镍、铜、铝和不锈钢电极,对电极和参比电极采用新鲜处理过的镁条.工作电极使用之前采用三氧化二铝粉末进行抛光处理,然后用丙酮及去离子水进行清洗,擦拭干净,干燥后放入氩气手套箱中待用.镁条使用前用砂纸打磨干净.测试时,从开路电位开始向负方向扫描,扫描速率为50 mV·s-1.
2.3.2 恒电流沉积-溶出测试
在氩气手套箱中,以镍片、不锈钢片、铜箔和不同碳纸作为正极,镁条(使用前用砂纸打磨干净)作为负极,0.25 mol·L-1Mg(AlCl2EtBu)2/THF或0.4 mol·L-1(PhMgCl)2-AlCl3/THF作为电解液组装成扣式电池后进行测试.恒电流(分别为0.09 mA·cm-2)进行一定时间的放电(镁沉积),静置30 s后,再以相同电流进行充电(镁溶出),如此循环.循环效率等于充电时间与放电时间的比值.
2.3.3 恒电流极化测试
在氩气手套箱中,以镍片、不锈钢片、铝片、铜箔作为正极,镁条(使用前用砂纸打磨干净)作为负极,0.25 mol·L-1Mg(AlCl2EtBu)2/THF或0.4 mol· L-1(PhMgCl)2-AlCl3/THF作为电解液组装成扣式电池后进行恒电流充电.电流大小为0.09 mA·cm-2,充电时间为20 h.
2.3.4 SEM测试
不同金属基质电化学极化前后的形貌采用扫描电子显微镜拍摄.在手套箱内,将恒流极化后的电池拆开,取出正极片,迅速用THF将基质表面的电解液洗干净,用滤纸将THF吸干,进行SEM测试.未极化的金属基质用丙酮及去离子水清洗,擦拭干净,干燥后直接进行SEM测试.

图1 不同电极在Mg(AlCl2BuEt)2/THF(a)和(PhMgCl)2-AlCl3/THF(b)中典型的循环伏安曲线Fig.1 Typical cyclic voltammograms of different electrodes in Mg(AlCl2BuEt)2/THF(a)and(PhMgCl)2-AlCl3/THF(b)
3 结果与讨论
3.1 不同金属集流体对可充镁电池电解液性能的影响
3.1.1 不同金属电极上电解液的循环伏安比较
图1为“一代”Mg(AlCl2BuEt)2/THF、“二代”(PhMgCl)2-AlCl3/THF两种电解液在不同金属基质上的三电极循环伏安曲线.两种电解液均在Pt电极上表现出最高的稳定性,Mg(AlCl2BuEt)2/THF和(PhMgCl)2-AlCl3/THF的阳极氧化分解电位分别在2.5和3.0 V(vsMg/Mg2+)左右.而两种电解液在Ni、SS、Cu、Al电极上的电化学稳定性依次递减,分别为2.2、2.1、1.8、1.3 V左右,见表1.(PhMgCl)2-AlCl3/ THF在Pt电极上具有更高的稳定性,但在其它金属电极上并没有明显表现出比Mg(AlCl2BuEt)2/THF更高的稳定性.电解液在Ni、SS、Cu、Al电极上的阳极氧化分解电位主要由金属基质本身决定.虽然Pt上电解液的氧化分解电位最高,但考虑到其价格, Ni、SS、Cu、Al这些常用金属更具有实用性.
在锂离子电池中Al因为具有较好的稳定性,通常作为正极材料的集流体来使用.但在可充镁电池中的情况不同,两种电解液均在Al电极上表现出最差的稳定性.尤其在(PhMgCl)2-AlCl3/THF中,不仅阳极氧化分解电位较低,其沉积、溶出电流也非常小,溶出峰电流仅有1.75 mA·cm-2,远小于其它三种电极.可充镁电池电解液的主要成分为烷基镁铝配合物,其中阳离子为MgCl+或Mg2Cl3+,阴离子为多种离子,电解液的稳定性主要受到含铝阴离子基团的影响,13金属Al与电解液中的含铝配合物组分可能会发生一些作用,从而对电解液和集流体的稳定性产生影响.(PhMgCl)2-AlCl3/ THF电解液的制备中直接使用AlCl3作为原料,因此这种影响更为明显.

表1 两种电解液中不同材料的阳极氧化分解电位(V vs Mg/Mg2+)Table 1 Anodic stability(V vs Mg/Mg2+)of different current collectors in two electrolytes
3.1.2 不同金属集流体上电解液镁沉积-溶出性能比较
目前,可充镁电池使用的正极材料较少,其中Chevrel相硫化物Mo6S8是最为稳定的一种材料,其放电平台在1.2和1.0 V,而充电电压至少要达到1.8 V才能保证镁离子的完全脱出.2即使对于这种充电截止电压比较低的正极材料,也不能使用Al作为集流体,因为在1.2V时就会发生电解液分解或Al的腐蚀,而只能选用Cu、Ni、SS作为集流体.因此我们以镁片为负极,Cu箔、Ni片、SS片为正极组装成扣式电池,通过恒电流沉积-溶出测试比较了可充镁电池电解液在Cu、Ni、SS基质上镁沉积-溶出的过电位和循环效率.
图2为Cu、Ni、SS三种金属基质上可充镁电池“一代”、“二代”电解液中前10次镁沉积-溶出曲线和前30次循环效率比较.在这三种基质上,两种电解液中镁的沉积-溶出效率起始几次循环中为70%-90%,随着循环增加逐渐趋于稳定.不同的金属基质对电解液中镁的沉积-溶出行为作用不同.在两种电解液中,Cu上均呈现出较低的沉积-溶出过电位.与“一代”Mg(AlCl2BuEt)2/THF相比,“二代”(PhMgCl)2-AlCl3/THF在三种基质上均表现出了更高的循环效率.在(PhMgCl)2-AlCl3/THF中,SS和Ni上的循环效率接近,稳定后可达到99.0%,Cu上的效率略低,在96.5%左右.在Mg(AlCl2BuEt)2/THF中,Cu上的效率反而最高,可达到95%,在Ni和SS上的效率仅有91.5%和89.2%.由于金属镁的沉积过程与电解液中活性离子的吸附有关,7,26活性离子在每种基质上不同的吸附过程会影响到镁的成核过程和沉积形貌,27从而导致了镁在不同金属上沉积-溶出效率的差异.Cu、Ni、SS均为镁沉积-溶出性能优异的基质.结合不同集流体对可充镁电池电解液阳极氧化分解电位的影响,Cu可用作充电截止电压在1.8 V以下正极材料的集流体,Ni和SS则可用于充电截止电压在2.0 V以下正极材料集流体.
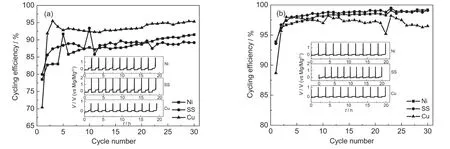
图2 Mg(AlCl2BuEt)2/THF(a)和(PhMgCl)2-AlCl3/THF(b)在不同金属基质上的循环效率比较Fig.2 Cycling efficiencies on different metal substrates in Mg(AlCl2BuEt)2/THF(a)and(PhMgCl)2-AlCl3/THF(b)The insets show the initial ten galvanostatic cycles for Mg deposition-dissolution.
3.1.3 不同金属在电解液中的腐蚀情况
对不同金属集流体在两种电解液中进行了恒流极化测试.图3是Ni片在(PhMgCl)2-AlCl3/THF中的恒流极化曲线(0.09 mA·cm-2,20 h).极化开始后,电位迅速增加到2.7 V,然后缓慢下降,稳定在2.1 V左右.这个过程发生的电化学反应可能为电解液的分解,也可能是金属材料自身的腐蚀溶解.
为了确定恒流极化过程是否对金属基质产生影响,我们进一步通过SEM观察了不同金属极化前后的表面形貌,结果如图4和图5所示.可以看到,在两种电解液中,经过极化后不同金属表面都发生了不同程度的腐蚀.经过极化后光滑的Ni片、SS片、Al箔表面都可以看到明显的蚀坑存在(如图中圆圈标出处);而所用的Cu箔极化前表面是粗糙的,具有颗粒状的形貌,极化后则可观察到表面粗糙部分被腐蚀掉.这表明这些金属作为可充镁电池的集流体使用时,达到一定充电电压除了发生电解液自身的分解外,也伴随有金属自身的腐蚀.
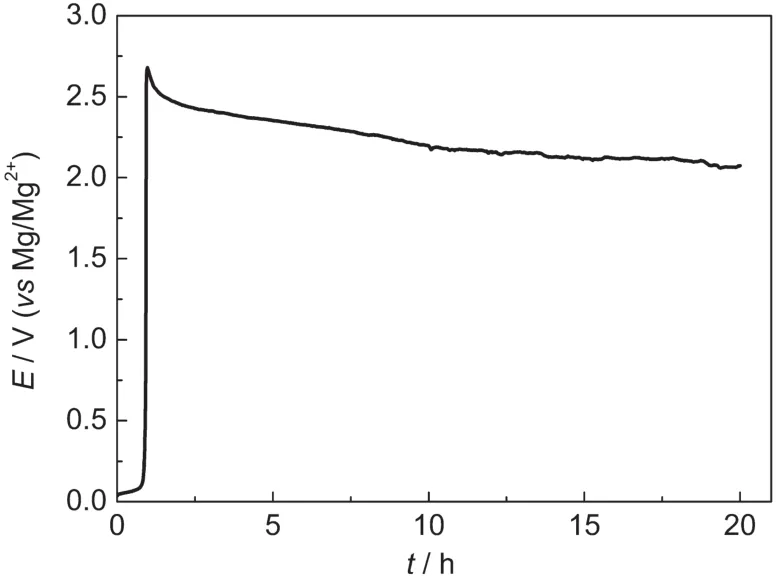
图3 Ni在(PhMgCl)2-AlCl3/THF中的恒电流(0.09 mA·cm-2)极化曲线Fig.3 Galvanostatic polarization curve of Ni in (PhMgCl)2-AlCl3/THF at 0.09 mA·cm-2
通过以上结果,金属(Ni、SS、Cu、Al)作为可充镁电池的集流体,达到一定电压时,集流体自身会发生腐蚀现象.要提高金属在可充镁电池电解液中的稳定性,除了选择价格较为便宜、更稳定的金属(如Ti)外,可以借鉴锂离子电池中的一些手段.例如,铜箔表面的粗糙度将会影响其在电解液中的阳极溶解电位,28选择表面粗糙度低的金属,提高其耐蚀性;同一种金属纯度不同,其组分组成存在差异,也会对其稳定性产生影响,24可选择纯度较高的材料;不同电解液中组分的差异会影响金属表面钝化层的形成,从而影响其稳定性,19,20可以对金属表面进行一定处理或向电解液中添加使金属表面更容易形成钝化层的组分,提高金属集流体在电解液中的稳定性.目前,关于可充镁电池中集流体腐蚀机理的研究很少,Muldoon等29认为镁电池电解液中金属的腐蚀可能与电解液中阴阳离子中卤素原子的存在有关.他们用不含卤素原子的BPh-4阴离子制备的可充镁电池电解液在不锈钢与Pt上具有相同的阳极稳定性(2.6 VvsMg/Mg2+).用同样不含卤素的B(C6F5)3作为路易斯酸与PhMgCl反应后制备的电解液在Pt上的阳极稳定性可达到3.7 V(vsMg/ Mg2+),但是在不锈钢上仅为2.2 V(vsMg/Mg2+).可充镁电池电解液中集流体腐蚀的具体机理仍需进一步研究.

图4 不同金属极化前的SEM图Fig.4 SEM images of different metals before polarization(a)Ni,(b)SS,(c)Al,(d)Cu
3.2 不同碳纸对可充镁电池电解液的性能的影响
3.2.1 不同碳纸上电解液的循环伏安比较

图5 极化电流为0.09 mA·cm-2、时间为20 h时不同金属极化后的SEM图Fig.5 SEM images of different metals after the polarization for 20 h at 0.09 mA·cm-2in Mg(AlCl2BuEt)2/THF:(a)Ni,(c)SS,(e)Al,(g)Cu;in(PhMgCl)2-AlCl3/THF:(b)Ni,(d)SS,(f)Al,(h)Cu
这里我们选取了碳纤维、石墨箔、碳布三种不同的碳纸对它们的性能进行了比较.图6是不同碳纸在两种电解液中的循环伏安曲线比较.在Mg (AlCl2BuEt)2/THF中,碳纤维、石墨箔、碳布均表现出较好的稳定性,阳极氧化分解电位分别在2.32、2.22、2.25 V左右,相比金属有所提高;石墨箔上在1.0-1.5 V内仍出现镁的溶出过程,表明其较差的镁溶出动力学性能.在(PhMgCl)2-AlCl3/THF中,碳布表现出最高的稳定性,阳极氧化分解电位可达到2.95 V,碳纤维和石墨箔上的阳极氧化分解电位分别为2.83和2.72 V;碳纤维和石墨箔上表现出了很宽的溶出峰,镁溶出的动力学性能较差.与金属集流体上的情况不同,(PhMgCl)2-AlCl3/THF在三种碳纸上的稳定性相对于Mg(AlCl2BuEt)2/THF中均有明显的提高.碳相对金属更为稳定,不易发生分解,因此不同碳纸上电解液的稳定性主要由电解液本身性质决定.
3.2.2 不同碳纸上电解液镁沉积-溶出性能比较

图6 Mg(AlCl2BuEt)2/THF(a)and(PhMgCl)2-AlCl3/THF(b)在不同碳纸上典型的循环伏安曲线Fig.6 Typical cyclic voltammograms on different carbon papers in Mg(AlCl2BuEt)2/THF(a)and(PhMgCl)2-AlCl3/THF(b)C1:carbon fiber,C2:graphite foil,C3:carbon cloth
图7是三种碳纸在不同电解液中的循环性能和前10次镁沉积-溶出曲线比较.在Mg(AlCl2BuEt)2/ THF中,碳纤维、石墨箔稳定后的效率在92%左右,碳布稳定后的效率在87%左右.在(PhMgCl)2-AlCl3/ THF中,碳纤维和石墨箔上稳定后的效率可达到96%,碳布上稳定后的效率在90%左右.
结合不同碳纸对电解液阳极氧化分解电位的影响,碳纤维在两种电解液中表现出最优异的性能.在Mg(AlCl2BuEt)2/THF中,其阳极氧化分解电位可达到2.30 V,且循环效率在92%左右;在(PhMgCl)2-AlCl3/THF中,其阳极氧化分解电位可达到2.80 V,且循环效率在96%左右.但由于碳纤维和和石墨箔较脆,正极材料不易涂覆,而且以碳纤维和石墨箔作为集流体时,镁溶出的动力学性能较差.以碳布作为集流体时,Mg(AlCl2BuEt)2/THF的阳极氧化分解电位为2.25 V,(PhMgCl)2-AlCl3/THF的阳极氧化分解电位为2.90 V,而且碳布容易涂覆活性物质,因此更适合作为可充镁电池的集流体.碳布可作为可充镁电池充电截止电压在2.25 V(对“一代”电解液)和2.95 V(对“二代”电解液)以下正极材料的集流体来使用.

图7 Mg(AlCl2BuEt)2/THF(a)and(PhMgCl)2-AlCl3/THF(b)在不同碳纸上的循环效率Fig.7 Cycling efficiencies on different carbon papers in Mg(AlCl2BuEt)2/THF(a)and(PhMgCl)2-AlCl3/THF(b)The insets show the initial ten galvanostatic cycles for Mg deposition-dissolution.
4 结论
通过三电极的循环伏安测试和实验扣式电池的恒电流沉积-溶出等测试系统比较了Pt、Ni、SS、Cu、Al五种金属集流体以及碳纤维、石墨箔、碳布三种碳纸集流体对可充镁电池电解液性能的影响.金属(Ni、SS、Cu、Al)作为可充镁电池的集流体,充电至一定电压时,集流体自身会发生腐蚀现象.其中,Ni和SS是最稳定的,适用于充电截止电压在2.1 V(vs Mg/Mg2+)以下的正极材料;Cu适用于充电截止电压在1.8 V(vsMg/Mg2+)以下的正极材料.若要使用具有更高充电截止电压的正极材料,则需选用更稳定的集流体.实验结果表明,碳纸具有比金属集流体更高的稳定性.其中,碳布是最为合适的集流体,可用作充电截止电压在2.25 V(vsMg/Mg2+)(对“一代”电解液)和2.95 V(vsMg/Mg2+)(对“二代”电解液)以下的可充镁电池正极材料的集流体.
(1) Gregory,T.D.;Hoffman,R.J.;Winterton,R.C.J.Electrochem. Soc.1990,137,775.doi:10.1149/1.2086553
(2)Aurbach,D.;Lu,Z.;Schechter,A.;Gofer,Y.;Gizbar,H.; Turgeman,R.;Cohen,Y.;Moshkovich,M.;Levi,E.Nature 2000,407,724.doi:10.1038/35037553
(3)Yuan,H.T.;Wu,F.;Wu,X.L.;Li,Q.Battery Bimonthly 2002, 32,14.[袁华堂,吴 峰,武绪丽,李 强.电池,2002,32, 14.]
(4) Shen,J.;Peng,B.;Tao,Z.L.;Chen,J.Progess in Chemistry 2012,22,515.[沈 健,彭 博,陶占良,陈 军.化学进展, 2010,22,515.]
(5) Zheng,Y.P.;NuLi,Y.N.;Yang,J.;Chen,Q.;Wang,J.L. Chemical Industry and Engineering Progress 2011,30(5), 1024.[郑育培,努丽燕娜,杨 军,陈 强,王久林.化工进展,2011,30(5),1024.]
(6) Zhao,Q.S.;Nuli,Y.N.;Guo,Y.S.;Yang,J.;Wang,J.L. Progress in Chemistry 2011,23,1598. [赵青松,努丽燕娜,郭永胜,杨 军,王久林.化学进展,2011,23,1598.]
(7)Aurbach,D.;Schechter,A.;Moshkovich,M.;Cohen,Y.; J.Electrochem.Soc.2001,148,A1004.
(8)Aurbach,D.;Gizbar,H.;Schechter,A.;Chusid,O.;Gottlieb,H. E.;Gofer,Y.;Goldberg,I.J.Electrochem.Soc.2002,149,A115.
(9) Gizbar,H.;Vestfrid,Y.;Chusid,O.;Gofer,Y.;Gottlieb,H.E.; Marks,V.;Aurbach,D.Organometallics 2004,23,3826.doi: 10.1021/om049949a
(10) Vestfried,Y.;Chusid,O.;Gofer,Y.;Aped,P.;Aurbach,D. Organometallics 2007,26,3130.doi:10.1021/om061076s
(11) Viestfried,Y.;Levi,M.D.;Gofer,Y.;Aurbach,D. J.Electroanal.Chem.2005,576,183.doi:10.1016/j.jelechem. 2004.09.034
(12)Aurbach,D.;Suresh,G.S.;Levi,E.;Mitelman,A.;Mizrahi,O.; Chusid,O.;Brunelli,M.Adv.Mater.2007,19,4260.doi: 10.1002/(ISSN)1521-4095
(13) Mizrahi,O.;Amir,N.;Pollak,E.;Chusid,O.;Marks,V.; Gottlieb,H.;Larush,L.;Zinigrad,E.;Aurbach,D. J.Electrochem.Soc.2008,155,A103.
(14) Pour,N.;Gofer,Y.;Major,D.T.;Aurbach,D.J.Am.Chem.Soc. 2011,133,6270.doi:10.1021/ja1098512
(15)Arora,P.;White,R.E.;Doyle,M.J.Electrochem.Soc.1998, 145,3647.doi:10.1149/1.1838857
(16) Tarascon,J.;Guyomard,D.Solid State Ionics 1994,69,293. doi:10.1016/0167-2738(94)90418-9
(17) Kanamura,K.;Toriyama,S.;Shiraishi,S.;Takehara,Z. J.Electrochem.Soc.1995,142,1383.doi:10.1149/1.2048586
(18)Dahn,J.R;Fuller,E.W.;Obrovac,M.;Von Sacken,U.Solid State Ionics 1994,69,265.doi:10.1016/0167-2738(94)90415-4
(19) Amatucci,G.;Tarascon,J.;Klein,L.Solid State Ionics 1996, 83,167.
(20) Morita,M.;Shibata,T.;Yoshimoto,N.;Ishikawa,M. Electrochim.Acta 2002,47,2787.doi:10.1016/S0013-4686(02) 00164-0
(21) Kanamura,K.J.Power Sources 1999,81-82,123.
(22) Peng,C.X.Research on the Compatibility between Current Collectors and New Ionic Liquid Electrolytes for Lithium Secondary Batteries.Ph.D.Dissertation,Shanghai Jiaotong University,Shanghai,2008.[彭成信.锂离子电池集流体与新型离子液体电解液的相容性及界面电化学行为研究[D].上海:上海交通大学,2008.]
(23) Ni,J.F.;Zhou,H.H.;Chen,J.T.;Zhang,X.Y.BatteryBimonthly 2005,35,128.[倪江锋,周恒辉,陈继涛,张新祥.电池, 2005,35,128.]
(24) Iwakura,C.;Fukumoto,Y.;Inoue,H.;Ohashi,S.;Kobayashi, S.;Tada,H.;Abe,M.J.Power Sources 1997,68,3013.
(25)Dai,Y.H.;Zhou,Y.M.;Wang,Q.;Tang,Y.W.;Lu,T.H.;Shen, T.Chinese Battery Industry 2007,12,31. [戴跃华,周益明,王 青,唐亚文,陆天虹,沈 涛.电池工业,2007,12,31.]
(26)Aurbach,D.;Turgeman,R.;Chusid,O.;Gofer,Y.Electrochem. Commun.2001,3,252.doi:10.1016/S1388-2481(01)00148-5
(27)Liebenow,C.;Yang,Z.;Lobitz,P.Electrochem.Commun.2000, 2,641.doi:10.1016/S1388-2481(00)00094-1
(28)Tang,Z,Y.;He,Y.B.;Liu,Y.G.;Liu,Q.;Yang,X.X.Corrosion Science and Protection Technology 2007,19,265.[唐致远,贺艳兵,刘元刚,刘 强,阳晓霞.腐蚀科学与防腐技术,2007, 19,265.]
(29) Muldoon,J.;Bucur,C.B.;Oliver,A.G.;Sugimoto,T.;Matsui, M.;Kim,H.S.;Allred,G.D.;Zajicek,J.;Kotani,Y.Energy Environ.Sci.2012,5,5941.
June 20,2012;Revised:August 2,2012;Published on Web:August 3,2012.
Effects of Current Collectors on the Electrochemical Performance of Electrolytes for Rechargeable Magnesium Batteries
CHEN Qiang NULI Yan-Na*YANG Jun KAILIBINUER Kerimu WANG Jiu-Lin
(School of Chemistry and Chemical Technology,Shanghai Jiaotong University,Shanghai 200240,P.R.China)
The effects of metal(platinum,nickel,stainless steel(SS),copper and aluminum)and carbon (carbon fiber,graphite foil and carbon cloth)current collectors on the anodic stability and magnesium deposition-dissolution of the electrolytes(Mg(AlCl2BuEt)2/THF and(PhMgCl)2-AlCl3/THF)for rechargeable magnesium batteries were studied by cyclic voltammetry and constant current deposition-dissolution. Nickel,SS,copper and aluminum current collectors corrode on charging.Nickel and SS exhibit higher stability than the other metals,and can be used as the current collector for the cathode material with a charging voltage under 2.1 V(vs Mg/Mg2+).Copper is suitable for the cathode with a charging voltage under 1.8 V(vs Mg/Mg2+).Furthermore,carbon current collectors have higher anodic stability than metals. Carbon cloth is appropriate for the cathode material with a charging voltage under 2.25 V(vs Mg/Mg2+)in Mg(AlCl2BuEt)2/THF and 2.95 V(vs Mg/Mg2+)in(PhMgCl)2-AlCl3/THF.
Rechargeable magnesium battery; Current collector;Metal;Carbon paper; Electrolyte
10.3866/PKU.WHXB201208032
∗Corresponding author.Email:lyn@sjtu.edu.cn;Tel:+86-21-54745887.
The project was supported by the National Natural Science Foundation of China(20603022,20973112).
国家自然科学基金(20603022,20973112)资助项目
O646
