广西地区人群TNF-α基因启动子区多态性与肝癌的易感性研究
2012-12-06杨艳仇小强曾小云贝春华
杨艳 仇小强, 曾小云 贝春华
1.广西医科大学公共卫生学院流行病学教研室,广西 南宁 530021;
2.桂林医学院,广西 桂林 541004
原发性肝细胞癌(hepatocellular carcinoma,HCC)是一种高度恶性的肿瘤,目前普遍认为它的发生是遗传因素和环境因素共同作用的结果。近年已证实慢性乙肝病毒(hepatitis B virus,HBV)感染是导致肝癌的重要原因,慢性HBV患者中约有10%~25%的患者最终发展为HCC[1]。在我国90%以上肝癌患者伴有HBV感染[2]。HBV的免疫清除,对促进肝功能恢复、防止和减少HCC的发生有着最根本的意义。研究表明,细胞因子作为宿主对炎症反应产生的重要免疫调节介质,在宿主清除病毒的免疫应答、以及抗肿瘤过程中发挥至关重要作用[3-4]。其中TNF-a作为机体炎症应答过程中产生的第1个细胞因子[5],在宿主清除病毒的免疫应答中的作用令人关注。
TNF-α是主要由单核巨噬细胞和T淋巴细胞分泌的细胞因子,其基因位于6号染色体p21区域内,包含于HLAⅢ基因中。研究发现肝癌组织TNF-α表达增多,肝癌患者体内TNF-a水平相对健康人群高,TNF-α参与了肝损伤、肝纤维化及肝癌的病理发生、发展过程[6]。由于TNF-α不是预先储存在细胞内而是在受到刺激时合成的,因此,基因启动子区域中的单核苷酸多态性(single nucleotide polymorphism,SNP)具有重要的意义。近年来已经有研究证实TNF-α基因启动子SNP影响TNF-α的表达,从而使不同个体对某些疾病易感性和疾病进程不同[7]。
本研究是在广西地区开展的一项病例对照研究,以探讨TNF-a基因多态性与HCC易感性的关系。本研究查找HapMap数据库(http://www.hapmap.org/index.html.zh),中国北京的汉族人分型数据,以最小等位基因频率(minor allele frequency,MAF)>5%作为标准[8],同时兼顾位点的生物学功能性,选择了TNF-α基因-1031C/T(rs1799964)和TNF-α基因-308A/G(rs1800629)2个功能性位点进行基因型检测和分析,以评价TNF-α基因多态性对广西地区人群HCC易感性的影响。
1 资料和方法
1.1 临床资料
采用以医院为基础的病例对照研究方法开展本次研究。研究对象包括620例HCC患者和625例非肿瘤患者。参照2001年9月在广州召开的第八届全国肝癌学术会议上正式通过的“原发性肝癌的临床诊断与分期标准”,病例组来源于广西医科大学第一附属医院、附属肿瘤医院和广西中医学院第一附属医院的住院患者。所有患者均为来自于广西地区的经组织病理学或临床确诊、未经放射和抗癌药物治疗的新发病例。对照组选自上述医院同期住院的脊柱骨科、创伤手外科和眼科的非肿瘤患者,无肿瘤病史和特征,无遗传疾病,与病例组来自相同地区(居住10年以上),并按照性别、年龄(±5岁)和民族与病例组频数匹配。
1.2 方法
1.2.1 现场调查
采用调查问卷的方法,经调查对象知情同意后,以统一的调查表收集每个研究对象详细的人口学资料和相关危险因素暴露资料,调查之前对调查人员进行统一培训。并于研究对象入院次日清晨采集空腹外周静脉血3 mL,置于真空ACD抗凝管中,混匀备用,于当日提取基因组DNA。
1.2.2 基因分型
采用常规酚-氯仿法提取研究对象的基因组DNA,-20 ℃保存备用。运用TaqMan MGB实时荧光定量PCR技术对TNF-α基因-1031C/T(rs1799964)和TNF-α基因-308A/G(rs1800629)位点进行基因分型。使用7500 Fast实时荧光定量PCR仪,PCR反应体系总体积为25 μL,包括2×通用PCR Master mix 12.5 μL,40×基因分型试剂0.625 μL,去离子水10.875 μL,DNA (1~10 ng/μL) 1 μL。PCR反应条件为:95 ℃变性10 min,92 ℃退火15 s,60 ℃延伸1 min,共40个循环。7 500 Fast实时荧光定量PCR仪、基因分型分析SDS软件、通用PCR Master mix和基因分型试剂均购于美国ABI公司。
1.3 质量控制
现场调查的质量控制详见文献[9]。实验室质量控制如下:实验采用双盲法进行。实验前先抽取一部分样品进行预实验,充分估计实验中可能遇到的问题。实验过程中严格遵守实验操作规程预防交叉感染。为确定实验的可靠性,设立阳性、阴性对照,随机抽取5%的样本进行重复检测,检测结果一致率为100%。
1.4 统计学处理
数据录入与分析分别采用EpiData 3.0和SPSS 13.0统计软件;用t检验和χ2检验统计分别分析计量资料和计数资料。应用非条件Logistic回归计算比值比(odds ratios,OR)及其95%可信区间(confidence intervals,CI)。所有统计检验均为双侧检验,P<0.05为差异有统计学意义。
2 结 果
2.1 研究对象一般人口学特征
所有研究对象均来自广西地区,年龄16~83岁,病例组平均年龄(48.44±11.07)岁,对照组平均年龄(48.38±12.36)岁,两组的年龄、性别、民族的分布差异均无统计学意义(P>0.05),两组在主要混杂因素方面均衡可比;吸烟、饮酒、慢性HBV感染及有食鱼生史的人数比例,病例组均明显高于对照组,差异有统计学意义(P=0.000,表1)。
2.2 基因型频率分布及与HCC患病风险的关系
625例对照组患者TNF-α基因-1031C/T(rs1799964)和-308A/G(rs1800629)位点基因型频率分布符合Hardy-Weinberg遗传平衡定律(rs1799964:χ2=0.006,P=0.936;rs1800629:χ2=0.226,P=0.635),表明研究对象具有人群代表性。
病例组中TNF-α基因-1031位点TT、CT和CC基因型频率分别为61.60%、34.20%和4.20%,T和C等位基因频率分别为78.70%、21.20%,对照组中TNF-α基因-1031位点TT、CT和CC基因型频率分别为62.40%、33.10%和4.50%,C和T等位基因频率分别为79.00%和21.00%,差异均无统计学意义(P>0.05)。病例组TNF-a基因-308位点GG、GA及AA基因型频率分别为80.00%、19.00%、1.00%,G和A等位基因频率分别为89.50%、10.50%,对照组中TNF-α基因-308位点GG、GA及AA基因型的频率分别为81.60%、17.30%和1.10%,G和A等位基因频率分别为90.20%、9.80%,差异均无统计学意义(P>0.05,表2)。

表1 病例组和对照组的一般人口学特征和环境危险因素分布Tab.1 Demographic and environment risk factors in HCC and controls[n(%)]
多因素Logistic回归分析结果显示,调整年龄、性别、民族、食鱼生史、吸烟、饮酒和慢性HBV感染后,TNF-α基因-1031C/T位点及-308A/G位点各基因型在调整前后与HCC的发病风险均不存在显著关联(表2)。
2.3 基因多态性与环境因素的交互作用分析
利用叉生分析原理,分别计算同时暴露于遗传与环境因素或单独暴露于遗传或环境因素的危险性,即OR值,遗传与环境因素均未暴露的病例和对照组作为共同参比组,即OR=1,从而判别基于不同模型的两因素间交互作用是否存在及其作用大小。通过分别对TNF-α基因-1031位点及-308位点多态性与吸烟、饮酒、食鱼生史和HBV慢性感染等可疑危险因素进行叉生分析,结果显示,-1031位点分别与吸烟、饮酒和HBV慢性感染3种环境危险因素均存在交互作用(因为-1031位点有食鱼生史在对照组中只有一种基因型,所以没能做进一步分析);而-308位点分别与吸烟、饮酒、食鱼生史和HBV感染4种环境危险因素均存在交互作用(表3、4)。
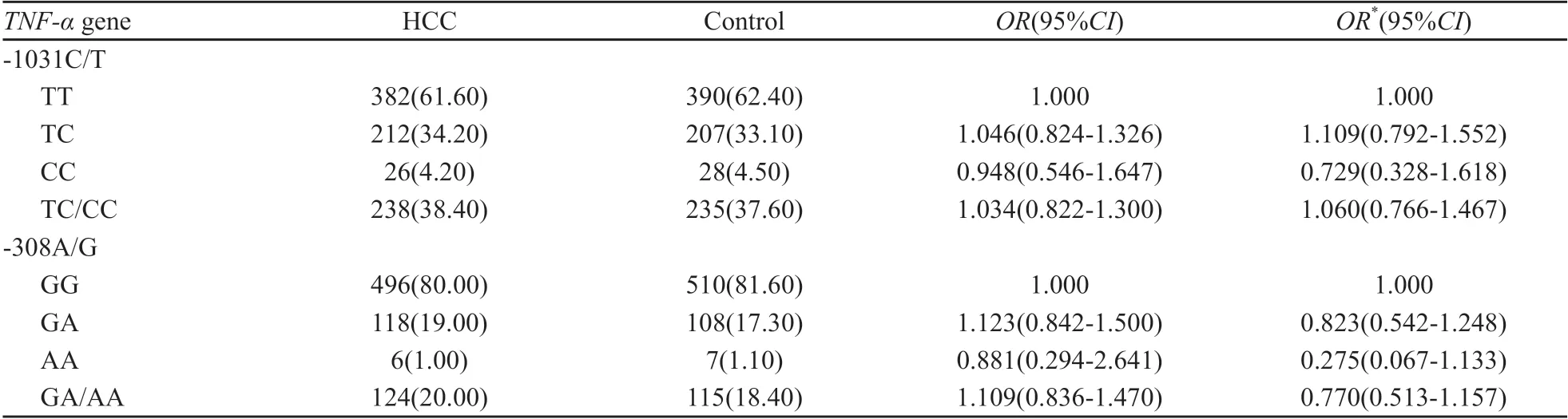
表2 TNF-α基因多态性与HCC的发病风险Tab.2 TNF-α gene polymorphisms and HCC risk[n(%)]

表3 TNF-α基因-1031C/T多态与环境危险因素的交互作用分析Tab.3 Interactions analysis between TNF-α gene -1031C/T polymorphisms with environment risk factors(n)
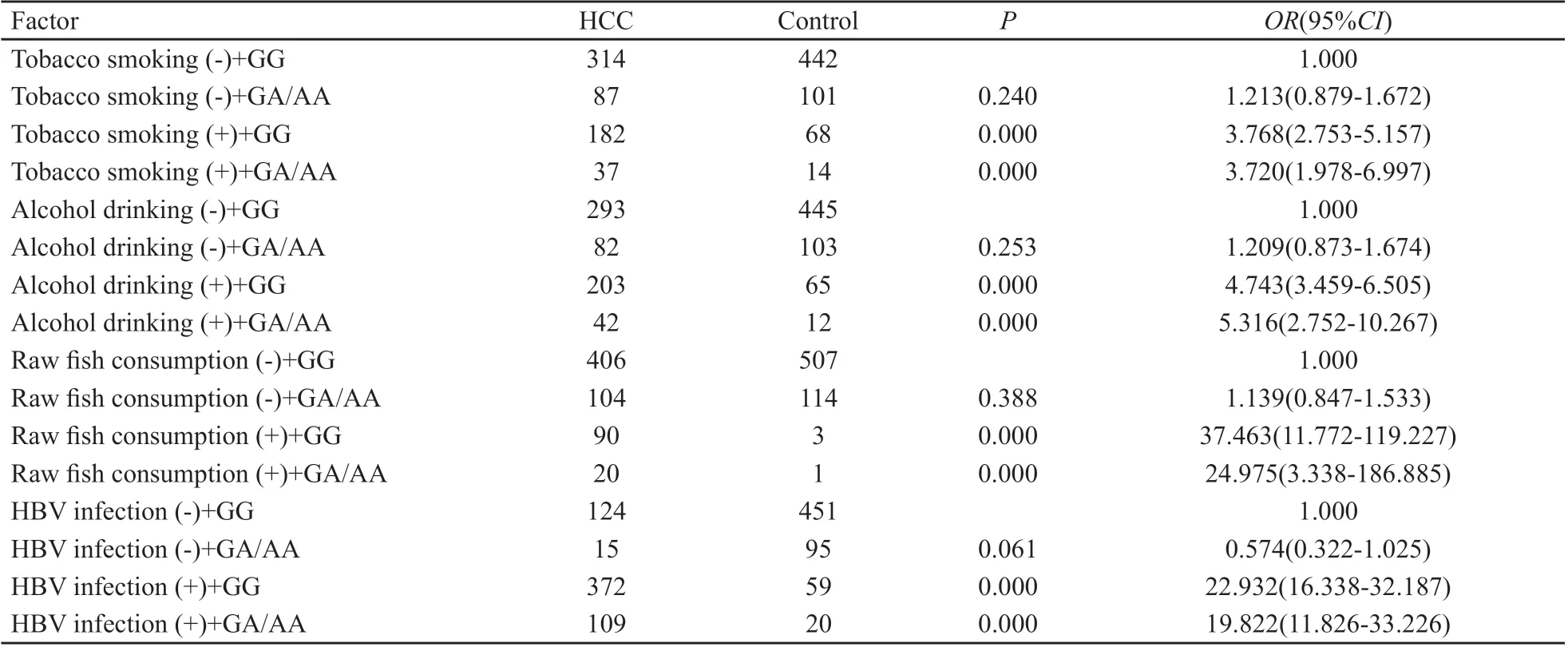
表4 TNF-α-308A/G多态与环境危险因素的交互作用分析Tab.4 Interactions analysis between TNF-α-308A/G polymorphisms with environment risk factors(n)
3 讨 论
基于TNF-α在机体炎症反应中的重要地位,近年来关于TNF-α基因多态性与HBV感染宿主易感性方面一直是研究的热点。TNF-α启动子区存在多个SNPs位点,其中5个典型的SNPs位点分别是-238G/A、-308G/A、-857C/T、-863C/A和-1031T/C,目前研究最多的是-308G/A位点。TNF-α-308位点存在G被A取代的现象,G存在时定义为常见型TNF1,A存在时定义罕见型TNF2[10]。Satoh等[11]的研究结果显示,TNF-α基因启动子区-308位点SNPs可影响TNF-α表达,-308位点G被A替换后,TNF-α转录效率增加7倍。Louis等[12]发现TNF-α-308A等位基因携带者TNF-α全血中的表达水平比G等位基因纯合子高。Ho等[13]对TNF多态研究发现,TNF-α-308A基因型与HCC危险性增加有关,且HCC的危险性随基因型从-308G/G、-308G/A到-308A/A的变化逐渐增高。本研究中,HCC患者携带TNF-α-308A等位基因的频率与非肿瘤患者相比差异无统计学意义(P>0.05),这与Ho等[13]的研究报道不一致,可能是因为存在样本量、种族、地区以及研究方法等方面的不同所致。
TNF-α基因位于6号染色体p21区域内,包含于HLAⅢ基因中。这个有着丰富SNPs的区域存在着广泛的连锁不平衡状态。Hohjoh等[14]发现,取自日本志愿者捐献的外周血单核细胞经刀豆蛋白A激活后,携带TNF-α-1031C/-863A和TNF-α-857T基因的个体比携带TNF-α-1031T/-863C和TNF-α-857C基因的个体,其TNF-α转录活性分别增加了2.0和1.7倍,并且发现-1031C与HLA-DRBl*0901存在在明显的连锁不平衡。Sinha等[15]研究发现携带-1031C/-863A的个体,无论是疟疾患者还是健康患者,其外周血中TNF表达水平比较高,提示TNF-α基因转录活性与其启动子区的多态性有关。我们的研究并未发现单独的携带-1031C等位基因个体与HCC发生的风险有关,可能是因为TNF-α启动子部分的SNPs以单倍型的形式对疾病的发生产生影响;或TNF-α启动子部分的SNPs靠近主要组织相容性复合体(major histocompatibility complex,MHC),使其处于连锁不平衡状态,而后者对某些疾病有重要的影响。
本研究基因与环境的交互作用分析发现,TNF-α基因-1031位点和-308位点SNP与吸烟、饮酒及HBsAg阳性和吸烟、饮酒、食鱼生及HBsAg阳性等环境因素在HCC发生中存在交互作用。在动物模型中,吸烟能激活全身炎症反应,并且通过改变炎症介质或细胞因子的水平来增加TNF-a的表达水平[16-17]。Bennet等[18]发现在吸烟者中,携带-857T等位基因和稀有TNF-α启动子区单倍型的个体其外周血中的TNF-α表达水平较高。Yang等[19]在研究TNF-a基因SNPs及其与吸烟的交互作用对胃癌发生的影响中发现,在吸烟者中,携带TNFα-1031T/C、TNF-α-863C/A、TNF-α-857C/T组成的CAT单倍型的个体罹患胃癌的风险显著增加。本研究发现-1031位点和-308位点SNPs与吸烟有交互作用,可显著增加HCC的患病风险。
宋韶芳等[20]发现,TNF-α-308A等位基因与饮酒、HBsAg阳性、肝病史在HCC发生中存在一定的交互作用,与本研究结果一致。饮酒是肝癌的重要危险因素之一。酒精可以激活某些参与细胞损害的细胞因子(如TNF-α等),诱导细胞色素P450等微粒体酶的活性,影响DNA甲基化和细胞信号通路,增加铁在肝沉积等途径,协同病毒通过激活癌基因(如RAS等),干预细胞凋亡或直接促进基因突变而致癌[21]。本研究发现-1031位点TC或CC基因型同时有饮酒史者患HCC的危险性是无饮酒史TT基因型者的4.71倍,-308位点GA或AA基因型同时有饮酒史者患HCC的危险性是无饮酒史GG基因型者的5.32倍。
HBV感染是HCC的主要危险因素,持续HBV感染者发生HCC的风险比正常人高20倍以上,而且HBV携带者肝脏炎症和肝纤维化程度越严重,其风险越大[22]。临床发现HBV患者的TNF-α含量明显高于健康对照组,它的含量与病毒复制活跃有关,并且随炎症程度及纤维化程度加重而升高[23]。本研究结果显示,-1031位点TC或CC基因型同时有HBsAg阳性者患HCC的风险是TT基因型HBsAg阴性者的25.43倍,-308位点GA或AA基因型同时伴HBsAg阳性者患HCC的危险性是GG基因型同时HBsAg阴性者的19.82倍。
本研究发现-308位点GA或AA基因型同时喜食鱼生者患HCC的危险性是无食鱼生史的GG基因型者的24.98倍,这可能与广西地区人群喜食鱼生而感染肝吸虫有关。由于肝吸虫的刺激及其分泌物的毒性作用,可使胆管上皮细胞增生,长期的刺激使这类患者的炎症反应和胆管上皮异常增生比不携带TNF-α-308A等位基因的患者严重,导致癌变的风险增加[20]。
虽然本次研究未提示-1031位点和-308位点SNPs与HCC的发生有明显的关联,但表明吸烟、饮酒、食鱼生及HBsAg这些环境因素与SNPs在HCC的发生中存在一定的交互作用,这种交互作用加重了单一因素对机体的危害。目前,虽然不能通过改变个体的基因型来预防HCC的发生,但是可以通过改变环境危险因素的暴露措施,如改变不良生活习惯、接种乙肝疫苗等措施减少肝癌的发生、发展。
[1]LOK A S, HEATHCOTE E J, HOOFNAQUE J H.Management of hepatitis B: 2000-summary of a workshop [J].Gastroenterology, 2001, 120(7): 1828-1853.
[2]THAKUR V, GUPTAN R C, KAZIM S N, et al.Profile, spectrum and significance of HBV genotypes in chronic liver disease patients in the Indian subcontinent [J].J Gastroenterol Hepatol, 2002, 17(2): 165-170.
[3]FERRARI C, PENNA A, BERTOLETTI A, et al.Antiviral cell-mediated immune responses during hepatitis B and hepatitis C virus infections [J].Recent Results Cancer Res, 1998, 154(8): 330-336.
[4]VGAS G N.Immunobiology of persistent blood-borne viral infections [J].Dev Biol, 2000, 102(1): 9-17.
[5]WARZOCHA K, RIBEIRO P, BIENVENU J, et al.Genetic polymorphisms in the tumor necrosis factor locus influence non-Hodgkin’s lymphoma outcome [J].Blood, 1998, 91(10): 3574-3581.
[6]BUDHU A, WANG X W.The role of cytokines in hepatocellular carcinoma [J].J Lecukoc Biol, 2006, 80(6): 1197-1213.
[7]HAJEER A H, HUTCHINSON I V.Influence of TNF alpha gene polymorphisms on TNF alpha production and disease [J].Hum Immunol, 2001, 62(11): 1191-1199.
[8]STEPHENS J C, SCHNEIDER J A, TANGUAY D A, et al.Haplotype variation and linkage disequilibrium in 313 human genes [J].Science, 2001, 293(5529): 489-493.
[9]曾小云, 余红平, 仇小强.广西肝癌高发区人群XRCC3 基因多态性与肝癌易感性研究 [J].中华肿瘤防治杂志, 2009, 16(21): 1629-1633.
[10]WILSON A, SYMONS J, MCODOWELL T, et al.Effects of polymorphism in the human tumor necrosis factor-α promoter on transcriptional activation [J].Proc Natl Acad U S A, 1997, 94(7): 3195-3199.
[11]SATOH J, FUJIWARA F, ISHII M.TNF-alpha gene polymorphism,insulin resistance and type 2 diabetes in humans [J].Nippon Rinsho, 2005, 63(2): 189-192.
[12]LOUIS E, FRANCHIMONT D, PIRON A, et al.Tumour necrosis factor (TNF) gene polymorphism influences TNFalpha production in lipopolysaccharide (LPS)-stimulated whole blood cell culture in healthy humans [J].Clin Exp Immunol, 1998, 113(3): 401-406.
[13]HO S Y, WANG Y J, CHEN H L, et al.Increased risk of developing hepatocellular carcinoma associated with carriage of the TNF2 allele of the -308 tumor necrosis factor-alpha promoter gene [J].Cancer Causes Control, 2004, 15(7): 57-63.
[14]HOHJOH H, TOKUNAGA K.Allele-specific binding of the ubiquitous transcription factor OCT-1 to the functional single nucleotide polymorphism (SNP) sites in the tumor necrosis factor- alpha gene (TNFA) promoter [J].Genes Immun, 2001, 2(2): 105-109.
[15]SINHA S, MISHRA S K, SHARMA S, et al.Polymorphisms of TNF-enhancer and gene for FcgammaRIIa correlate with the severity of falciparum malaria in the ethnically diverse Indian population [J].Malar J, 2008, 7(1): 13.
[16]ZHANG C, CAI S, CHEN P, et al.Inhibition of tumor necrosis factor-alpha reduces alveolar septal cell apoptosis in passive smoking rats [J].Chin Med J (Engl), 2008, 121(7): 597-601.
[17]CHURG A, DAI J, TAI H, et al.Tumor necrosis factor alpha is central to acute cigarette smoke-induced inflammation and connective tissue breakdown [J].Am J Respir Crit Care Med, 2002, 166(6): 849-854.
[18]BENNET A M, VAN MAARLE M C, HALLQVIST J, et al.Association of TNF-alpha serum levels and TNF A promoter polymorphisms with risk of myocardial infarction [J].Atherosclerosis, 2006, 187(2): 408-414.
[19]YANG J J, KO K P, CHO L Y, et al.The role of TNF genetic variants and the interaction with cigarette smoking for gastric cancer risk: a nested case-control study [J].BMC Cancer, 2009, 9(7): 238.
[20]宋韶芳, 郜艳晖, 陈思东.TNF-α-308位点基因多态性与环境因素在肝癌发生中的交互作用 [J].广东药学院学报, 2009, 25(2): 196-201.
[21]CHUANG S C, LA VECCHIA C, BOFFETTA P.Liver cancer: descriptive epidemiology and risk factors other than HBV and HCV infection [J].Cancer Lett, 2009, 286(1): 9-14.
[22]SHERLOCK S.Viruses and hepatocellular carcinoma [J].Gut, 1994, 35(6): 828-832.
[23]苏是苍, 李承彬, 胡勤明.慢性乙肝肝纤维化不同分期TNF-α、NO和内毒素水平变化 [J].标记免疫分析与临床, 2006, 13 (3): 131-132.
