贝伐单抗联合化疗治疗晚期多程治疗失败后的非小细胞肺癌临床观察
2012-05-30黄诚张晶柯明耀倪敏王馨崔同建吴标
黄诚 张晶 柯明耀 倪敏 王馨 崔同建 吴标
1.福建医科大学教学医院,福建省肿瘤医院内科,福建 福州350014;
2.厦门市第二医院呼吸内科,福建 厦门361002;
3.南京军区福州总医院肿瘤侨宾科,福建 福州350014
4.厦门大学附属中山医院肿瘤内科,福建 厦门361002;
5.福建省立医院肿瘤内科,福建 福州350001
晚期非小细胞肺癌(non-small cell lung cancer,NSCLC)经一线、二线和三线治疗后疾病进展的患者,目前尚无标准的治疗方案,通常只能予以最佳支持治疗或进入临床试验。本院联合厦门市第二医院、南京军区福州总医院、厦门大学附属中山医院、福建省立医院,自2010年1月—2011年2月对35例晚期多程治疗失败后的NSCLC患者予以贝伐单抗(bevacizumab)联合不同化疗药物进行试验性治疗,探讨治疗的疗效及安全性。
1 资料和方法
1.1 入选标准
患者年龄18~75岁;ECOG体能状况(PS)0~2分;经病理学和(或)细胞学诊断确诊的晚期多程化疗和(或)靶向治疗2个方案以上(包括2个方案)失败的NSCLC患者,鳞癌除外;至少具有1个双径可测量的病灶,胸片、普通CT或MRI扫描病灶≥20 mm,螺旋CT或PET-CT扫描病灶≥10 mm;预计生存期≥3个月;符合化疗的指征和基本要求,包括外周血象基本正常,心、肝、肾功能无明显异常,心电图基本正常,无严重高血压(<150/100 mmHg)及出血性疾病,机体无未愈合的创伤;既往未采用贝伐单抗治疗;无化疗禁忌证;签署知情同意书。
1.2 临床资料
35例晚期NSCLC患者中,男性14例,女性21例;年龄32~74岁,中位年龄57岁;其中腺癌30例,未分类癌5例;合并脑转移8例,肺转移22例,骨转移12例,胸腔积液10例,肝转移2例,肾上腺转移3例;ECOG评分为1分27例,2分8例;35例均为Ⅳ期;既往经过1个方案治疗的6例,2个方案的8例,3个方案的10例,治疗方案≥4个的11例,最多的化疗周期数为18个周期。从诊断Ⅳ期到本治疗开始≤6个月的12例,6个月~1年2例,1年~2年10例,>2年11例。25例 (占71.4%)经过表皮生长因子受体酪氨酸激酶抑制剂(EGFR-TKI)治疗。
1.3 方法
1.3.1 研究设计
前瞻性多中心研究。主要目标为客观疗效、肿瘤进展时间,次要目标为不良反应及总生存期(overall survival,OS)。
1.3.2 给药方法
单药化疗方案为主(PS 0~1分联合化疗方案),选择二线化疗药物或未用过的第三代化疗药物或既往有疗效的药物。各药用法及剂量如下:多西他塞75 mg/m2,静脉滴注,第1天;吉西他滨1 000 mg/m2,静脉滴注,第1、8天;长春瑞滨 25 mg/m2,静脉推注,第1、8天;紫杉醇150 mg/m2,静脉滴注,第1天;培美曲赛500 mg/m2,静脉滴注,第1天;顺铂75 mg/m2,静脉滴注,第1天,或25 mg/m2,静脉滴注,第1~3天给药;卡铂(AUC5-6),静脉滴注,第1天;洛铂30 mg/m2,静脉滴注,第1天。所有方案每3周重复。
贝伐单抗7.5 mg/m2+0.9%NaCl溶液250 mL,静脉滴注,化疗第1天,每3周重复。贝伐单抗滴注第1次持续90 min。如耐受性良好,第2次可为60 min,如果耐受良好,以后的输注可控制在30 min。
1.4 疗效评价
近期疗效按照实体瘤近期客观疗效评价标准(RECIST 1.0)进行评价,分为完全缓解(CR)、部分缓解(PR)、稳定(SD)及进展(PD)。客观有效率(RR)=(CR+PR)/总例数×100%;疾病控制率(DCR)=(CR+PR+SD)/总例数×100%。
无进展生存时间(PFS)是指患者随机入组至任何有记录的病变进展之日或任何原因引起的死亡之日的时间。自判定疗效为CR、PR或SD之日开始,每2个月定期随访1次,以观察有效或SD患者的PFS。OS是指患者首次用药到任何原因死亡的时间。
1.5 不良反应
按美国国立癌症研究所制定的通用药物毒性标准(NCI CTC 3.0版)进行评价。
1.6 统计学处理
采用SPSS 13.0统计软件建立数据库进行统计分析。生存时间、生存率以Kaplan-Meier法计算并绘制生存曲线,P<0.05为差异有统计学意义。
2 结 果
2.1 治疗完成情况
单药+贝伐单抗25例,其中培美曲赛+贝伐单抗8例,长春瑞滨+贝伐单抗的10例,多西他塞+贝伐单抗4例,紫杉醇+贝伐单抗2例,吉西他滨+贝伐单抗的1例;联合化疗+贝伐单抗10例,其中培美曲赛+卡铂+贝伐单抗2例,吉西他滨+卡铂+贝伐单抗2例,多西他赛+顺铂+贝伐单抗1例,多西他赛+洛铂+贝伐单抗1例,长春瑞滨+顺铂+贝伐单抗2例,紫杉醇+卡铂+贝伐单抗1例,紫杉醇+洛铂+贝伐单抗1例。化疗方案的选择多为以往未用过的三代化疗药物或以往用过的药物中有疗效的药物。
总共完成治疗周期数为112个,平均3.2个周期。其中6例完成1个周期,8例完成2个周期,3例完成3个周期,12例完成4个周期,3例完成5个周期,3例完成6个周期以上。2例因经济原因化疗1个周期,1例化疗1个周期后因下肢静脉血栓未再治疗,32例进入疗效分析。全部患者均可评价不良反应。
2.2 疗效
32例可评价疗效,CR 0例(0%),PR 7例(21.9%),SD 18例(56.2%),PD 7例(21.9%),RR为21.9%(7/32),DCR为78.1%(25/32),具体结果见表1。所有患者的随访截止日期为2011年10月1日,中位随访时间8个月,失访1例,已死亡13例。本组中位PFS为3个月,95%CI为2.015~3.985个月(图1)。本组中位OS为8个月,95%CI为7.106~8.894个月(图2)。
2.3 不良反应
不良反应多为Ⅰ、Ⅱ级,Ⅲ、Ⅳ级的白细胞下降与化疗有关。与贝伐单抗相关的不良反应中Ⅰ、Ⅱ级高血压发生率为17.1%(6/35),Ⅰ、Ⅱ级蛋白尿发生率为20%(7/35)。出血发生率为22.9%(8/35),Ⅰ、Ⅱ级出血发生率为20%(7/35)多为鼻衄和少量咯血,Ⅲ级出血为咯血并出现Ⅲ级贫血1例(2.9%)。Ⅲ级下肢深静脉血栓1例(2.9%),予以抗凝治疗(表2)。
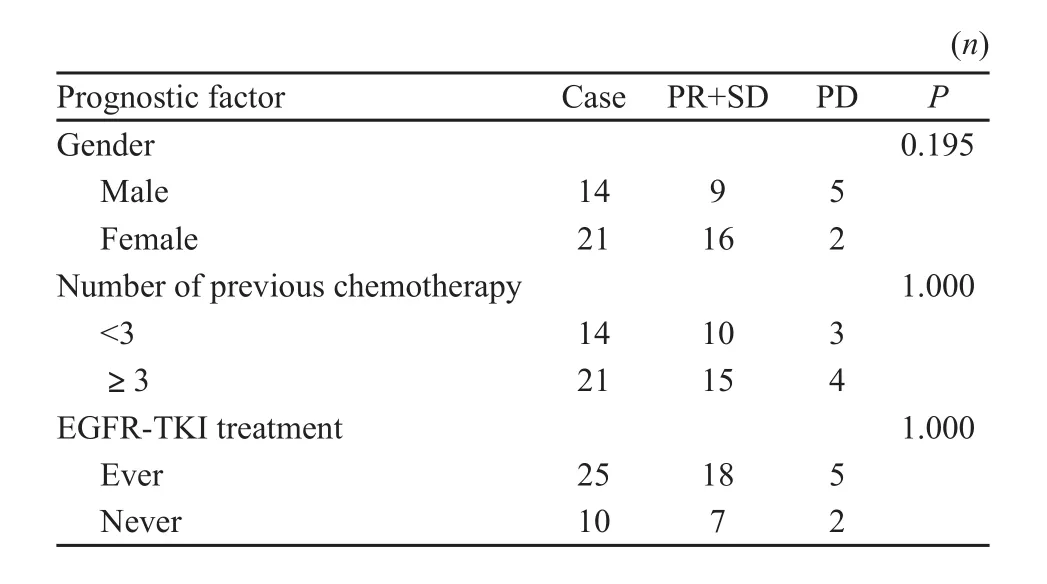
表 1 贝伐单抗联合化疗治疗晚期多程治疗失败后的NSCLC各亚组疗效差异Tab.1 The sub-group eff i cacy of bevacizumab plus chemotherapy in advanced NSCLC after failure of multipletreatment
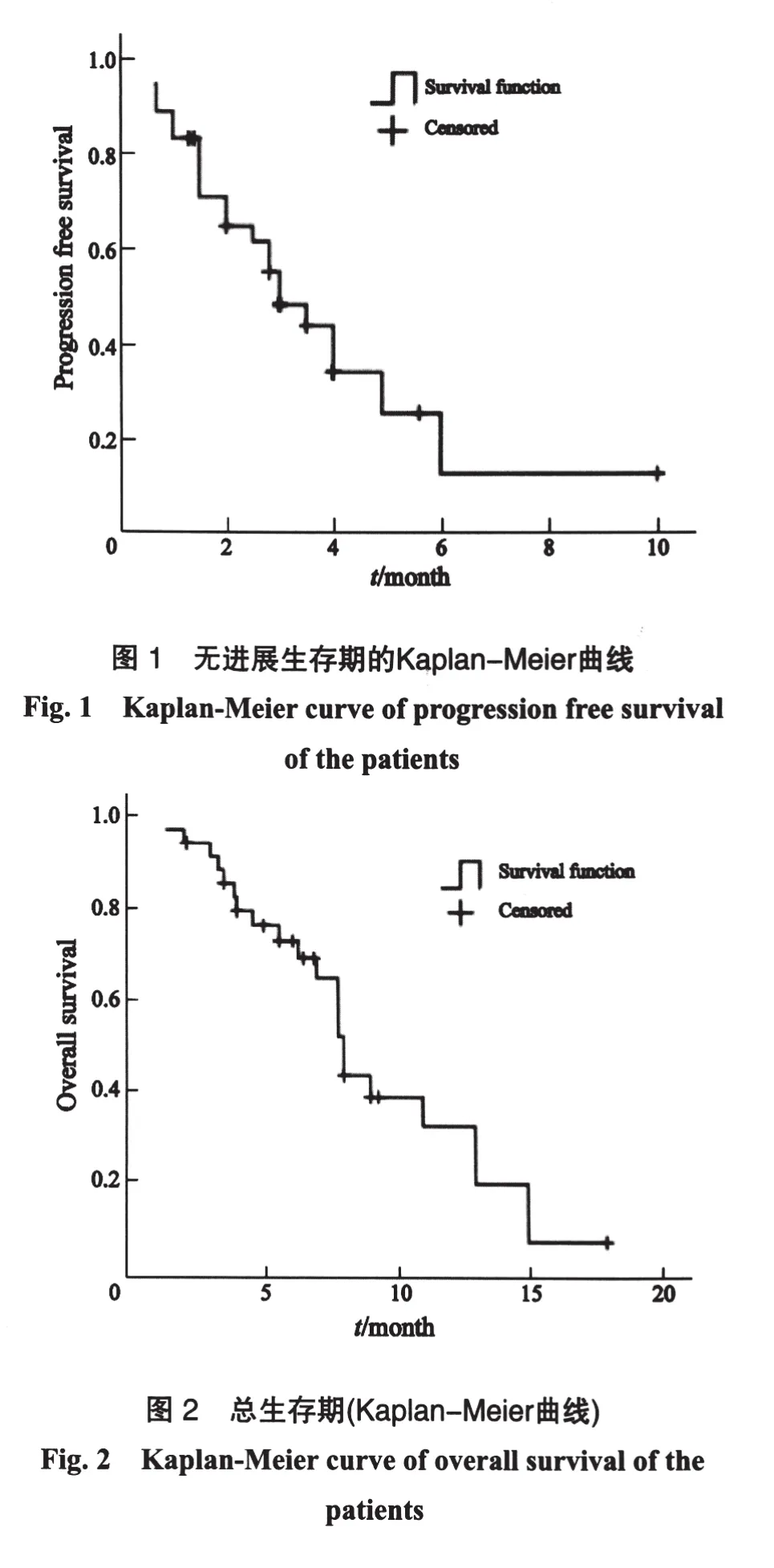

表 2 贝伐单抗联合化疗治疗晚期多程治疗失败后NSCLC的不良反应Tab.2 The adverse events of bevacizumab plus chemotherapy in advanced NSCLC after failure of multiple-treatment
3 讨 论
晚期NSCLC的一线标准治疗方案是以三代新药加铂类为主,缓解率为35%,中位生存时间为9~11个月,1年生存率为30%~35%[1]。二线化疗单药多西他赛、培美曲塞,MST约5~8个月,有效率为10%[2-3]。EGFR-TKI应用于晚期NSCLC的二线或三线治疗,部分患者得以长期生存[4]。对于已予上述治疗后病情进展的患者,目前没有标准的治疗方案。
贝伐单抗是一种可特异性结合VEGF的人源化单克隆抗体,并可阻断VEGF受体的激活。贝伐单抗抑制VEGF的结果包括能使现有的肿瘤血管退化,从而切断肿瘤细胞生长所需氧气及其他营养物质;抑制肿瘤新生和再生血管生成,从而持续抑制肿瘤细胞的生长和转移;使存活的肿瘤血管正常化,降低肿瘤组织间渗透压,改善化疗药物向肿瘤组织内的传送,提高化疗效果[5-6]。ECOG 4599研究证实,贝伐单抗15 mg/kg联合紫杉醇加卡铂一线治疗非鳞型晚期NSCLC与单纯紫杉醇加卡铂化疗比较,不仅能显著提高客观缓解率(27%vs10%,P<0.000 1)及无进展生存期(6.4和4.5个月,P<0.000 1),同时也显著延长患者生存时间,中位生存期分别为12.3和10.2个月(P=0.007)[7]。亚组分析则显示,腺癌患者的生存期更达到了14.2个月。因此FDA已经批准贝伐单抗与紫杉醇加卡铂联合应用一线 治疗无脑转移,无出血史的晚期非鳞型NSCLC。此后的AVAIL研究也证实,贝伐单抗15与7.5 mg/kg联合化疗(吉西他滨+顺铂)较单用化疗(吉西他滨+顺铂)改善了RR及PFS,但联合贝伐单抗15或7.5 mg/kg在疗效及PFS上差异无统计学意义[8]。
Socinski等[9]对贝伐单抗在非鳞癌型NSCLC脑转移患者中的安全性进行了研究,入组115例,76例为一线治疗(贝伐单抗为15 mg/kg+铂类为主的双药化疗或厄洛替尼),39例为二线治疗(贝伐单抗15 mg/kg +单药化疗或厄洛替尼),106例可进行安全性评价,贝伐单抗中位用药周期为5个周期,没有报告≥2的中枢神经系统出血。出现严重不良反应2例,均为肺出血。作者认为贝伐单抗联合化疗或厄洛替尼治疗非鳞癌型NSCLC脑转移患者是安全的,中枢神经系统出血发生率低。Heist等[10]报告了贝伐单抗联合培美曲赛+奥沙利铂治疗复治进展期NSCLC的Ⅱ期研究,PR占27%,SD占44%,PD占29%,中位PFS为5.8个月(95%CI:4.1~7.8),中位OS为12.5个月(95%CI:7.3~17)。不良反应可以耐受。Adjei等[11]也报告了另一项Ⅱ期研究,贝伐单抗联合培美曲赛二线治疗晚期NSCLC,中位PFS为4.0个月,中位OS为8.6个月。因此,贝伐单抗联合化疗治疗复治的晚期NSCLC是有前途的一种治疗方案,而且对脑转移的病例也是安全的。
本研究中的35例肺癌患者均为多程治疗的病例,其中脑转移的病例占22.9%(8/35),经过三线治疗的病例占60%(21/35)。所取得的治疗效果与文献报道的二线治疗相似,耐受性好。因此,贝伐单抗联合化疗对晚期多程治疗失败后的NSCLC有一定的抗肿瘤活性和较高的疾病控制率,安全性较好,临床获益率高,是一种有临床应用前景的治疗方法。
[1]BUNN P A J R, THATCHER N.Systemic treatment for advanced (stage Ⅲb/Ⅳ) non-small cell lung cancer: more treatment options: more things to consider.Conclusion[J].Oncologist, 2008, 13(Suppl 1): 37-46.
[2]SHEPHERD F A, DANCEY J, RAMLAU R, et al.Prospective randomized trial of docetaxel versus best supportive care in patients with non-small cell lung cancer previously treated with platinum-based chemotherapy[J].J Clin Oncol, 2000,18(10): 2095-2103.
[3]HANNA N, SHEPHERD FA, FOSELLA FV, et al.Randomized phase Ⅲ trial of pemetrexed versus docetaxel in patients with non-small cell lung cancer previously treated with chemotherapy[J].J Clin Oncol, 2004, 22(9): 1589-1597.
[4]SHAO Y Y, LIN C C, YANG C H, et al.Gefitinib or erlotinib in the treatment of advanced non-small cell lung cancer[J].Discov Med, 2010, 9(49): 538-545.
[5]WILLETT C G, BOUCHER Y, TOMASO E, et al.Direct evidence that the VEGF-specific antibody bevacizumab has antivascular effects in human rectal cancer[J].Nat Med,2004, 10(2): 145-147.
[6]GERBER H P, FERRARA N.Pharmacology and pharmacodynamics of bevacizumab as monotherapy or in combination with cytotoxic therapy in preclinical studies[J].Cancer Res, 2005, 65(3): 671-680.
[7]SANDLER A, GRAY R, PERRY M C, et al.Paclitaxelcarboplatin alone or with bevacizumab for non-small cell lung cancer[J].N Engl J Med, 2006, 355(24): 2542-2550.
[8]RECK M, VON PAWEL J, ZATLOUKAL P, et al.PhaseⅢ trial of cisplatin plus gemcitabine with either placebo or bevacizumab as first-line therapy for nonsquamous non-small cell lung cancer: AVAil[J].J Clin Oncol, 2009, 27(8):1227-1234.
[9]SOCINSKI M A, LANGER C J, HUANG J E, et al.Safety of bevacizumab in patients with non-small cell lung cancer and brain metastases[J].J Clin Oncol, 2009, 27(31): 5255-5261.
[10]HEIST R S, FIDIAS P, HUBERMAN M, et al.A phaseⅡ study of oxaliplatin, pemetrexed, and bevacizumab in previously treated advanced non-small cell lung cancer[J].J Thorac Oncol, 2008, 3(10): 1153-1158.
[11]ADJEI A A, MANDREKAR S J, DY G K, et al.Phase Ⅱ trial of pemetrexed plus bevacizumab for second-line therapy of patients with advanced non-small cell lung cancer: NCCTG and SWOG study N0426[J].J Clin Oncol, 2010, 28(4):614-619.
