一氧化碳分子在Pt/t-ZrO2(101)表面的吸附性质
2012-12-05满梅玲陆春海陈文凯章永凡
满梅玲 陆春海 陈文凯,* 李 奕 章永凡
(1福建省光催化重点实验室—省部共建国家重点实验室培育基地,福州大学化学系,福州350002; 2成都理工大学核技术与自动化工程学院,成都610059)
一氧化碳分子在Pt/t-ZrO2(101)表面的吸附性质
满梅玲1陆春海2陈文凯1,*李 奕1章永凡1
(1福建省光催化重点实验室—省部共建国家重点实验室培育基地,福州大学化学系,福州350002;2成都理工大学核技术与自动化工程学院,成都610059)
运用广义梯度密度泛函理论(GGA-PW91)结合周期平板模型方法,研究了CO分子在完整与Pt负载的四方ZrO2(101)表面的吸附行为.结果表明:表面第二层第二氧位和表面第二桥位分别为CO分子和Pt原子在完整ZrO2(101)表面的稳定吸附位,且覆盖度为0.25 ML(monolayer)时均为稳定吸附构型,吸附能分别为56.2和352.7 kJ·mol-1.CO分子在负载表面的稳定吸附模式为C-end吸附,吸附能为323.8 kJ·mol-1.考察了CO分子在负载表面吸附前后的振动频率、态密度和轨道电荷布居分析,并与CO分子和Pt原子在ZrO2表面的结果进行比较.结果表明,C端吸附CO分子键长为0.1161 nm,与自由的和吸附在ZrO2表面后的CO相应值(0.1141和0.1136 nm)相比伸长.吸附后C―O键伸缩振动频率为2018 cm-1,与自由CO分子相比发生红移;吸附后CO带部分正电荷,电子转移以Pt 5d➝CO 2π的π反馈机理占主导地位.
密度泛函理论;四方型二氧化锆;一氧化碳;吸附;铂
1 引言
一氧化碳在氢燃料电池中被称为失活催化剂,1一氧化碳的氧化反应是研究氧化型催化剂活性最普遍的反应;2在聚合物电解质燃料电池中,即使很低浓度的CO也能够在阳极产生CO中毒而引起很严重的破坏.3如何消除一氧化碳或将其转化成无害物质已成为实验4-9和理论10-22研究的热点,而金属氧化物负载贵金属是非常好的消除CO的催化剂. CO在贵金属表面上吸附的反应机制通常起关键作用的是活泼金属和载体,23贵金属如Pt、Pd、Rh等是三效催化剂中的有效成分;贵金属在金属氧化物上的负载能增强催化活性和减少催化剂成本,同时能够将CO、HCs(hydrocarbons)和NOx等污染气体转化为CO2和N2.在众多金属氧化物中,ZrO2由于具有特定的物理化学性质,包括表面酸碱性、氧化还原性、良好的热稳定性、抗催化中毒性,使其成为一种很具吸引力的催化剂和催化剂载体.24-27
江凌等28报道了CO在过渡金属表面上的吸附,结果表明吸附强度为Pd>Pt>Cu>Ag>Au.任云鹏等29用密度泛函理论(DFT)方法研究了CO分子在Pt低指数面的吸附,结果发现,当CO的覆盖率为0.25 ML时,其在Pt(100)面桥位的吸附能为203.6 kJ· mol-1;在Pt(100)面最大吸附能为228.7 kJ·mol-1;在Pt(111)面hcp位的吸附能为189.1 kJ·mol-1,与文献30计算的201.7 kJ·mol-1相吻合.Yamagishi等31用DFT方法研究了CO分子在Pt(100)、Pt(410)和Pt(110)面的吸附,研究考虑了吸附的吸附能、吸附构型和振动频率,结果表明,覆盖度对CO分子在不同Pt表面上的吸附能影响并不明显,且稳定吸附能和频率的理论预测值与实验数据32,33相吻合.Anez等34用Gaussian 03软件包ONIOM2方法35研究了CO和H2O分子在四方ZrO2(110)和(101)表面的吸附,结果表明CO分子在(110)表面的最佳吸附位为连接两个Zr原子的桥位,吸附能为90.8 kJ·mol-1;在(101)表面的最佳吸附位为连接Zr和O原子的桥位,吸附能为97.9 kJ·mol-1.Dilara等36研究发现在300 K时Pt可以在ZrO2(100)面形成层状结构,但当温度超过700 K时,Pt层就会凝聚成颗粒状,高分辨电子能量损失谱证实CO能在Pt-ZrO2(100)界面发生吸附. Zhu等37研究了CO在Pt/ZrO2上的吸附,结果表明,随着烧结温度的增加,CO的吸附量明显减少.Graf等38报道了Pt/ZrO2催化水煤气转换反应中羟基的反应性,研究表明单配位的羟基在ZrO2载体上能与CO反应形成甲酸盐,多配位的羟基甲酸盐需在Pt存在时才会发生分解生成H2和CO2,说明甲酸盐物种的反应性与Pt颗粒有关.同时,Pt/ZrO2已经在许多领域有广泛应用,如作为传感器、固体氧化物燃料电池39和催化剂.40,41目前对于CO在Pt/ZrO2的吸附研究理论研究方面未见报道.
本文采用密度泛函理论结合周期平板模型方法,模拟了Pt负载前后CO分子的吸附行为.对不同吸附构型进行构型优化以及电荷、频率和态密度的分析,目的主要是探讨CO分子吸附前后吸附性质的变化,为实验研究提供一定的理论依据.
2 模型和计算方法
四方ZrO2晶型相当于立方萤石型结构沿着c轴伸长而变形的晶体结构,空间群为P42/nmc.由于四方ZrO2最稳定表面为(101)表面,42因此本文计算选取t-ZrO2(101)-2×2九层平板厚度来讨论CO分子在Pt/ZrO2表面的吸附,如图1所示.相邻两层平板间的真空层厚度设为1 nm,以确保平板间的分子间相互作用力足够小.
通过对蚊虫的标记、释放、回捕研究发现,由于蚊虫不具有对宿主和孽生地位置的记忆能力,所以蚊虫在初期是通过随机扩散搜寻吸血目标;一旦蚊虫飞行到足以感应目标所在位置的距离之后,蚊虫通过定向飞行接近宿主并完成吸血活动[10]。本研究以蚊笼中饲养的斯氏按蚊为研究对象,旨在通过对比不同条件下的按蚊吸血率,讨论影响按蚊吸血行为中定向飞行阶段的诸多因素。
本文采用广义梯度密度泛函理论和周期平板模型方法模拟CO分子的吸附行为,所有计算均由Dmol3软件包43-45实现.广义梯度近似下的PW91泛函46被用来描述交换相关能,Pt和Zr原子内层电子由有效核电势(ECP)代替,价电子波函数采用双数值基加极化函数(DNP)展开,非金属原子C和O采用全电子基组.Brillouin zone积分的Monkhorst-Pack网络参数设为2×3×1.优化时固定下面六层,表面三层放开.
(1)红柳泉油田下干柴沟组下段圈闭主要为岩性圈闭,类型有砂岩上倾尖灭岩性圈闭、物性封闭岩性圈闭(成岩圈闭)、砂岩透镜体三种。
对于Pt原子在ZrO2(101)表面的吸附同样考虑如图1所示的八种吸附位.构型优化后,除在Osub2吸附位外,其他吸附位构型均转化为同一种构型,吸附能在331.8-352.7 kJ·mol-1之间.表3只列出了Osub2位和bri2位的构型参数、吸附能及电荷.由表可见,Pt原子带部分负电荷,说明电子由底物向Pt原子转移,且bri2位所带电荷更多.吸附后Zr原子均得电子,O原子均失电子,说明O原子转移电子给Pt原子,Pt原子又将部分电子转移给Zr原子.表4给出了吸附前后Pt原子的轨道布居,固体Pt的价电子组成为6s15d9.吸附后在Osub2和bri2位分别变成6s1.0545d8.8226p0.276和6s1.1705d8.8846p0.142.可见,吸附后两种吸附位的Pt原子d轨道分别失去0.178e和0.116e,而s轨道分别得到0.054e和0.170e,p轨道分别得到0.276e和0.142e,净结果为Pt原子分别得到0.152e和0.196e.

图1 t-ZrO2(101)-2×2超晶胞平板模型Fig.1 Side view and top view for the slab model of t-ZrO2(101)-2×2 supercellLight blue and red balls represent Zr and O atoms,respectively. Osurf1and Osurf2represent two different O sites of top surface;Osub1and Osub2represent two different O sites of sub-surface;Zraand Zrb represent two different Zr sites;bri1 and bri2 represent two different bridge sites.

表1 CO分子在ZrO2(101)表面吸附的几何构型参数和吸附能Table 1 Geometrical parameters and adsorption energies for CO adsorbed on ZrO2(101)surface

3.3.1 吸附构型、吸附能和振动频率
3 结果与讨论
3.1 CO在ZrO2(101)面的吸附研究
3.1.1 不同吸附位的吸附活性
对CO分子在t-ZrO2(101)表面的吸附,本文选取如图1所示的Osurf1、Osurf2(表层两种不同O位),Osub1、Osub2(次表层两种不同的O位),Zra、Zrb(a,b指代两种不同Zr位),bri1和bri2(1,2指代两种不同桥位)共八种吸附位,分别考虑了CO分子以C-end、O-end和parallel(以下简称para)吸附模式吸附于表面,不同构型优化后,计算得到的几何构型参数及吸附能列于表1.
基于以上分析,以下仅考虑bri2位上的吸附情况.对Pt原子的覆盖度我们采用和CO分子一样的方法,即定义0.25、0.5和1 ML分别指在ZrO2(101)-2×2超晶胞、1×2超晶胞和1×1超晶胞上分别吸附一个Pt原子时的覆盖度.计算结果列于表5.如图1俯视图中的Zrb位有4个等价吸附位,Zrb位和Zr4之间的原子距离为0.3531 nm,而Zrb位和Zr6之间的原子距离为0.6060 nm.由于前者距离较小会使得Pt原子易与邻近单胞的Pt原子发生相互作用而形成二聚体结构.
具体选择哪一种接班模式,家族企业需要充分考虑内、外部因素及其对能力和忠诚两个维度的影响。企业外部因素短期是无法去改变的,企业只能去适应。决定家族企业接班模式选择的主要是内部因素。[7]企业在不同的发展阶段,企业内部影响因素有很大的变化,从而出现不同阶段选择不同的接班模式,[8]见表2。
图2给出了Pt原子在ZrO2(101)表面吸附前后的态密度图,以利于进一步分析Pt原子的作用机理.从图中可以看到,与吸附前相比,吸附后两种吸附位的s、p轨道均向低能级方向移动,位于Fermi能级之下,说明两种轨道均得电子.d轨道发生离域化,说明Pt原子的d轨道与底物存在较强的相互作用.与前面的分析相吻合,综合说明bri2位吸附更稳定.同时吸附能352.7 kJ·mol-1与Eichler57的计算值(363.8 kJ·mol-1)比较接近.
3.1.2 不同覆盖度下CO分子的吸附活性比较
上述分析知道,CO分子以C-end在Osub2位吸附时最稳定,因此以下仅讨论C-end在Osub2位上的吸附.不同覆盖下吸附活性不同,Yang等49在c-ZrO2(110)表面吸附CO分子时考虑了不同的覆盖度的影响,计算结果表明,并不是覆盖度越大吸附活性越大,而是在覆盖度为0.25 ML时更稳定.因此本文也采用同样方法讨论覆盖度的影响.覆盖度通过计算吸附CO分子数与表面Zr原子数的比值得到,即定义0.25、0.5和1 ML分别指在ZrO2(101)-2×2超晶胞、1×2超晶胞和1×1超晶胞上分别吸附一个CO分子时的覆盖度.计算结果列于表2.需要指出的是,如图1俯视图中的Zra位有4个等价吸附位,Zra位和Zr1之间的原子距离为0.3633 nm,而Zra位和Zr2之间的原子距离为0.6402 nm.由于前者距离较小使得CO分子会与邻近单胞的CO发生相互作用,从而导致吸附能降低.50-53
从表5可以看到,随着覆盖度的增加,吸附能相差不大,并且是逐渐减小的,键长相差也不大,因此三种覆盖度下Pt原子在覆盖度为0.25 ML时吸附构型更稳定,也说明Pt趋向于分散而不是聚集.以下对于CO分子的吸附采用0.25 ML覆盖度来讨论.
3.2 Pt原子在ZrO2(101)表面的吸附
3.2.1 几何构型参数和布居分析
吸附能定义为吸附前后各物质总能量的变化,吸附能为正值表示较强的吸附作用.
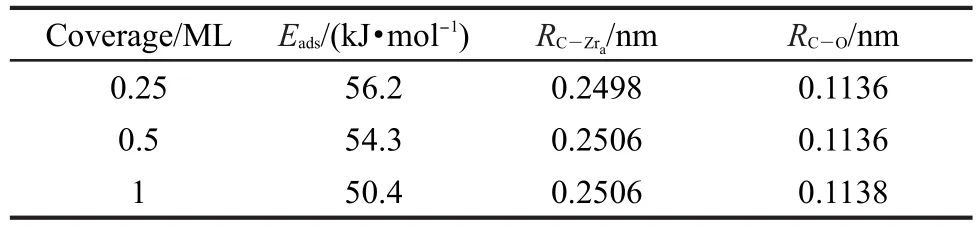
表2 CO分子在ZrO2(101)表面吸附的几何构型参数和吸附能Table 2 Geometrical parameters and adsorption energies for CO adsorbed on ZrO2(101)surface

表3 Pt及与Pt成键的Zr、O原子在ZrO2(101)表面的几何构型参数、吸附能和Mulliken电荷Table 3 Geometrical parameters,adsorption energies,and Mulliken population for Pt and Zr, O bonded with Pt on ZrO2(101)surface
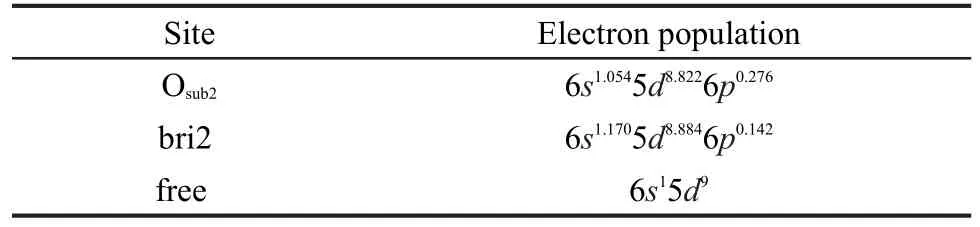
表4 Pt原子吸附前后的轨道电子布居Table 4 Orbital population for atoms of Pt before and after adsorption
3.2.2 态密度分析
由表1可知,O-end吸附均为物理吸附,CO分子C-end吸附在Osub2、Zra、Zrb、bri1和bri2位及para吸附在Zra、Zrb、bri1和bri2位为化学吸附.吸附能越大,说明吸附质与衬底Zr原子的吸附键越强.CO以C-end吸附在Osub2位最稳定,吸附能为56.2 kJ· mol-1.计算得到自由CO分子的键长为0.1141 nm,与实验值(0.1128 nm)47相接近,吸附后C―O键与自由的CO分子相比,均有不同程度的缩短.吸附后C―O键的伸缩振动频率为2172.8 cm-1,与文献48中利用红外光谱得到的CO分子吸附在四方ZrO2晶体上的振动频率(2183 cm-1)很接近.
3.2.3 不同覆盖度下Pt原子吸附活性的比较
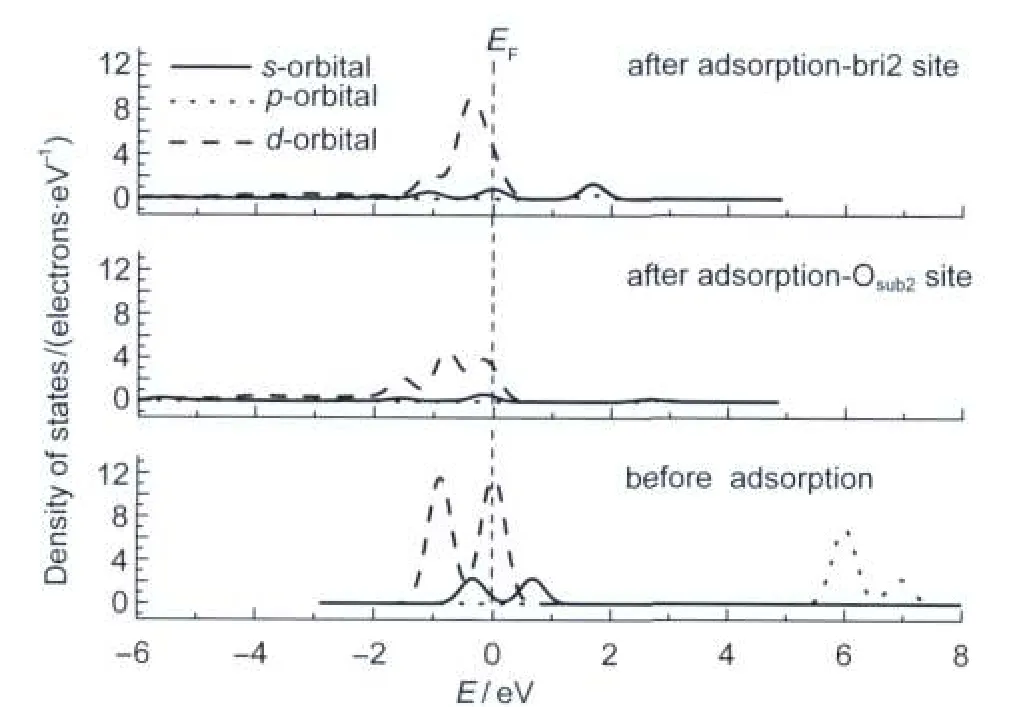
图2 Pt原子吸附前及吸附后在Osub2和bri2位的分态密度图Fig.2 Partial density of states of Pt atom before and after adsorption on Osub2and bri2 sites
(5)白垩系。测区白垩系零星分布于西南部的柳州市大、小鹅山、凉水铁路桥下、进德、鲁比、咸甫、良泗、柳城凤山地区以及洛埠附近等地,面积约10.96 km2。根据孢粉组合、岩石组合特征和与邻区相对比,划分下统和上统。测区内出露不连续,保存不完整,与下伏地层呈角度不整合接触。下统称永福(K1Y)群,上统称西垌(K2x)组。
由表2可以看到,随着覆盖度的增加吸附能逐渐减小,54-56C―Zr和C―O键伸长.三种覆盖度中覆盖度为0.25 ML时CO分子的吸附构型为稳定构型,这与我们选择ZrO2(101)-2×2超晶胞是一致的.
3.3 CO分子在Pt/ZrO2(101)表面的吸附
其中Eadsorbate和Esubstrate分别表示吸附前吸附质和底物的能量,Eadsorptionsystem表示吸附后体系的总能量.
以上计算已经得到Pt原子在t-ZrO2(101)-2×2表面的最有利吸附位为bri2位,因此我们选取此表面研究CO分子的吸附.吸附分别考虑C端、O端单齿配位和CO分子双齿配位吸附共3种情况.构型优化后,C端和双齿配位吸附构型转化为同一种构型. C-end和O-end两种吸附构型的吸附能分别为323.8和77.9 kJ·mol-1.Anez等34用Gaussian 03软件包ONIOM2方法35研究CO分子在四方ZrO2(101)表面的吸附,得到CO分子在连接Zr与O的桥位上的吸附能为97.9 kJ·mol-1,与我们的计算值(323.8 kJ· mol-1)相比较,说明Pt的负载更有利于C-end的吸附;Dulaurent等58利用红外光谱研究了CO分子在Pt/ZrO2面的Pt位上的吸附,结果表明,当覆盖度θ=0时的吸附能E0=195 kJ·mol-1和θ=1时的吸附能E1= 96 kJ·mol-1相比差别较大,这主要是由于文献中Pt的分散度较低(5%)造成的.一般而言,CO分子都是采用C原子与金属相连方式,O-end吸附模式不稳定,因此本文只对C-end吸附进行研究.为清晰起见,构型图仅选取表面三层.图3为最稳定吸附构型的侧视图.从图3可以看出,构型优化后CO分子发生倾斜,但CO分子与Pt原子之间的键角仍为180°.

表5 Pt原子在ZrO2(101)表面吸附的几何构型参数和吸附能Table 5 Geometrical parameters and adsorption energies for Pt adsorbed on ZrO2(101)surface
由图3可知,吸附后CO分子的键长为0.1161 nm,与自由CO分子相比键伸长,C―Pt键长为0.1838 nm,与文献59报道的CO在Pt(111)面的吸附中,C―O键长为0.1140 nm,C―Pt键长为0.1850 nm相吻合.C端吸附时C―O键的振动频率为2018 cm-1,Dulaurent等58利用红外光谱研究CO吸附在Pt/ZrO2面Pt位上的频率为2068 cm-1,我们的计算结果与其接近.吸附后C―O键的伸缩振动频率与自由分子的伸缩振动频率(2112 cm-1)相比发生红移,与自由分子的实验值(2138 cm-1)47相差不大.
3.3.2 Mulliken电荷布居和轨道布居分析
算法综合比较了NLMS和FDNLMS算法的性能,比较指标包括处理时间以及自适应滤波器失调系数和回声返回损耗增益值:
CO分子的电子组态为[(1σ)2(2σ)2(3σ)2(4σ)2(1π)4(5σ)2(2π)0].60表6列出了Pt原子吸附前后CO分子、Pt原子及与Pt、C成键的Zr、O(为了与CO分子中的O原子相区别,以Oʹ表示)原子的Mulliken电荷布居.可见,与自由状态下相比,吸附后CO分子均失去电子,Pt原子得到电子,底物O原子和Zr原子均得电子.这也可以由表7的C、O、Pt及与Pt成键的Zr、O原子吸附前后的轨道电子布居来解释:负载Pt后,C原子的s轨道失去0.614e,p轨道得到0.198e;O原子的s、p轨道分别得到0.008e和0.052e;Pt原子的s、p轨道分别得到0.172e和0.198e,d轨道失去0.174e.底物Zr原子的s、p轨道分别失去0.002e和0.030e,d轨道得到0.110e;O原子s轨道失去0.004e, p轨道得到0.108e.吸附后CO分子带部分正电荷,与表6结果相吻合.计算结果表明Pt原子负载后更有利于CO分子在ZrO2表面的吸附.

图3 最稳定吸附构型的侧视图Fig.3 Side view of the most stable adsorbed structuresGray balls represent C atoms.bond length in nm

图4 吸附前后CO分子,表面Pt、Zr、O原子的态密度图Fig.4 Density of states for CO,Pt,Zr,O atoms before and after CO adsorption
3.3.3 态密度分析
依照填埋场的服务范围,对2017年及以后理论垃圾填埋量进行预测。随着城市人口的稳定和收运点数量的稳定,城乡环卫一体化建设的基本实现,依据经验,生活垃圾产生量增长率按1%计。依据填埋场的运行预估,预测结果见表2。
对于自由CO分子,它的前线轨道成分主要来自于C原子的2s和2p、O原子的2s和2p轨道的贡献,CO的5σ轨道成分来自于C原子的2s和2p的贡献,而2π轨道成分则来自于C原子的2p和O原子的2p的贡献.61由图4可见,自由CO分子的最高占据轨道(HOMO)是位于Fermi能级处的5σ轨道,最低空轨道(LUMO)是2π轨道,且5σ和1π轨道之间存在一定的能级差,而一般认为1π轨道是定域化的,不参与成键.吸附后CO分子的4σ、5σ和2π轨道均向低能级方向移动,5σ轨道远离Fermi能级,而且可以清楚看到,C-end吸附时,CO的5σ轨道与1π轨道很接近,CO的5σ轨道与Pt的6s轨道发生重叠,2π轨道与Pt的5d轨道发生重叠.这说明,C-end吸附时同时存在两种转移机理,即CO 5σ➝Pt 6s的σ成键机理和Pt 5d➝CO 2π的π反馈机理.从以上讨论可以看出,吸附的CO分子带部分正电荷,也说明CO 5σ➝Pt 6s的σ成键机理占主要地位,但是CO的5σ轨道为非键轨道,对于键长和频率的影响不大.因此Pt 5d➝CO 2π的π反馈机理就占主导地位,导致C―O键伸长,相应的频率发生红移.与Pt原子成键的Zr、O原子吸附后轨道稍微向低能级发生偏移,这些结果也与表6的电荷布居分析结果相符.
三是要保证公正性。名师评选必须在推荐、审核、评审和审批四个环节严格把关,杜绝暗箱操作和名师“不名”的情况发生,确保评选结果的公正性、权威性和示范性,确保评选出的教学名师质量。
一定时期内传统产业对一国经济发展起着支撑作用,发达国家也不例外.下面以日本、瑞典为例分析传统产业发展的国际经验.

表6 CO分子及各原子和Pt以及与Pt成键的Zr、O(Oʹ)原子的平均Mulliken电荷布居Table 6 Mulliken population for CO,atoms of CO,Pt and Zr,O bonded with Pt

表7 C、O、Pt及与Pt成键的Zr、O原子吸附前后的轨道电子布居Table 7 Orbital population for atoms of C,O,Pt and Zr, O bonded with Pt atom before and after adsorption
4 结论
采用密度泛函理论GGA-PW91方法模拟了CO分子在Pt/四方ZrO2(101)面最稳定位的吸附行为.对CO分子和Pt原子在完整ZrO2(101)及CO分子在负载表面的吸附分别进行了构型优化,并分析了它们的电子结构性质.研究表明:CO分子和Pt原子的稳定吸附位分别为Osub2和bri2位,吸附能分别为56.2和352.7 kJ·mol-1.而CO分子在负载表面吸附时,C端吸附最稳定,吸附能为323.8 kJ·mol-1,且伸缩振动频率分析结果表明,C端吸附的频率发生红移,键伸长;态密度和布居电荷分析结果表明:CO吸附过程中带部分正电荷,电子转移以Pt 5d➝CO 2π的π反馈机理占主导地位.通过对CO分子在负载型稳定ZrO2面上的吸附研究为实验中消除CO或将其转化为无害物质提供理论依据.
(1) Zou,H.B.;Chen,S.Z.;Liu,Z.L.;Lin,W.M.Int.J.Hydrog. Energy 2009,34,9324.
(2) Gong,X.Q.;Liu,Z.P.;Raval,R.;Hu,P.J.Am.Chem.Soc. 2004,126,8.
(3) Igarashi,H.;Fujino,T.;Watanabe,M.J.Electroanal.Chem. 1995,391,119.
(4) Dekkers,M.A.P.;Lippits,M.J.;Nieuwenhuys,B.E.Catal. Lett.1998,56(4),195.
(5) Rupprechter,G.;Dellwig,T.;Unterhalt,H.J.Phys.Chem.B 2001,105(18),3797.
(6)Hadjiivanov,K.;Knözinger,H.;Mihaylov,M.J.Phys.Chem.B 2002,106(10),2618.
(7) Shaikhutdinov,S.K.;Meyer,R.;Naschitzki,M.Catal.Lett. 2003,86(4),211.
(8)Chen,J.G.;Xiang,H.W.;Dong,Q.N.;Wang,X.Z.;Sun,Y.H. Acta Phys.-Chim.Sin.2001,17(2),161. [陈建刚,相宏伟,董庆年,王秀芝,孙予罕.物理化学学报,2001,17(2),161.]
(9)Chen,Y.Q.;Gong,M.C.;Zhu,X.H.;Ming,H.;Tang,S.H. Chem.J.Chin.Univ.2002,23(4),715.[陈耀强,龚茂初,祝小红,明 虹,唐水花.高等学校化学学报,2002,23(4),715.]
(10) Jia,Y.X.;Guo,X.Y.Acta Phys.-Chim.Sin.2005,21(3),306. [贾玉香,郭向云.物理化学学报,2005,21(3),306.]
(11) Li,P.Chem.Res.Appl.2005,17(6),741.[李 平.化学研究与应用,2005,17(6),741.]
(12)Nygren,M.A.;Pettersson,L.G.M.J.Chem.Phys.1996,105 (20),9339.
(13) Koper,M.T.;Shubina,T.E.;Van Santen,R.A.J.Phys.Chem. B 2002,106(3),686.
(14) Bredow,T.J.Phys.Chem.B 2002,106(28),7053.
(15) Orita,H.;Inada,Y.J.Phys.Chem.B 2005,109(47),22469.
(16)Zhou,J.;Li,Z.H.;Wang,W.N.;Fan,K.N.J.Phys.Chem.A 2006,110(22),7167.
(17) Dholabhai,P.P.;Ray,A.K.Phys.Scr.2007,75,506.
(18) Seebauer,E.G.;Kong,A.C.F.;Schmidt,L.D.J.Vac.Sci. Technol.A 1987,5(4-1),464.
(19)Wang,Y.Z.;Wu,R.F.;Zhao.Y.X.Catal.Today 2010,158 (3-4),470.
(20)Wasileski,S.A.;Koper,M.T.M.;Weaver,M.J.J.Phys.Chem. B 2001,105(17),3518.
(21) Doll,K.Surf.Sci.2004,573(3),464.
(22) Olsen,R.A.;Philipsen,P.H.T.;Baerends,E.J.J.Chem.Phys. 2003,119(8),4522.
(23) Panagiotopoulou,P.;Christodoulakis,A.;Kondarides,D.I.; Boghosian,S.J.Catal.2006,240(2),114.
(24) Srinivasan,R.;Davis,B.H.Catal.Lett.1992,14(2),165.
(25)Dang,Z.;Anderson,B.G.;Amenomiya,Y.;Morrow,B.A. J.Phys.Chem.1995,99(39),14437.
(26)Tanabe,K.Mater.Chem.Phys.1985,13(3-4),347.
(27)Tanabe,K.;Misono,M.;Ono,Y.;Hattori,H.Stud.Surf.Sci. Catal.1989,51,1.
(28) Jiang,L.;Wang,G.C.;Guan,N.J.;Wu,Y.;Cai,Z.S.;Pan,Y. M.;Zhao,X.Z.;Huang,W.;Li,Y.W.;Sun,Y.H.;Zhong,B. Acta Phys.-Chim.Sin.2003,19(5),393.[江 凌,王贵昌,关乃佳,吴 杨,蔡遵生,潘荫明,赵学庄,黄 伟,李永旺,孙予罕,钟 炳.物理化学学报,2003,19(5),393.]
(29) Ren,Y.P.;Lu,Y.X.;Lou,Q.Acta Phys.-Chim.Sin.2007,23 (11),1728.[任云鹏,鲁玉祥,娄 琦.物理化学学报,2007, 23(11),1728.]
(30) Lyncha,M.;Hu,P.Surf.Sci.2000,458(1-3),1.
(31) Yamagishi,S.;Fujimoto,T.;Inada,Y.;Orita,H.J.Phys.Chem. B 2005,109,8899.
(32) Martin,R.;Gardner,P.;Bradshaw,A.M.Surf.Sci.1995,342, 69.
(33) Banholzer,W.F.;Parise,R.E.;Masel,R.I.Surf.Sci.1985,155 (2-3),653.
(34) Anez,R.;Sierraalta,A.;Martorell,G.J.Mol.Struct.2009,900, 59.
(35)Maseras,F.;Morokuma,K.J.Comp.Chem.1995,16(9),1170.
(36) Dilara,P.A.;Vohs,J.M.J.Phys.Chem.1995,99(47),17259.
(37) Zhu,X.;Xie,Y.;Liu,C.J.;Zhang,Y.P.J.Mol.Catal.A 2008, 282(1-2),67.
(38) Graf,P.O.;de Vlieger,D.J.M.;Mojet,B.L.;Lefferts,L. J.Catal.2009,262(2),181.
(39) Mitterdorfer,A.;Gauckler,L.J.Solid State Ionics 1999,117 (3-4),187.
(40) Bitter,J.H.;Seshan,K.;Lercher,J.A.J.Catal.1997,171(1), 279.
(41) Bitter,J.H.;Seshan,K.;Lercher,J.A.Top.Catal.2000,10 (3-4),295.
(42) Hofmann,A.;Clark,S.J.;Oppel,M.;Hahndorfk,I.Phys. Chem.Chem.Phys.2002,4,3500.
(43) Delly,B.J.Chem.Phys.1990,92(1),508.
(44) Delly,B.J.Chem.Phys.2000,113(18),7756.
(45) Delly,B.J.Phys.Chem.1996,100,6107.
(46) Perdew,J.P.;Chevary,J.A.;Vosko,S.H.;Jackson,K.A.; Pederson,M.R.;Singh,D.J.;Fiolhais,C.Phys.Rev.B 1992, 46(11),6671.
(47)Lide,D.R.CRC Handbook of Chemistry and Physics;CRC Press:Boca Raton,2003;pp 9-20.
(48)Ma,Z.Y.;Yang,C.;Wei,W.;Li,W.H.;Sun,Y.H.J.Mol. Catal.A:Chem.2005,227,119.
(49)Yang,Y.L.;Chen,W.K.;Guo,X.;Li,Y.;Zhang,Y.F.Chin.J. Struct.Chem.2010,29(7),1021.
(50)Nibbelke,R.H.;Campman,M.A.J.;Hoebink,J.H.B.J.; Marin,G.B.J.Catal.1997,171(2),358.
(51) Herz,R.K.;Marin,S.P.J.Catal.1980,65,281.
(52) Oh,H.;Fisher,G.B.;Carpenter,J.E.;Goodman,D.W. J.Catal.1986,100,360.
(53)Yeo,Y.Y.;Vattuone,L.;King,D.A.J.Chem.Phys.1997,106, 392.
(54) Chafk,T.;Dulaurent,O.;Gass,J.L.;Bianchi,D.J.Catal.1998, 179,503.
(55) Dulaurent,O.;Chandes,K.;Bouly,C.;Bianchi,D.J.Catal. 1999,188,237.
(56) Dulaurent,O.;Bianchi,D.Appl.Catal.A 2000,196,271.
(57) Eichler,A.Phys.Rev.B 2003,68,205408.
(58) Dulaurent,O.;Bianchi,D.Appl.Catal.A 2001,207(1-2),211.
(59) Bleakley,K.;Hu,P.J.Am.Chem.Soc.1999,121,7644.
(60) Pan,D.A.;Zhao,C.D.;Zheng,Z.X.Structures of Matters,2nd ed.;Higher Education Press:Beijing,1989;p 200 [潘道皑,赵成大,郑载兴.物质结构.第2版.北京:高等教育出版社, 1989:200]
(61) Sun,B.Z.;Chen,W.K.;Zheng,J.D.;Lu,C.H.Appl.Surf.Sci. 2008,255(5),3141.
August 25,2011;Revised:September 16,2011;Published on Web:September 30,2011.
Adsorption Properties of CO Molecules on Pt/t-ZrO2(101)Surfaces
MAN Mei-Ling1LU Chun-Hai2CHEN Wen-Kai1,*LI Yi1ZHANG Yong-Fan1
(1State Key Laboratory Breeding Base of Photocatalysis,Department of Chemistry,Fuzhou University,Fuzhou 350002,P.R.China;2College of Nuclear Technology and Automation Engineering,Chengdu University of Technology,Chengdu 610059,P.R.China)
We studied the adsorption of CO molecules on perfect and Pt-adsorbed t-ZrO2(101)surfaces using a periodic slab model by PW91 of generalized gradient approximation(GGA)within the framework of density functional theory.The results indicated that the second sub-surface oxygen and the second bridge sites are the most stable adsorbed sites for CO and Pt on the ZrO2(101)surface,respectively.When the coverage is 0.25 ML(monolayer)the most stable models were obtained with adsorption energies of 56.2 and 352.7 kJ·mol-1.The most stable model of CO adsorbed on the Pt/t-ZrO2(101)surface was obtained by C-end adsorption with an adsorption energy of 323.8 kJ·mol-1.We considered vibrational frequency calculations,density of states and the Mulliken population of the adsorption systems before and after adsorption and the
