新型U型双四硫富瓦烯衍生物的合成及其光诱导电子转移反应
2012-12-03严云才迟兴宝
严云才,迟兴宝
(1.淮北师范大学 化学系,安徽 淮北235000;2.桐城第五中学,安徽 桐城231400)
1 引言
30多年来,四硫富瓦烯(TTF)及其衍生物已被成功地应用于制备有机导体和超导体材料[1]。而近年来开始关注将TTF单元嵌入到多种分子体系中,构建不同电子给体-受体(D-A)的分子器件,如分子传感器、分子开关等[2]。本文利用具有强荧光的9,10-二(氯甲基)蒽将两个TTF单元连接在一起形成由电子给体-电子受体-电子给体(D-A-D)3组分的双TTF衍生物荧光传感器(图1),从而创建了新的U型双TTF体系(图2)。从TTF单元和C60反应来研究其光诱导电子转移反应(PET)。

图1 化合物2的合成
2 实验部分
2.1 仪器与试剂
图2 化合物2的最低能量构象
Avance 300核磁共振仪(CDCl3,内标TMS);数字熔点仪(上海精密科学仪器有限公司),Zeta Siz-er Nano-zs90(英国Malvem公司),TU-1901型双光束紫外可见光谱仪(北京普析通用仪器有限责任公司),BAS100B/W 电化学分析系统(美国BAS公司),Agilent 6890/Micromass GCT-MS,FP-6500 spectrofluorometer(测定参数:λex=376nm,缝宽:2nm,灵敏度:low)。2,3-二(2′-氰乙基硫基)-6,7-二丁硫基四硫富瓦烯(1)[3]。
2.2 新型双TTF衍生物2的合成
将0.500g (0.91mmol)化合物1溶于50mL干燥的THF中,在20min内加入溶有0.021g Na(0.91mmol)的甲醇溶液10mL,室温搅拌0.5h,形成暗红色溶液,加入溶有0.125g(0.45mmol)9,10-二(氯甲基)蒽的DMF溶液10mL,搅拌过夜,有橙红色沉淀生成,过滤,用甲醇洗涤,干燥后用四氢呋喃-甲醇溶液重结晶,得化合物2为橙红色粉状固体0.490g,产 率 90.0%,m.p.135.0~136.0℃,1H NMR(CDCl3,300MHz)δ:8.37(t,J=7.2Hz,4H),7.58(d,J=7.2Hz,4H),5.00(s,4H),2.85(t,J=6.3 Hz,8H),2.63(t,J=7.2Hz,4H),2.15(t,J=7.2Hz,4H),1.64~1.50(m,8H),1.42~1.40(m,8H),0.93(t,J=7.2Hz,12H);13CNMR(CDCl3,75MHz)(:130.0,129.1,126.5,124.8,117.5,36.2,32.3,31.9,21.5,18.4,13.7;MS(TOF-MS-EI+)m/z:556.0552(C26H21S7+),468.0225(C22H12S6+),204.0944(C16H12+),57.0708(C4H9+),54.0348(C3H4N+)。
3 结果与讨论
3.1 关于化合物2的氧化研究
TTF及其衍生物是良好的电子给体,利用此独特的性质可以构建多种D-A型的荧光分子传感器,其工作原理:(1)由于光诱导电子(PET)从TTF单元转移到激发态的A单元,使A单元荧光猝灭,导致D-A型分子显弱荧光;(2)氧化后,TTF单元给电子能力变弱,PET反应受阻,荧光变强;(3)还原后,DA型分子又显弱荧光。实验测定了化合物1的紫外吸收光谱和9,10-二(氯甲基)蒽的荧光光谱,发现这两个光谱有重叠部分见图3,这样化合物2中TTF单元的光电子就能够转移到蒽单元上,使化合物2显弱荧光,实验证实了这一点(图4),化合物2是弱荧光的,其荧光的量子产率只有0.026[4]。从热力学角度也可以得到解释,根据 Rehm-Weller公式[5]:ΔEPET=-E(ex)-E(red)+E(ox)-e2/εr(注:E(ox)=0.67 eV,E(red)=-1.078eV,λ(ex)=370nm,and e2/ε=-0.1eV),化合物2ΔEPET=-0.70eV,这就表明在化合物2中光诱导电子从TTF单元到蒽单元在热力学上是允许的,由此产生的光诱导电子导致蒽单元的荧光猝灭,使化合物2显示弱荧光。
2.2 U型双-TTF衍生物与C60的PET反应行为
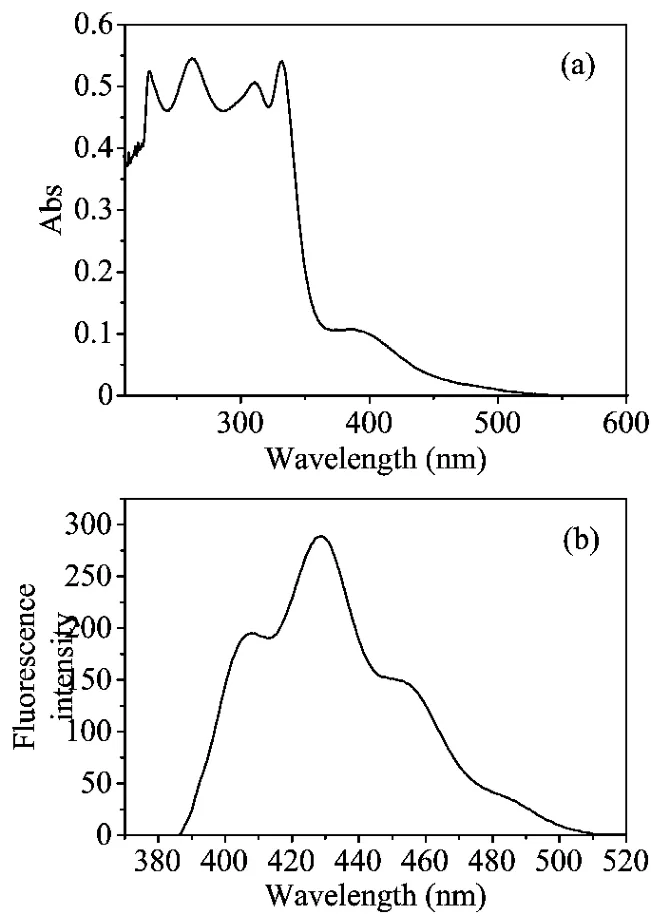
图3 (a)化合物1(1.0×10-5 mol·L-1)在THF中的吸收光谱;(b)9,10-二(氯甲基)蒽(1.0×10-5 mol·L-1)在THF中的荧光光谱
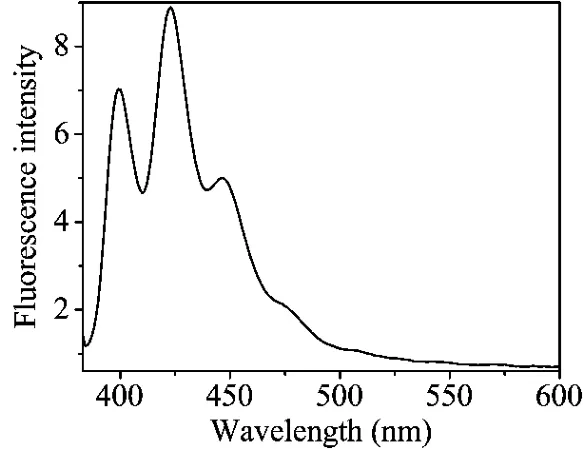
图4 化合物2(1.0×10-5 mol·L-1)在THF中的荧光光谱
C60是一个很好的电子受体,可以与TTF衍生物发生分子内或分子间的光诱导电子转移反应(PET)[7]。根据Chemdraw计算可知化合物2为U型分子,分子体积为1 035Å3,C60为421Å3。所以,化合物2可作为分子主体,C60作为分子客体进入化合物2分子中。在化合物2的二氯甲烷溶液中加入不同量的C60,通过体系的荧光强度的变化来观察其分子间PET反应行为。随着C60的量的增加,体系的荧光强度逐渐增大,当C60的为1.0eq时其荧光强度最大(图5a),C60的量继续增大其荧光变弱(图5b)。这是由于在化合物2中加入C60,C60与化合物2发生分子间的PET反应(图6),使原来的TTF单元到蒽单元分子内的PET反应受到抑制,体系的荧光变强。但过量的C60却导致体系的荧光变弱。是什么原因产生如此现象?在测定化合物2的过程中,化合物2的荧光光谱与C60的紫外吸收光谱也存在重叠的部分(图7),导致化合物2在激发过程中能量上与C60有竞争,随着C60量的增加这种竞争越来越强,化合物2在激发过程中获得的能量越来越少,从而也使体系荧光逐渐变弱。

图5 化合物2(1.0×10-5 mol·L-1)的CH2Cl2溶液中加入不同量C60的荧光图
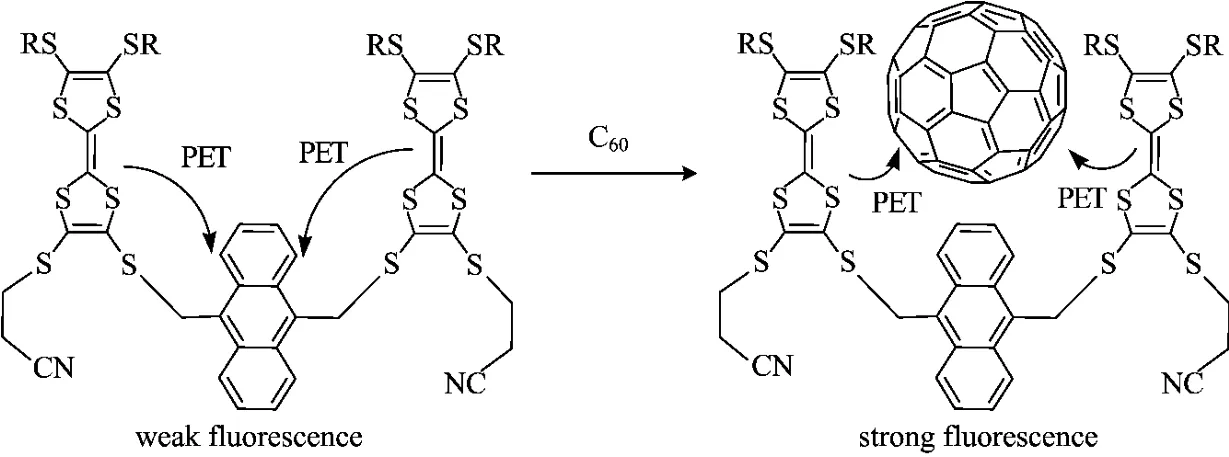
图6 C60与化合物2发生分子间的PET反应
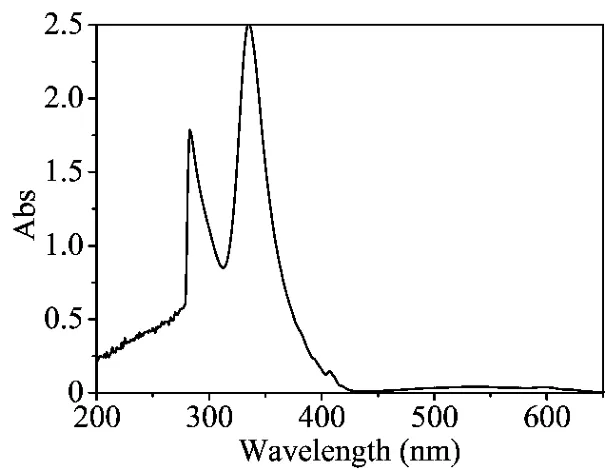
图7 C60的甲苯溶液(5.0×10-6 mol·L-1)的紫外吸收光谱
3 结论
本文成功地合成了新型U型双四硫富瓦烯衍生物,并对其结构进行了表征;研究结果表明新型U型双四硫富瓦烯衍生物能够与C60之间产生光诱导电子转移反应,使体系的荧光明显增强。
[1]J M Williams,J R Ferraro,R J Thorn,et al.Organic Superconductors(Including Fullerenes)[M].Prentice Hall,Englewood Cliffs,NJ,1992.
[2]M R Bryce.Tetrathiafulvalenes asπ-electron donors for intramolecular charge-transfermaterials[J].Adv.Mater.1999,(11):11-23.
[3]K B Simonsen,N Svenstrup,J Lau,et al.Sequential functionalization of bis-protected tetrathiafulvalene-dithiolates[J].Synthesis,1996,(3):407-418.
[4]Fluorescence quantum efficiencies were determined by comparing the integrated fluorescence spectra of the sample with that of a standard (9,10-diphenylanthracene in THF,φf=1.00).
[5]Z R Grabowski,J Dobkowski.Twisted intramolecular charge transfer(TICT)excited states:energy and molecular structure[J].Pure Appl.Chem.1983,(55):245-250.
[6]G X Zhang,D Q Zhang,X F Guo,et al.New redoxfluorescence switch based on a triad with tetrathiafulvalene and anthracene units[J].Org.lett.2004,6(8):1209-1213.
[7]M M Alam,A Watanabe and O Ito.Efficient Photoinduced Electron Transfer between C60and Tetrathiafulvalenes Studied by Nanosecond Laser Photolysis[J].J.Photochem.Photobiol.A,1997,104:59-64.
