罗汉果甜苷干预棕榈酸致胰岛B细胞氧化应激相关损伤的机制研究Δ
2012-12-03陈善源邓立东冯乐平黄岚珍于冉冉桂林医学院广西桂林541004
陈善源,邓立东,徐 勤,冯乐平,黄岚珍,于冉冉(桂林医学院,广西桂林 541004)
罗汉果甜苷(Mogrosides)是一组含三萜苷元(罗汉果醇,Mogrol)和不同数目葡萄糖残基的糖苷,为葫芦科植物罗汉果(Siraitia grosvenorii)提取物的主要甜味成分[1]。罗汉果甜苷对四氧嘧啶复制的糖尿病模型动物有抗氧化和控制血糖水平的作用[2],而对正常动物的血糖无显著作用[3]。近年研究[4]提出胰岛素抵抗导致的血糖血脂水平调节紊乱可使胰岛B细胞处于持续的氧化应激状态,活化叉头框蛋白-1(FOXO1)等转录因子,抑制葡萄糖代谢和胰岛素合成,损害胰岛素分泌功能并导致凋亡。罗汉果甜苷可能通过抗氧化作用保护胰岛B细胞的胰岛素分泌功能并控制糖尿病动物模型的血糖水平,但具体作用机制的研究尚未见文献报道。本研究通过观察罗汉果甜苷干预棕榈酸导致的胰岛B细胞氧化应激损伤效应,初步探讨罗汉果甜苷通过抗氧化作用保护胰岛B细胞的机制,为今后进一步阐明罗汉果甜苷的降血糖机制奠定坚实的理论基础。
1 仪器与材料
1.1 仪器
SW-CJ-2F型超净工作台(苏州净化设备有限公司);Galaxy 170 S型CO2细胞培养箱(德国Eppendorf公司);FACSAriaⅢ流式细胞仪(美国BD公司);Tprofessional PCR仪(德国Biometra公司);DYY-6D型琼脂糖电泳仪(北京六一仪器厂);JS-780型凝胶成像仪(上海培清科技有限公司)。
1.2 试药
罗汉果甜苷(桂林莱茵生物科技股份有限公司,其中罗汉果甜苷含量为50%);棕榈酸(分析纯,国药集团化学试剂有限公司);低糖Dulbecco's改良Eagle's培养基(DMEM)培养液、高糖DMEM培养液、胎牛血清(美国Thermo Scientific公司);0.5%含乙二胺四乙酸(EDTA)、胰酶与D-Hank’s溶液(美国Invitrogen公司);二氯荧光素双酯(DCFH-DA)法活性氧检测试剂盒、异硫氰酸荧光素(FITC)标记Annexin V细胞凋亡检测试剂盒(上海碧云天生物技术研究所);超纯RNA提取试剂盒、HiFi-MMLV逆转录cDNA合成试剂盒与2x Es Taq Mastermix PCR试剂盒(北京康为世纪生物技术有限公司)。
1.3 细胞
小鼠胰岛B细胞系NIT-1细胞由桂林医学院冯乐平教授研究组惠赠。
2 方法
2.1 NIT-1细胞培养与传代
NIT-1细胞培养于含10%胎牛血清与抗生素(100 u·mL-1青霉素和100 μg·mL-1链霉素)的低糖DMEM培养液中,置37℃、5%CO2恒温培养箱内传代培养。细胞占据培养瓶瓶底面积80%左右时以胰酶消化并离心收集细胞,计数后按每孔30万细胞接种至六孔板,加培养液至每孔总液体量为2 mL。培养48 h,细胞占据50%~60%培养孔底面积后,按表1分组,为每组更换培养液,每组3个复孔,培养48 h后收集细胞进行试验。各处理组培养液组成见表1。
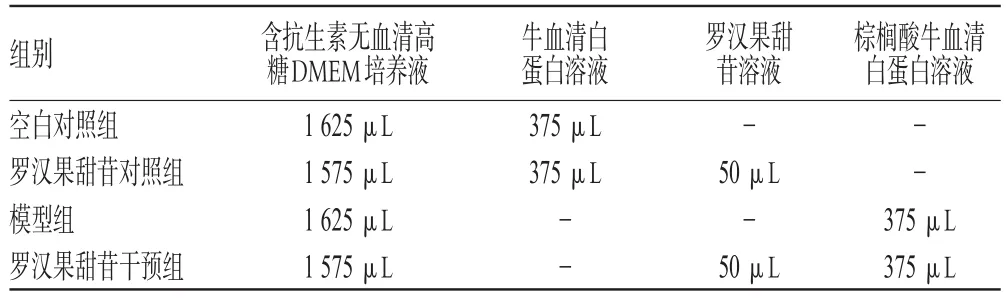
表1 各处理组培养液组成Tab 1 Content of cultivate medium for each group
牛血清白蛋白溶液中牛血清白蛋白浓度为50 g·L-1。罗汉果甜苷溶液浓度按罗汉果甜苷的含量计算为40 mmol·L-1。棕榈酸牛血清白蛋白溶液中棕榈酸浓度为4 mmol·L-1,牛血清白蛋白浓度为50 g·L-1,溶剂均为高糖DMEM培养液。
各组培养环境中均含有9.375 g·L-1牛血清白蛋白;罗汉果甜苷对照组和干预组均含有1 mmol·L-1罗汉果甜苷;模型组和罗汉果甜苷干预组中均含有0.75 mmol·L-1棕榈酸。
2.2 流式细胞术测定NIT-1细胞内活性氧自由基(ROS)含量与凋亡率
细胞加药处理完毕后,一部分加入适量无血清高糖DMEM培养液洗涤,每孔加入1 mL无血清高糖DMEM培养液与DCFH-DA工作液1 μL,混匀后置于培养箱内孵育30 min,孵育完毕后洗涤,胰酶消化后制成细胞悬液;一部分制成细胞悬液后按FITC-Annexin V凋亡检测试剂盒的操作说明对凋亡细胞进行标记。标本处理完毕后上流式细胞仪检测。DCF荧光强度值即可看作判断ROS含量高低的指标。
2.3 半定量逆转录PCR测量细胞葡萄糖转运受体(GLUT)-2与丙酮酸激酶编码基因相对表达水平
细胞加药处理完毕后,以D-Hank’s平衡盐液洗涤2次,按RNA抽提试剂盒说明操作,提取细胞中的总RNA。各样本总RNA经测量RNA浓度后,按照逆转录和PCR试剂盒说明操作,逆转录生成各样本的cDNA片段,再对cDNA片段进行半定量PCR。PCR产物以最大电压250 V、最大电流400 mA的参数在2%琼脂糖凝胶中进行电泳,在凝胶成像仪中拍摄电泳条带照片。PCR反应所使用的引物序列见表2。
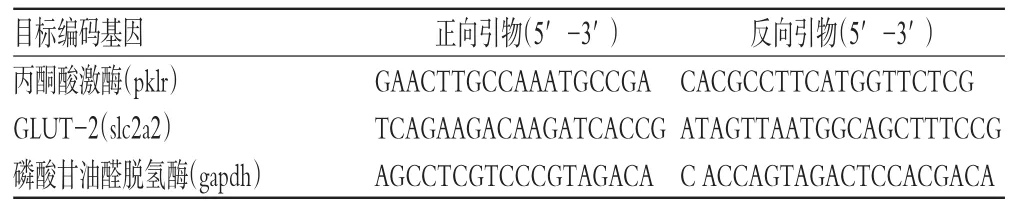
表2 PCR反应所使用的引物序列Tab 2 Primer sequence for PCR assay
2.4 数据处理
流式细胞仪数据以FlowJo 7.6流式细胞术数据分析软件进行分析处理;半定量逆转录PCR所得电泳灰度图片以Gel-Pro Analyzer 4分析并获取各条带的积分光密度值(IOD),使用IOD在Excel中求得各样本目的基因的相对表达强度(相对表达强度计算公式:相对表达强度=目的基因条带IOD/内参基因条带IOD)。上述数据汇入SPSS 11.0软件中,使用单因素方差分析进行比较。P<0.05为差异有统计学意义。
3 结果
3.1 罗汉果甜苷对高脂环境中B细胞内ROS含量的影响
与空白对照组比较,模型组NIT-1细胞内的ROS含量显著增加(P<0.05);罗汉果甜苷对照组细胞内的ROS含量显著减少(P<0.05)。与模型组比较,罗汉果甜苷干预组NIT-1细胞内的ROS含量显著减少,表明罗汉果甜苷可显著降低NIT-1细胞内ROS含量,对棕榈酸导致的NIT-1细胞内ROS增加的抑制作用更为显著。各组DCF荧光强度比较见表3。
表3 各组DCF荧光强度比较(±s,n=3)Tab 3 Comparison of DCF fluorenscence strength in each group(±s,n=3)
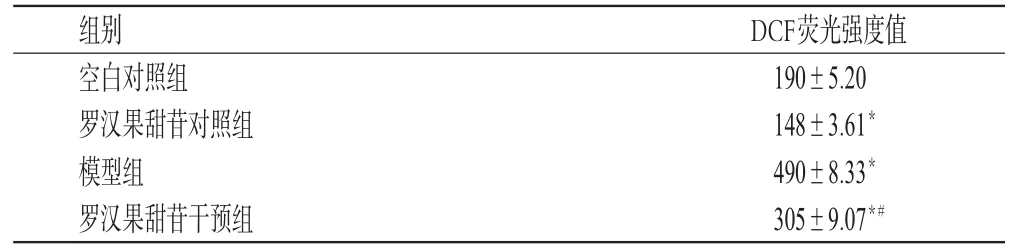
表3 各组DCF荧光强度比较(±s,n=3)Tab 3 Comparison of DCF fluorenscence strength in each group(±s,n=3)
与空白对照组比较:*P<0.05;与模型组比较:#P<0.05vs.blank control group:*P<0.05;vs.model group:#P<0.05
组别空白对照组罗汉果甜苷对照组模型组罗汉果甜苷干预组DCF荧光强度值190±5.20148±3.61*490±8.33*305±9.07*#
3.2 罗汉果甜苷对高脂环境中B细胞糖代谢关键基因表达水平的影响
对各样本总RNA的逆转录PCR均成功合成出PCR产物,分别为小鼠磷酸甘油醛脱氢酶编码基因gapdh的315 bp产物、小鼠GLUT-2编码基因slc2a2的174 bp产物和小鼠丙酮酸激酶编码基因pklr的205 bp产物。
与空白对照组比较,罗汉果甜苷对照组slc2a2基因相对表达水平显著降低(P<0.05);模型组slc2a2基因相对表达水平降低更显著(P<0.05),同时pklr基因相对表达水平也显著降低(P<0.05)。与模型组比较,罗汉果甜苷干预组上述指标均显著增强(P<0.05)。各组糖代谢关键基因表达水平的比较见表4;半定量逆转录PCR产物琼脂糖凝胶电泳图见图1。
表4 各组糖代谢关键基因表达水平的比较(±s,n=5)Tab 4 Comparison of relative gene expression level of glucose metabolism in each grou(p±s,n=5)

表4 各组糖代谢关键基因表达水平的比较(±s,n=5)Tab 4 Comparison of relative gene expression level of glucose metabolism in each grou(p±s,n=5)
与空白对照组比较:*P<0.05;与模型组比较:#P<0.05vs.blank control group:*P<0.05;vs.model group:#P<0.05
组别空白对照组罗汉果甜苷对照组模型组罗汉果甜苷干预组pklr基因相对表达水平10.87±0.160.18±0.06*0.71±0.21*#slc2a2基因相对表达水平10.67±0.23*0.34±0.14*0.87±0.15#
3.3 罗汉果甜苷对NIT-1细胞群落凋亡率的影响
流式细胞仪测定结果显示,空白对照组已有5%左右的细胞自发凋亡,培养环境中存在1 mmol·L-1浓度的罗汉果甜苷对NIT-1细胞群落凋亡率无显著影响(P>0.05)。加入0.75 mmol·L-1的棕榈酸后,细胞凋亡率显著上升(P<0.05),罗汉果甜苷对棕榈酸所造成的凋亡增加并无显著抑制作用(P>0.05)。各组凋亡率比较见表5。
表5 各组凋亡率比较(±s,n=3)Tab 5 Comparison of apoptosis percentage in each group(±s,n=3)

表5 各组凋亡率比较(±s,n=3)Tab 5 Comparison of apoptosis percentage in each group(±s,n=3)
与空白对照组比较:*P<0.05vs.blank control group:*P<0.05
组别空白对照组罗汉果甜苷对照组模型组罗汉果甜苷干预组5.79±1.445.44±0.2412.80±3.83*16.00±4.33*凋亡率/%

图1 半定量逆转录PCR产物琼脂糖凝胶电泳图Fig 1 Agarose gel electrophoresis of semi-quantitative RTPCR assay
4 讨论
本研究以高糖培养基和棕榈酸模拟机体胰岛素抵抗所导致的高血脂和血糖代谢障碍产生的内环境改变,结果显示罗汉果甜苷可显著降低在此环境中大幅上升的NIT-1细胞内ROS含量,与文献报道[5]相同。正常情况下细胞无法摄取完整的分子量达1287 Da的罗汉果甜苷分子,动物实验显示口服罗汉果甜苷后在血液中只能检测到罗汉果醇等水解产物[5]。未水解的罗汉果甜苷能在NIT-1细胞内产生抗氧化作用的机制可能是通过细胞表面存在的糖苷酶进行水解,小分子苷元进入细胞产生抗氧化作用。
1分子罗汉果甜苷完全水解后可产生5分子葡萄糖。相当于1 mmol·L-1罗汉果甜苷剂量的罗汉果甜苷混合物水解可生成远大于5 mmol·L-1的葡萄糖。NIT-1细胞在22.5 mmol·L-1葡萄糖的环境中培养48 h已有近5%的凋亡率,并随葡萄糖浓度同步上升[6]。本研究中,罗汉果甜苷对照组的培养环境葡萄糖浓度可能高达30 mmol·L-1,NIT-1细胞凋亡率与空白对照组无显著差异,显示罗汉果甜苷的抗氧化剂活性可保护NIT-1细胞免受高浓度葡萄糖导致的氧化应激损伤。
本研究中观察到罗汉果甜苷可以有效清除棕榈酸产生的ROS,但不能减少棕榈酸造成的凋亡,甚至呈现增加趋势,这可以用“糖脂毒性”(Glucolipotoxicity)理论[7]作出解释。高于生理水平的葡萄糖和脂类对胰岛B细胞有协同损伤作用,除了产能代谢带来的氧自由基损害外,还有蛋白糖基化和脂肪酸旁路代谢产物的毒害作用[8]参与。罗汉果甜苷的抗氧化作用只能减缓ROS产生的损伤作用,对其他损伤机制产生的凋亡效应在本研究中未见显著影响,水解产生的葡萄糖和棕榈酸产生协同毒害作用,使NIT-1细胞凋亡率呈上升趋势。
半定量逆转录PCR结果显示,罗汉果甜苷能促进GLUT-2与丙酮酸激酶编码基因的表达上升,对胰岛B细胞的胰岛素分泌功能起到了一定的保护作用。胰岛B细胞表面的GLUT-2数目不受胰岛素水平的影响,当血糖上升时,葡萄糖自由进入胰岛B细胞内,线粒体产生更多能量和ROS,促使含有胰岛素的分泌颗粒移动至胞膜并融合、释放胰岛素[9]。棕榈酸代谢产生的ROS可通过激活JNK信号转导通路,促使转录因子FOXO1向胞核内迁移和活化[10]。在胰岛B细胞中,FOXO1的活化可抑制磷酸果糖激酶、丙酮酸激酶和GLUT-2等多种产能代谢相关酶的基因表达[11],导致胰岛B细胞不能对血糖变化产生有效反应,进而影响胰岛素分泌功能,这可能是胰岛B细胞在高糖高脂环境下的自我保护机制。棕榈酸导致NIT-1细胞GLUT-2和丙酮酸激酶编码基因下调表达的效应被罗汉果甜苷逆转,表明罗汉果甜苷起到的抗氧化作用可降低NIT-1细胞氧化应激水平,可能逆转FOXO1的活化,有助于恢复胰岛B细胞的正常葡萄糖代谢能力和葡萄糖刺激后胰岛素分泌(GSIS)作用。
综上所述,罗汉果甜苷可显著减少NIT-1细胞内因棕榈酸代谢而上升的ROS含量,并提高被抑制的GLUT-2和丙酮酸激酶的基因表达水平。这些效应可能由于罗汉果甜苷清除细胞内ROS后使氧化应激激活的FOXO1失活所致,具体作用机制尚待进一步研究。
此外,胰岛B细胞氧化应激损伤理论中的一个重要观点是转录因子FOXO1活化和胰腺十二指肠同源性蛋白1(PDX1)失活,此论点已有试验证据佐证[12]。PDX1失活可导致胰岛素合成和胰岛细胞再生分化能力下降[13],罗汉果甜苷的抗氧化作用可能抑制FOXO1活化并使PDX1的活性恢复,保护胰岛B细胞的胰岛素合成功能和增生分化能力。罗汉果甜苷的三萜苷元结构上与甾体激素的相似性亦可能与药理作用相关。新近研究结果[14]证明此苷元有激活腺苷酸、活化蛋白激酶(AMPK)的作用,而腺苷酸活化蛋白激酶(AMPK)参与胰岛B细胞的胰岛素释放过程和脂代谢相关蛋白的表达和活性的调节[15]。这些作用与本研究所发现的效应之间有何相互作用均是深入研究罗汉果甜苷和其结构相似分子对胰岛B细胞保护作用机制的方向。
[1]齐一萍,唐明仪.罗汉果果实的化学成分与应用研究[J].福建医学杂志,2001,23(5):158.
[2]Qi XY,Chen WJ,Xie BJ,et al.Mogrosides extract from Siraitia grosvenorii scavenges free radicals in vitro and lowers oxidative stress,serum glucose,and lipid levels in alloxan-induced diabetic mice[J].Nutrition Research,2008,28(4):278.
[3]徐 庆,梁荣感,徐 立.罗汉果甜苷对正常人血糖含量与肝酶活性的影响[J].食品科学,2007,28(6):315.
[4]陈善源,徐 勤.2型糖尿病中胰岛β细胞氧化应激损伤机制与相关治疗药物的研究进展[J].中国药房,2011,22(37):3533.
[5]Murata Y,Ogawa T,Nakano Y,et al.Digestion and absorption of siraitia grosvenori triterpenoids in the rat[J].Biosci Biotech Bioch,2010,74(3):637.
[6]罗静思,夏 宁,梁瑜祯.不同浓度葡萄糖对小鼠胰岛β细胞株NIT-1增殖、分泌功能和凋亡的影响[J].山东医药,2010,50(43):28.
[7]Poitout V.Glucolipotoxicity of the pancreatic β-cell:Myth or reality[J].Biochem Soc T,2008,36(Pt5):901.
[8]Haber EP,Ximenes HMA,Carpinelli AR,et al.Pleiotropic effects of fatty acids on pancreatic bata-cells[J].J Cell Physiol,2002,194(1):1.
[9]Pi J,Bai Y,Collins S,et al.Reactive oxygen species as a signal in glucose-stimulated insulin secretion[J].Diabetes,2007,56(7):1783.
[10]Martinez SC,Tanabe K,Permutt MA,et al.Inhibition of FOXO1 protects pancreatic islet β-cells against fatty acid and endoplasmic reticulum stress-induced apoptosis[J].Diabetes,2008,57(4):846.
[11]Buteau J,Shlien A,Accili D,et al.Metabolic diapause in pancreatic β-cells expressing a gain-of-function mutant of the forkhead protein FOXO1[J].J Biol Chem,2007,282(1):287.
[12]Kawamori D,Kaneto H,Yamasaki Y,et al.The forkhead transcription factor FOXO1 bridges the JNK pathway and the transcription factor PDX-1 through its intracellular translocation[J].J Biol Chem,2006,281(2):1091.
[13]Ahlgren U,Jonsson J,Edlund H,et al.β-Cell-specific inactivation of the mouse Ipf1/Pdx1 gene results in loss of the β-cell phenotype and maturity onset diabetes[J].Gene Dev,1998,12(12):1763.
[14]Chen XB,Zhuang JJ,Hu LH,et al.Potential AMPK activators of cucurbitane triterpenoids from Siraitia grosvenorii swingle[J].Bioorgan Med Chem,2011,19(19):5776.
[15]Winder WW,Hardie DG.AMP-activated protein kinase,a metabolic master switch:possible roles in type 2 diabetes[J].AM J Physiol-Endoc M,1999,277(1):E1.
