麦西来甫-木卡姆练习对维吾尔族肥胖妇女脂肪细胞因子、胰岛素和免疫球蛋白含量的影响
2012-12-03王志锋
王志锋
Department of Physical Education,Kashi Teaching College,Kashi 844000,China.
新疆自古是多民族聚集的地区,现在居住的民族有47个,新疆少数民族传统体育是各族群众在生产、生活实践中创造的一种文化现象,它在一定的民族间和特定的区域内有着广泛的影响,同时,在少数民族群众健身活动中也起着重要的作用,是重要的非物质文化遗产。现在搜集、整理出的新疆少数民族传统体育项目共有278项[5],主要有竞赛类项目、表演类项目、民间传统类项目、民间游戏项目4大类[1]。新疆虽然有丰富的少数民族传统体育项目,但是目前对其开发和深入研究的程度还十分有限,较多的研究都集中在对新疆少数民族体育旅游项目的开发研究上[13,4],而从健身机制方面深入研究新疆少数民族传统体育项目的报道十分少见,这无疑不利于少数民族优秀传统体育项目的开发、推广与传承。
麦西来甫-木卡姆是极具新疆少数民族特色的传统体育项目,且在新疆少数民族中,尤其是在新疆维吾尔族中广为开展。2005年11月28日,联合国教科文组织宣布“中国新疆维吾尔木卡姆”为第三批“人类口头和非物质遗产代表作”,这为新疆麦西来甫-木卡姆在新世纪的发展与传承提供了极好的机会,同时,也充分证实了木卡姆在人类发展中的重要作用。麦西来甫-木卡姆反映了古代维吾尔人打猎生活的全部过程,主要包括“组织打猎”、“拨开红柳观察野兽”、“与野兽周旋”、“搏斗、追求”以及“胜利后的欢舞”5个部分。现代麦西来甫-木卡姆则演变成了以序唱、切克提曼、赛乃姆、赛乃克斯提、色里玛这5个部分为主要形式,同时,将表演和体育锻炼融为一体的传统文体项目,其中,序唱为自由散板,切克提曼为慢板3/4拍,赛乃姆为中板4/4拍,赛乃克斯提为小快板2/4拍,色里玛为快板2/4拍,与这些表现内容相对应的麦西来甫-木卡姆形成了滑冲及微颤的显著动律特征。目前,关于麦西来甫-木卡姆的研究主要集中在其文化层次上,本研究从运动生物学的角度进行研究,进而探讨它在大众健身方面的作用。
本研究以39名维吾尔族肥胖妇女为研究对象,分析24周规律性麦西来甫-木卡姆练习对其脂肪细胞因子(瘦素、脂联素)、血清胰岛素含量、血脂成份、体成份及其免疫机能的影响,深入探讨麦西来甫-木卡姆的健身机制,为其进一步的开发与推广提供实验依据。
1 研究对象与方法
1.1 研究对象与分组
受试者来自新疆喀什师范学院、喀什教育学院的维吾尔族肥胖女教工46名,对其进行临床医学检查,排除有家族性疾病史、糖尿病、心脑血管疾病及内分泌与代谢类疾病患者、继发性肥胖患者共计7名,最终筛选出肝脏、肾脏功能正常的单纯性肥胖患者39名作为研究对象,采用随机分组的方法,将实验对象分为麦西来甫-木卡姆练习组(EXE组,n=20)和对照组(CON组,n=19)。肥胖标准以2000年2月WHO对亚太地区肥胖的定义标准,即BMI=18~22.9为正常,BMI=23~24.9kg/m2为肥胖前期,BMI≥25kg/m2为肥胖。
所有受试者均被告知实验内容和注意事项,并签署知情同意书,确保实验前、后除麦西来甫-木卡姆练习外没有额外的体力活动。
1.2 练习时间及方式
实验起止日期为2011年5月1日-11月1日,实验组由专业教练带领,每周进行5次麦西来甫-木卡姆练习,每次80min,主要包括10min热身活动,60min麦西来甫-木卡姆练习和10min放松练习,练习强度根据木卡姆音乐节拍的快慢来调整,保证控制在个体60%~70%HRmax的强度范围内。对照组实验前后都保持正常的生活方式,不进行麦西来甫-木卡姆练习。

表1 本研究受试者基本情况一览表Table 1 List of Subjects Condition
1.3 样品制备
受试者在实验前一天和实验结束后一天进行血样采集,在样本采集的前后要求受试者禁止喝酒,空腹禁食12 h,于清晨7:00~8:00无菌条件下抽取肘静脉血5ml,其中2ml经肝素抗凝后立刻进行血脂检测,其余3ml经肝素抗凝后快速离心,取血清放入-80℃冰箱冰冻,以待实验后样品一起检测。
1.4 测试指标及方法
身体形态及体成份指标在喀什师范学院体育系生理实验室进行。采用国产电子体重计测体重(W),采用国家体育总局体育科学研究所研制的皮褶厚度计测体脂百分比(BF%),采用标准无弹性皮尺测腰、臀围度,以计算腰臀比(WHR)。
血脂成份、免疫球蛋白、胰岛素和脂肪细胞因子的测定在喀什第一人民医院进行。血清TG、TC、LDL-c、HDL-c采用酶法检测,仪器为日本东芝800TOSHIBA TBA-40FR全自动生化分析仪,血清瘦素、脂联素和胰岛素采用放射免疫法检测;血清免疫球蛋白(IgG、IgA、IgM)采用免疫透射比浊法检测,试剂盒均为南京建成生物有限公司产品。
2 数据处理
所有数据采用SPSS 13.0系统软件包进行单因素方差分析处理,P<0.05表示有显著性差异,P<0.01表示有极显著性差异。
3 研究结果
3.1 实验前、后受试者肥胖指标变化比较
表2显示,实验后练习组与对照组相比,体重和 WHR显著性降低(P<0.05),BMI和 BF%极显著降低(P<0.01)。结果提示,24周规律性的麦西来甫-木卡姆练习可以显著降低受试者体重、BF%、WHR和BMI。
3.2 实验前、后受试者血脂成份变化比较
表3显示,实验后练习组TC有降低趋势,但不具有显著性差异(P>0.05),TG显著性降低(P<0.05),LDL-c极显著性降低(P<0.01),而 HDL-c则显著性升高(P<0.05)。结果提示,24周规律性的麦西来甫-木卡姆练习有效的改善了肥胖患者的血脂成份,使TC、TG、LDL-c不同程度的降低,HDL-c含量升高,肥胖患者血脂异常状态得到改善,患动脉粥样硬化的风险性降低。

表2 本研究实验前、后练习组和对照组肥胖指标变化比较一览表Table 2 Comparison of Obesity Index of the Exercise Group and Control Group before and after Experiment
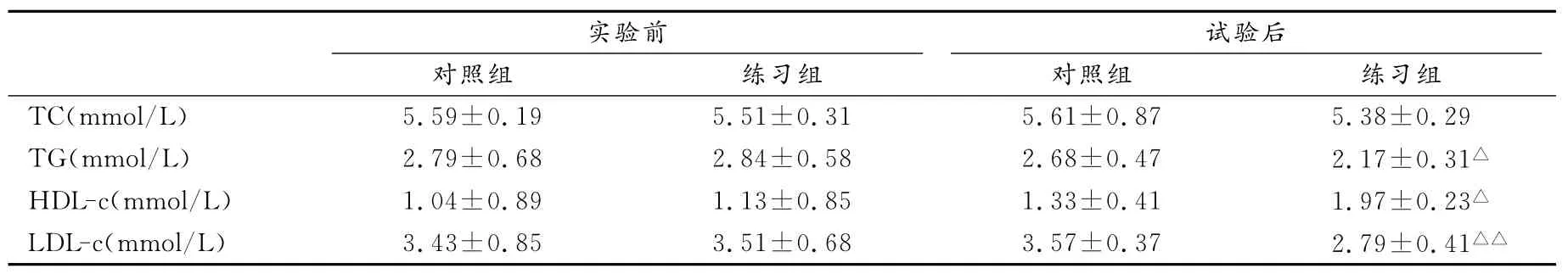
表3 本研究实验前、后练习组和对照组血脂成份变化比较一览表Table 3 Comparison of Blood Lipid Composition of the Exercise Group and Control Group before and after Experiment
3.3 实验前、后受试者脂肪细胞因子、胰岛素含量变化比较
表4显示,实验后练习组血清胰岛素、瘦素含量与对照组相比极显著降低(P<0.01),而脂联素含量则显著升高(P<0.05)。结果提示,24周规律性的麦西来甫-木卡姆练习有效的改善了肥胖患者的胰岛素抵抗状态以及脂肪细胞的分泌功能。
3.4 实验前、后受试者免疫球蛋白含量变化比较
从表5可见,实验后练习组与对照相比免疫球蛋白IgG含量极显著升高(P<0.01),IgA、IgM 显著升高(P<0.05)。结果提示,24周规律性的麦西来甫-木卡姆练习提高了受试者体液免疫能力,是体质改善的良好表现。

表4 本研究实验前、后练习组和对照组脂肪细胞因子、胰岛素变化比较一览表Table 4 Comparison of Adipocytokines and Insulin Content of the Exercise Group and Control Group before and after Experiment

表5 本研究实验前、后练习组和对照组免疫球蛋白含量变化比较一览表Table 5 Comparison of Immunoglobulin Content of the Exercise Group and Control Group before and after Experiment
4 分析与讨论
4.1 麦西来甫-木卡姆练习对受试者体态及血脂成份的影响
现代医学证实,肥胖与胰岛素抵抗、动脉粥样硬化、高血压、冠心病、糖尿病、自身免疫性疾病、代谢综合症、高脂血症、肿瘤等20多种疾病的发生密切相关,同时,也与死亡率存在较高的相关性[2]。可以认为,肥胖已经成为影响人类健康的世界性问题,减肥更是当今社会和科研工作者广泛关注的热点问题。在新疆的维吾尔族群众中,其饮食习惯具有高脂肪、高蛋白、低碳水化合物的特点,而高热量膳食不仅是导致个体肥胖症的重要因素,更是诱发2型糖尿病((Type 2Diabetes Mellitus,T2DM)患病的危险因素之一。临床资料表明,新疆维吾尔族较汉族及其他少数民族T2DM高发,是汉族人群的2倍[11],因此,积极探索行之有效的减肥、降体重的方法已经成为当前科研工作者亟待解决的问题。在众多的减肥方法中,运动减肥控制体重是一种有效且稳定的方法[7]。本研究结果显示,24周规律性的麦西来甫-木卡姆练习后,受试者体重和WHR显著性降低(P<0.05),BMI和BF%极显著降低(P<0.01),原因在于麦西来甫-木卡姆练习中身体的滑冲、颤动、下肢的跳动、上肢的摆动和腰腹部规律性的扭转动作较多,同时,练习强度根据木卡姆音乐节拍的快慢基本控制在个体60%~70%HRmax的范围内,这一强度范围内使受试者内源性脂蛋白脂肪酶活性增高,肌细胞和脂肪细胞中储存的甘油三酯加速水解成游离脂肪酸,进而被运送至运动器官作为主要能源物质积极参与供能,导致脂肪大量被消耗,最终使个体体重、BF%、WHR和BMI不同程度的降低,这一研究结果在前人的研究中也得到了证实[14,16]。另外,练习过程中富于动感的木卡姆音乐结合练习者肢体规律性的运动,还可能使受试者交感肾上腺系统活动增强,分解代谢加强,能量消耗和静息代谢率增加,这些都将促使机体能量收支负平衡的出现。
进一步证实,肥胖患者多伴有血脂异常,即血浆TC、TG、LDL-c升高,HDL-c降低。LDL-c对动脉壁内膜有侵蚀作用,而且,容易在动脉管壁内沉积形成脂斑,堵塞血管,所以,血脂异常是诱发动脉粥样硬化和冠心病的重要危险因素。长期有氧运动可促进血浆TG水解、增加血浆HDL含量,改善血脂异常[46]。本实验发现,24周麦西来甫-木卡姆练习使受试者TC有降低趋势(P>0.05),TG、LDL-c显著性和极显著性降低(P<0.05,P<0.01),HDL-c显著性升高(P<0.05),提示,麦西来甫-木卡姆练习有效的改善了肥胖患者的血脂成份,使肥胖患者血脂异常状态得到扭转,患心脑血管疾病的风险降低。
4.2 麦西来甫-木卡姆练习对受试者脂肪细胞因子和胰岛素含量的影响
脂肪细胞因子是近来被用以描述脂肪起源的生物活性因子,它们能够调节机体其他组织的生理学功能,已经发现的脂肪细胞因子有20多种。目前对该领域的研究十分活跃,但是,许多结论尚不一致[9,18]。瘦素是由 OB基因(位于人染色体7q32)编码的,具有167个氨基酸的蛋白质分子,它可直接或间接地通过下丘脑介导的反应激活骨骼肌AMPK增加脂肪酸的氧化和葡萄糖的摄取和利用[35]。当瘦素浓度在正常的生理范围时,瘦素能通过下丘脑控制食欲,并且增加能量消耗[43],增强胰岛素敏感性[45]。瘦素浓度如果持续保持在较高水平,则肥胖和2型糖尿病风险增高,胰岛素抵抗发生,并伴随代谢综合征[24]。瘦素基因缺陷导致瘦素分泌减少,患者摄食过多而导致肥胖,外源性瘦素注射可逆转此过程[36]。肥胖患者血清瘦素水平高于正常人群,表现出“瘦素抵抗”症状[31]。目前,关于运动对血清瘦素水平影响的研究较多,但是结果不尽一致,随运动强度、运动时间的不同而不同,较为一致的结论包括:1)短时间(1小时至3天)大强度、中等强度运动后循环血液中瘦素水平无显著性变化[23,29];2)短时期(16周内)大强度或中等强度运动后循环血液中瘦素水平在正常人群中无变化,在肥胖患者或糖尿病患者中瘦素水平降低[26,38];3)长期(16周以上)大强度或中等强度运动后瘦素水平降低[6]。本实验发现,24周规律性的麦西来甫-木卡姆练习后,受试者血清瘦素水平极显著降低(P<0.01),原因可能是由于该实验使受试者体脂含量降低,致使脂肪细胞分泌瘦素量减少。此外,体育锻炼使机体糖皮质激素、交感-肾上腺素能系统的活动增强,这对OBmRNA表达都将产生一定的影响,进而影响运动后受试者瘦素含量[2]。
脂联素是脂肪细胞分泌的又一重要生物活性蛋白,脂联素基因位于染色体3q27,全长17kb,属于colectin家族。血液脂联素的生理浓度为5~30Lg/ml,占循环中总血浆蛋白的0.01%[17]。脂联素在调节机体糖、脂代谢,生长发育和炎症反应中都发挥重要的作用[15]。脂联素是迄今为止发现的唯一一种在脂肪容积增大时分泌反而减少的蛋白质产物,对机体具有良好的保护作用[39]。体育锻炼作为一种全身性的应激刺激,对脂肪细胞的分泌功能必将产生一定的影响,进而影响到循环血中脂联素含量,目前,关于这方面的研究已经展开,但是,众多研究结果随实验设计、运 动 时 间 、实 验 对 象 的 不 同 而 表 现 出 众 多 不 一 致[25,30,32,33],同时,对于影响脂联素含量变化的确切机制也不是十分清楚。本实验结果显示,24周规律性的麦西来甫-木卡姆练习后,受试者血脂联素水平极显著升高(P<0.05),这与Hisayo Y等人[28]的研究结果相似,但是,与Rochlitz H等人[42]的研究结果不同。造成本实验结果与前人研究结果不同的原因,可能是实验选用的测试对象和练习时间、强度不同所致。本实验中受试者循环血中脂联素含量升高,可能与24周规律性的麦西来甫-木卡姆练习改善了受试者BF%和血脂成份有关[40]。同时,运动过程中骨骼肌血流量增加,肌纤维规律性的收缩刺激肌管系统产生更多脂联素[34],这也可能是导致实验组脂联素含量升高的一个原因。
胰岛素由胰岛B细胞分泌,在调节糖代谢中发挥重要作用。循环血中胰岛素水平升高,胰岛素敏感性降低,机体发生“胰岛素抵抗”是肥胖人群的重要病发症,同时也是Ⅱ型糖尿病、脂代谢紊乱和“代谢综合症”的重要病理特征。因此,有效控制血胰岛素水平、提高机体血胰岛素敏感性已成为防治上述疾病的重要途径。运动训练在降低循环胰岛素水平、提高机体胰岛素敏感性方面具有显著的作用[20,44],并被视为治疗“胰岛素抵抗”和多种代谢综合症的重要方法。但是,关于运动训练提高机体胰岛素敏感性、降低循环胰岛素水平的确切机制至今还不是十分明了。现阶段的研究结果认为,运动改善胰岛素抵抗状态或提高胰岛素敏感性的作用可能发生在受体前水平、受体水平和受体后水平上。在受体前水平上,运动训练可提高骨骼肌肌糖原合成酶(glycogen synthase)活性和改变血液动力学的特性,从而增加骨骼肌摄取胰岛素和增加葡萄糖转运的能力。在受体水平上,运动训练可以增加胰岛素受体数目[3]、提 高 胰 岛 素 受 体 磷 酸 化 水 平[27],进 而 导 致 下 游 的PI3K和akt发生磷酸化,磷酸化的PI3K和akt进一步导致Glut4向组织细胞膜的募集,最终使组织对葡萄糖的利用率增加[41]。在受体后水平上,运动训练可以提高胰岛素受 体 底 物 (IRS)磷 酸 化 水 平 和IRS-1、IRS-2mRNA 的 表达[19,21],以及 Glut4mRNA 在细胞膜上的表达,从而 增加组织对葡萄糖的摄取能力。但是,最近一系列具有生物活性的脂肪细胞因子的发现使人们对胰岛素抵抗的发病机制有了一个更加深刻的认识,同时也为更加有效地治疗胰岛素抵抗提供了一个新的思路。本实验结果显示,24周规律性的麦西来甫-木卡姆练习后受试者胰岛素水平极显著降低(P<0.01)。笔者认为,实验组胰岛素水平降低除了与上述因素有关之外,还可能与麦西来甫-木卡姆练习提高受试者脂联素水平,降低受试者瘦素水平有关。已有研究证实,脂联素可以通过抑制成熟巨噬细胞的功能、抑制粒细胞和单细胞系的增殖、抑制脂多糖诱导的TNF-α产生等一系列的抗炎症状,消除炎性因子对胰岛素信号传导通路的干扰,从而提高机体胰岛素敏感性[47,12]。瘦素水平降低使得瘦素→AMPK→胰岛素途径更加畅通,对提高机体胰岛素敏感性也有重要的促进作用。
4.3 麦西来甫-木卡姆练习对受试者免疫球蛋白含量的影响
免疫球蛋白是B淋巴细胞经过免疫母细胞阶段分化为浆细胞后,由浆细胞合成和分泌的一组能与抗原发生特异性结合的球蛋白,共有IgG、IgM、IgA、IgE、IgD五大类,在介导体液免疫中发挥重要作用。在运动实践中,IgG、IgM、IgA是常被用到的衡量体液免疫机能和机体抗感染免疫能力高低的指标。目前,关于运动训练对机体免疫机能影响的研究已经较多,较一致的观点认为,长期规律性的中等强度运动可以提高循环中IgG、IgM、IgA含量,进而增强机体的免疫机能[37],而长期大强度运动训练则能降低循环中IgG、IgM、IgA含量,其降低程度随运动负荷的增加而逐渐加剧[22],从而使机体发生较强烈的免疫抑制现象,并表现出明显的免疫机能低下状态。但是,目前在揭示运动训练导致机体免疫抑制或增强的机制方面,还显得不是十分全面,较多的研究集中在神经-内分泌系统和谷氨酰胺方面,认为大强度运动时下丘脑-垂体-肾上腺轴被激活,可的松、促肾上腺皮质激素和儿茶酚胺等激素类物质大量分泌,对免疫系统功能造成抑制作用,尤其是糖皮质激素(GC)的大量分泌对下丘脑-垂体-性腺轴分泌性激素、生长-甲状腺轴分泌生长素(GH)、T3、T4都有重要的抑制作用,而后者对增强机体免疫具有重要的作用。其次,大强度运动过程中谷氨酰胺被大量分解参与供能,以及运动过程中自由基的大量产生都是造成机体免疫功能低下的重要原因。而中、长期中等强度运动则使上述功能轴适度激活,进而造成 GH、促甲状腺素(TSH)、催乳素(PRL)、β-内啡肽、褪黑激素、P物质等相关激素类物质大量分泌,这些激素类物质通过不同的途径作用于免疫系统,最终导致免疫机能增强[10]。本实验结果显示,24周规律性的麦西来甫-木卡姆练习后受试者血清IgG含量极显著升高(P<0.01),IgA、IgM 显著升高(P<0.05)。结果提示,24周规律性的麦西来甫-木卡姆练习提高了B淋巴细胞的功能,使其介导体液免疫的能力增强,这是体质改善的良好表现。原因可能是麦西来甫-木卡姆练习属于中等运动强度,练习过程中使上述功能轴适度激活,使神经-内分泌-免疫系统产生适宜的免疫应答反应[8]。
5 结论
规律性的麦西来甫-木卡姆练习可有效改善肥胖患者身体形态和血脂异常状态,降低循环血中胰岛素含量,使脂肪细胞因子的分泌向有益于健康的方向发展;同时,对于提高机体免疫球蛋白含量,增加免疫功能也有重要的促进作用,具有较高的健身价值。
[1]保继刚,楚义芳.旅游地理学[M].北京:高等教育出版社,2004.
[2]邓树勋,王健.高级运动生理学—理论与应用[M].北京:高等教育出版社,2003.
[3]冯光斌,冯光斌,吴毅,等.运动对糖尿病大鼠脑细胞膜胰岛素受体的影响[J].中国物理医学杂志,1998,20(2):102-104.
[4]高刚,毕存箭,张栓.新形势下新疆体育旅游资源的开发及营销策略[J].新疆师范大学学报,2011,30(3):42-46.
[5]郭风兰,沈林.新疆少数民族自治州传统体育与构建和谐社会研究[J].新疆师范大学学报,2010,29(2):44-48.
[6]黄彩华,陈俊钦,林建新,等.运动改善2型糖尿病胰岛素抵抗与血清脂联素和瘦素及其交互作用[J].中国体育科技,2011,47(7):100-105.
[7]刘恒慨.肥胖的自然运动疗法减肥机理浅识[J].中医药学刊,2005,23(4):82-85.
[8]王茂叶.长期太极拳锻炼对老年女性血清睾酮∕皮质醇、免疫球蛋白和生长激素的影响[J].首都体育学院学报,2009,23(3):343-345.
[9]肖凤英,陆付耳.脂肪细胞因子脂粘联蛋白的研究进展[J].生理科学进展,2003,34(4):309-313.
[10]邢良美,李洁.运动对血清免疫球蛋白IgA、IgM、IgG的影响[J].吉林体育学院学报,2007,23(6):81-83.
[11]徐忠星,张和占,买买提·西日甫,等.新疆墨玉县维吾尔族糖尿病患病率调查[J].中国基层医药,2002,9(3):221-222.
[12]叶丹.炎症反应相关因子与胰岛素抵抗[J].国外医学(内分泌学分册),2004,23(5):312-314.
[13]张守平,臧留鸿.新疆少数民族特色体育旅游项目开发研究[J].成都体育学院学报,2008,34(9):54-56.
[14]郑健荣.健身跑运动对中年人血脂异常者血脂、身体成分的影响[J].北京体育大学学报,2009,32(7):56-59.
[15]周国霞.脂联素、神经-内分泌-免疫调节与运动[J].首都体育学院学报,2008,20(6):53-56.
[16]周勇,赵霞,张玉朝,等.运动减肥人体体态与血脂变化及其相关性研究[J].陕西师范大学学报,2006,34(4):95-98.
[17]ARITA Y,KIHEM S,OUCHI N,et al.Paradoxical decrease of an adi posespecific protein,adiponectin,in obesity[J].Biochem Biophys Res Common,1999,25(7):79-83.
[18]BERGGEN J R,HULVER M W,Houmard J A.Fat as an endocrine organ:Influence of exercise[J].J Appl Physiol,2005,99(2):757-764.
[19]BROWN M D,MOORE G E,KORYTKOWSKI M T,et al.Improvement of insulin sensitivity by short-term exercise training in hypertensive African American women[J].Hypertension,1997,30(6):1549-1553.
[20]BRUCE C R,HAWLEY J A.Improvements ininsulin resistanc with aerobic exercise training:a lipocentric approach[J].Med Sci Sport Exe,2004,36(7):1196-1201.
[21]CHIBALIN A V,YU M,RYDER J W,et al.Exercise-induced changes in expression and activity of proteins involved in insulin signal transduction in skeletal muscle:differential effects on insulin receptor substrates 1and 2[J].Proc Natl Acad Sci USA,2000,97:38-43.
[22]COPPOLA A,COPPOLAL L,MORAL D.Vigorous exercise acutely changes platelet and B-lymphocyte CD39expression[J].J Appl Physiol,2005,98(4):1414-1419.
[23]DIRLEWANGER M,DI VETTA V,GIUSTI V,et al.Effect of moderate physical activity on plasma leptin concentration in humans[J].Eur J Appl Physical,1999,79:331-335.
[24]DYCK D J.Adipokines as regulators of muscle metabolism and insulin sensitivity[J].Appl Physiol Nutr Metab,2009,34(3):396-402.
[25]FERGUSON M A,WHITE L J,MC COY S,et al.Plasma adiponect in response to acute exercise in healthy subject[J].Eur J Appl Physiol,2004,91(2-3):324-329.
[26]FISHER J S,VAN PELT R E,ZINDER O,et al.Acute exercise effect on postabsorptive serum leptin[J].J Appl Physiol,2001,91:680-686.
[27]HELED Y,SHAPIRO Y,SHANI Y,et al.Physical exercise enhances protein kinase C delta activity and insulin receptor tyrosine phosphorylation in diabetes-prone psammomys obesus[J].Metabolism,2003,52(8):1028-1033.
[28]HISAYO Y,MASANORI E,TAKAHIRO A,et al.Effect of aerobic exercise on plasma adiponectin levels and insulin resistance in type 2diabetes[J].Diabetes Care,2004,27(7):1756-1758.
[29]HOUMARD J A,COX J H,MACLESN P S,et al.Effect of short-term exercise training on leptin and insulin action[J].Metabolism,2000,49:858-861.
[30]HULVER M W,ZHENG D,TANNER CJ,et al.Adiponectin is not altered with exercise training despite enhanced insulin action[J].Am J Physiol Endocrinol Metab,2002,283(4):E861-865.
[31]JEQUIER E,TAPPY L.Regulation of body weight in humans[J].Physiol Rev,1999,70(2):451-480.
[32]JURIMAE J,HOFMANN P,JURIMAE T,et al.Plasma adiponect in response to sculling exercise at individual anaerobic threshold in college level male rowers[J].Int J Sports Med,2006,27(4):272-277.
[33]JURIMAE J,PURGE P,JURIMAE T.Adiponectin and stress hormone responses to maximal sculling after volume-extended training season in elite rowers[J].Metabolis,2006,55(1):13-19.
[34]LIN Y,CHEWHCHUK S,LAVIGNEC C,et al.Functional significance of skeletal muscle adiponect in production,changes in animal models of obesity and diabetes,and regulation by rosiglitazone treatment[J].Am J Physiol Endocrinol Metab,2009,297(3):E657-664.
[35]MINOKOSHI Y,KIM Y B,PERONI O D,et al.Leptin stimulates fatty-acid oxidation by activating AMP-activate protein kinase[J].Nature,2002,415(6869):339-343.
[36]MONTAGUE C T,FAROOQI I S,WHITEHEAD J P,et al.Congenital leptin deficiency is associated with severe early-onset obesity in humans[J].Nature,1999,387,(6636):903-908.
[37]NIEMAN D C,PEDERSEN B K.Exercise and immune function:Recent developments[J].Int J Sports Med,1999,27(2):73-80.
[38]OLIVE J L,MILLER G D.Differential effects of maximal-and moderate-intensity runs on plasma leptin in healthytrained subjects[J].Nutrition,2001,17(5):365-369.
[39]OUCHI N,KIHARA S,ARITA Y,et al.Novel modulator for endothelial adhesion molecules:Adipocyte-derived plasma protein adiponectin[J].Circulation,1999,100(25):2473-2476.
[40]PARK S H,KIM J Y,LEE J H,et al.Association between plasma adiponectin and high-density lipoprotein cholesterol in postmenopausal women[J].Clin Biochem,2010,43(13-14):1069-1073.
[41]PENDE M,KOZMAS C,JAQUET M,et al.Hypoinsulinaemia,glucose intolerance and diminished beta-cell size in S6K1-deficient mice[J].Nature,2000,408(6815):994-997.
[42]ROCHLITZ H,AKPULAT S,BOBBERT T,et al.Significance of biomarkers for metabolic syndrome during weight reduction[J].Dtsch Med Wochenschr,2005,130(17):1061-1066.
[43]ROMAN E A,REIS D,ROMANATTO T,et al.Central leptin action improves skeletal muscle AKT,AMPK,andPGC1alpha activation by hypothalamic PI3K-dependent mechanism[J].Mol Cell Endocrinol,2010,314(1):62-69.
[44]ROSS R,JANSSEN I,DAWSON J,et al.Exercise-induced reduction in obesity and insulin resistance inwomen:a randomized controlled trial[J].Obes Res,2004,12(5):789-798.
[45]STEFANYK L E,DYCK D J.The interaction between adipokines,diet and exercise on muscle insulin sensitivity[J].Curr Opin Clin Nut rMetab Care,2010,13(3):255-259.
[46]VAJDA I,MSZROS J,MSZROS Z,et al.Effects of 3hours a week of physicala ctivity on body fat and cardio-respiratory parameters in obese boys[J].Acta Physiol Hung ,2007,94(3):191-198.
[47]YOKOTA T,ORITANI K,TAKAHASHI I,et al.Adiponectin,a new member of the family of soluble defense collagens,negatively regulates the growth of myelomonocytic progenitors and the functions of macrophages[J].Blood,2000,96(5):1723-1732.
