黄瓜枯萎病菌内生拮抗细菌的筛选与鉴定
2012-12-02蔡学清谢玲平胡方平
蔡学清,谢玲平,胡方平
(福建农林大学植物保护学院,福建福州350002)
由尖孢镰刀菌(Fusarium oxysporum f.sp.cucumerinum)引起的黄瓜枯萎病是一类经土壤传播的维管束病害,在我国瓜类种植区普遍发生,并己成为生产上制约黄瓜产量和品质的重要因素之一。据统计,每年黄瓜的发病率可达20%,甚至高达80%-90%,导致黄瓜严重减产(李平生,2003)。
目前对于该病害的防治主要采用采用化学防治,而化学农药则易产生农药残留及环境污染等弊端(陈志杰等,2006),因此生物防治成为目前研究的热点。现已有一些关于黄瓜枯萎病的生物防治的研究报道,如Paulita等从1987年开始研究黄瓜枯萎病的生物防治及其可能的机制(Paulita and Park,1987);范寰筛选到8株对黄瓜枯萎病菌有强拮抗作用的细菌,抑菌直径达18-32 mm,对黄瓜胚根和幼苗生长均有促生作用,混合培养液防效可达70.27%(范寰,2000);等从植物根际土壤中分离出了一株具有1-氨基环丙烷-1-羧酸(ACC)脱氨酶活性的促生拮抗的双功能假单胞菌M18,用M18活菌浸种春黄瓜种子,黄瓜枯萎病的发病率下降70%-80%,产量提高20%以上(许煌泉等,1999);从浙江大学华家池蔬菜所和杭州市蔬菜所的老熟菜地的土壤中分离筛选出对黄瓜猝倒病和黄瓜中期枯萎病分别具有离体拮抗作用的细菌 ZJ14(Bacillus subtilis),ZJ32S1(B.subtilis),ZJ45(Pseudomonas aeruginosa)菌株,通过促芽试验和无菌土盆栽测定,发现ZJ14和ZJ32S1菌株能促进黄瓜种子的萌发和黄瓜苗的生长,增加苗干物质重量,对黄瓜猝倒病和黄瓜中期枯萎病具有防病效果(张震,2004);吴加志进行温室防治实验结果表明,芽孢杆菌和假单胞杆菌属中的一些菌株,对黄瓜枯萎病具有明显的防治效果(吴加志,1996);岳东霞等研究证明假单胞菌类对土传病原菌黄瓜枯萎病菌和棉花枯萎病菌有抑制作用,对黄瓜枯萎病的苗期防效达67.5%(岳东霞等,2002);而洪鹏翔等从番茄、茄子、烟草和辣椒健康植株体内分离筛选出3株对黄瓜枯萎病有20.83%-79.17%的防病效果的内生细菌(洪鹏翔等,2007)。
植物内生细菌存在于植物体内,不易受外界环境的影响,可以较长时间发挥生物学作用,同时它们还可以作为外源基因受体菌,构建具有内生、促生、防病等多功能内生生防工程菌。因此,本研究以黄瓜枯萎病菌为对象,从黄瓜体内分离筛选对该病菌具有抑制作用的细菌菌株,为防治黄瓜枯萎病生物制剂的产业化提供有效菌株。
1 材料与方法
1.1 试验材料
1.1.1 供试黄瓜品种 黄瓜“盐津7号”。
1.1.2 供试病原菌 黄瓜枯萎病菌(Fusarium oxysporum f.sp.cucumerinum)和枯草芽孢杆菌(Bacillus subtilis)菌株TL-2均由本实验室分离鉴定并保存。
1.1.3 培养基(方中达,1998) NA(蛋白胨 5.0 g;牛肉浸膏 3.0 g;葡萄糖 2.5 g;酵母粉1.0 g;琼脂粉16.0-18.0 g;蒸馏水 1 L;PH 7.0-7.2)、PDA(马铃薯 200 g;蛋白胨 5.0 g;葡萄糖(或蔗糖)20.0 g;琼脂 16.0-18.0 g;蒸馏水 1 L)、KB(蛋白胨 20.0 g;MgSO4·7H2O 1.5 g;K2HPO4·H2O 1.8 g;纯甘油 10.0 mL;琼脂粉 16.0-18.0 g;蒸馏水 1 L;pH 7.2-7.4)、TSA(胰蛋白胨 15.0 g;大豆胨 5.0 g;NaCl 5.0 g;琼脂 16.0-18.0 g;蒸馏水 1 L;pH 7.2-7.4)、蛋白胨水培养基(蛋白胨 10.0 g;NaCl 5.0 g;蒸馏水 1 L;pH 7.2-7.4)
1.2 黄瓜内生细菌的分离
参照何红等(2002)方法。从黄瓜的茎、花、叶、果上各取组织1.0 g,用70%酒精浸泡30 s,无菌水漂洗后,置于1%次氯酸钠中表面消毒3-5 min(其中叶片和花3 min,茎和果5 min),取出后用无菌水冲洗3次。样品晾干后分别置于无菌研钵中并加5 mL无菌水研磨成浆状,静置10-15 min后,每一样品各取上层澄清液50 μL分别涂布在培养基(NA、KB和TSA)平板上,每种培养基涂布3皿,28℃黑暗培养48-72 h,计算每一平板的菌落数。表面消毒后研磨前,取50 μL最后一次无菌水冲洗液涂布平板或者是采用组织印迹试验,将最后一次清洗的植物组织在培养基平板上印一下,同上述条件下培养48 h,观察有无菌落产生,以验证消毒方法是否能杀死供试材料表生微生物。根据菌落形态、颜色等挑取单菌落,划线分离、纯化后保存,供测试鉴定。
1.3 黄瓜枯萎病菌内生拮抗细菌的筛选
采用对峙生长法,测定所有分离菌株对黄瓜枯萎病菌的拮抗作用。在PDA平板中央接入直径为5 mm的真菌菌丝块,48 h后在平板四个边缘距中央中心处接入一小环细菌菌落,28℃下黑暗培养,设不接种的处理为对照,72 h后观察真菌菌落大小以及形成的抑菌圈和抑菌带。
1.4 内生拮抗菌株的鉴定
1.4.1 菌株的培养 将供试菌株接种在NA斜面上,28℃培养18-72 h后备用,或配成3×108cfu·mL-1的菌悬液备用。
1.4.2 形态观察和生理生化测定 参照方中达(1998)的方法和东秀珠和蔡妙英(2001)的方法。
2 结果与分析
2.1 黄瓜内生拮抗细菌的分离结果
用三种不同培养基分离黄瓜体内的内生细菌,结果表明(表1),黄瓜不同部位﹙花、茎、叶、果﹚均存在大量的内生细菌,内生细菌数量为2.9×103-25.6×103cfu·(g·FW)-1。从不同部位来看,叶片中的细菌数量比其他部位多,花中的细菌数量比茎中的细菌数量多,果中的细菌数量最少。从不同培养基来看,在NA培养基中分离到的细菌数量比其他培养基的细菌数量多,在TSA培养基中分离到的细菌数量最少。由此可见,植物的不同部位其内生细菌的数量不同,不同的培养基分离植物的同一部位其内生细菌的数量也不同。

表1 黄瓜不同器官分离出的内生细菌数量(×103cfu·(g·FW)-1)Table 1 Population of endophytic bacteria separated from different organs of cucumber(×103cfu·(g·FW)-1)
2.2 黄瓜枯萎病菌拮抗细菌的筛选结果
分别从黄瓜叶、花、茎、果上分离的内生细菌中共筛选到对黄瓜枯萎病菌有不同程度拮抗作用的内生细菌20株(表2),占分离总数的33.3%,其中HY3、HY4、HY6等10株对黄瓜枯萎病菌的拮抗效果较好,其抑菌带宽度为4.5-8.5 mm(表3)。
2.3 内生拮抗菌株的鉴定结果
2.3.1 菌株的培养性状 供试菌株在NA培养基上于28℃培养48 h,菌落为灰白色、圆形或近圆形、边缘不整齐、凸起呈乳头状或中央凹陷、表面干燥、不透明。供试的10株菌株的耐盐性均达到5%,部分菌株(HY3、HY6、HJ5、HH2、HY7、HH4和 HH)为 7%;另外,供试菌株在4℃均不能生长,除了HY4和HJ6菌株外,其余菌株均可在50℃下生长(表4)。
2.3.2 菌株的形态和染色反应 供试菌株的菌体均呈杆状,周生鞭毛,革兰氏染色阳性,产芽孢,芽孢中生或端生。
2.3.3 生理生化性状 从表5可知:供试的所有菌株好氧或兼性厌氧、接触酶阳性,不产生吲哚和苯丙氨酸脱氨酶,能利用柠檬酸盐、L-阿拉伯糖、乳糖、D-甘露醇、D-葡萄糖和水解淀粉,这与对照菌株TL2的测定结果一致。但是菌株HH7和HY7不能利用D-木糖、菌株HY3不能还原硝酸盐、菌株HY3、HY6、HY9 V-P测定呈阴性,这与对照菌株TL2不一致,而其他的所有菌株的测定结果均与对照菌株TL2一致。参照东秀珠等(2001)编写的《常见细菌系统鉴定手册》鉴定表明,供试的10个菌株均为芽孢杆菌属(Bacillus spp.)。
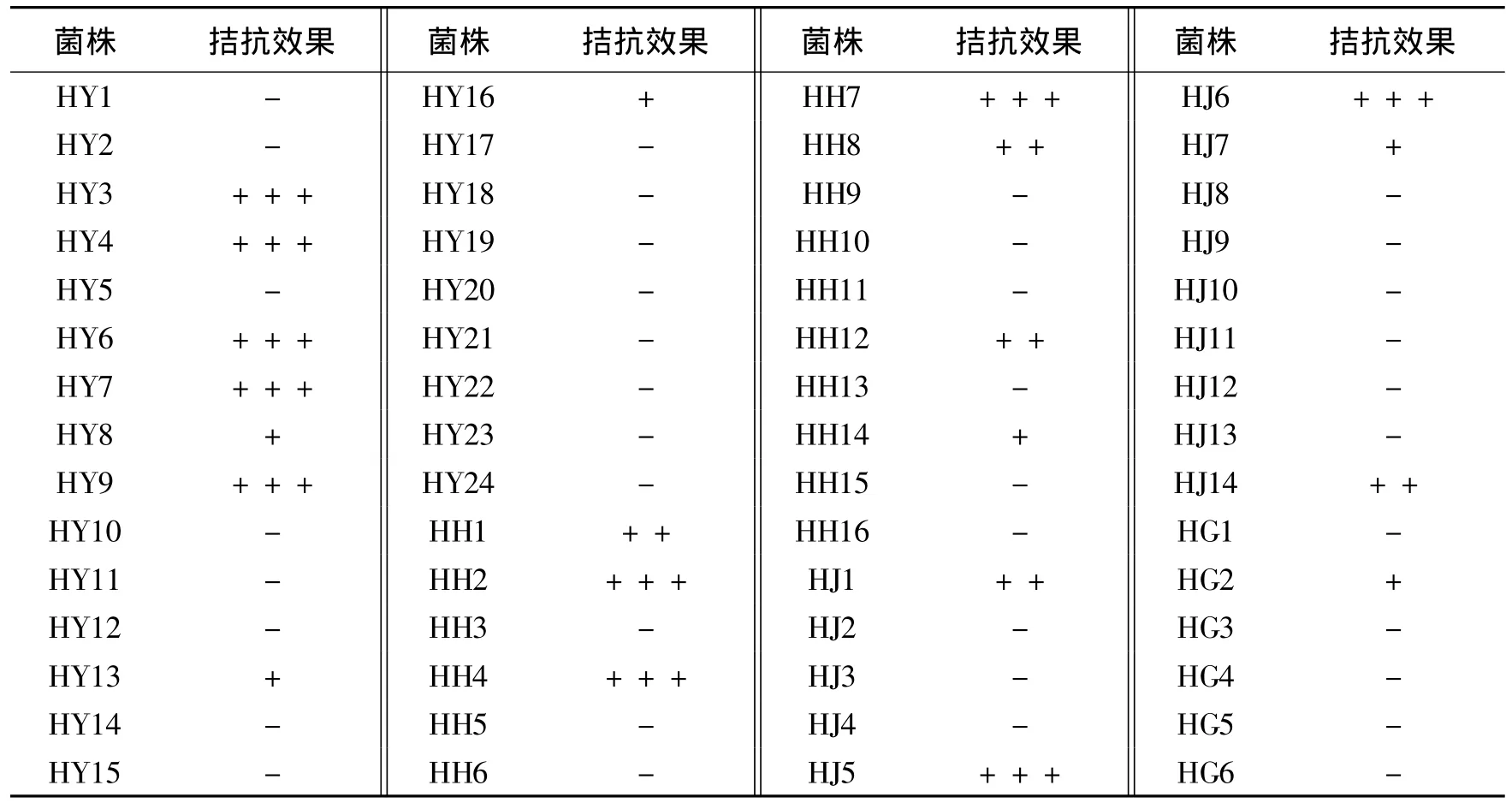
表2 黄瓜枯萎病菌内生拮抗细菌的筛选结果Table 2 Screening of the antagonistic and endophtic bacteria to Fusarium oxysporum f.sp.cucumerinum
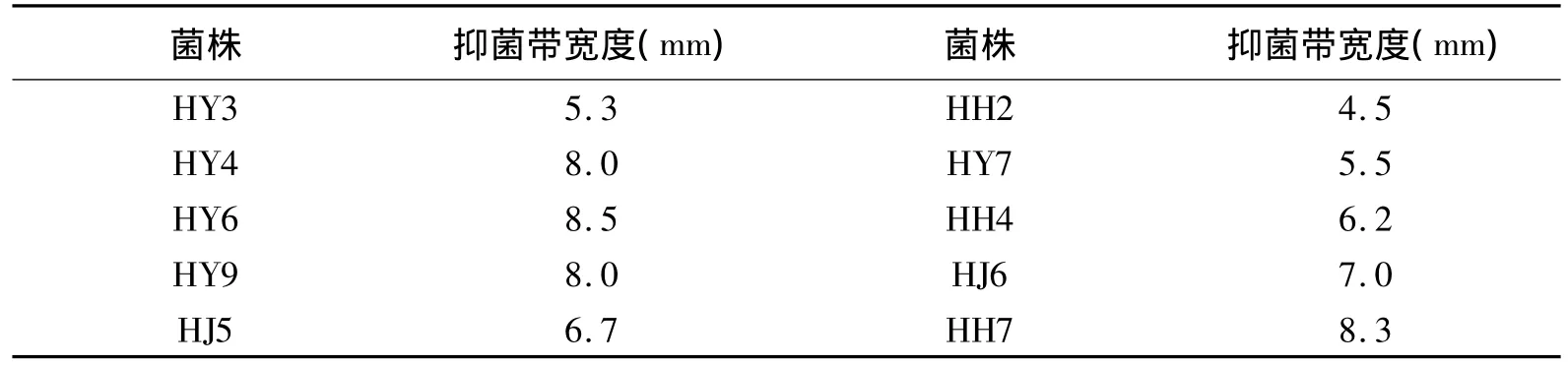
表3 内生拮抗菌对黄瓜枯萎病菌的拮抗能力Table 2 Inhibition activity of endophytic bacterial strains to Fusarium oxysporum f.sp.cucumerinum
3 讨论
黄瓜内生细菌的分离结果表明,黄瓜体内存在大量的内生细菌,其种群数量为2.9×103-25.6 ×103cfu·(g·FW)-1这与前人报道的植物内生细菌数量(一般在 103-105cfu·g-1之间)基本吻合(Quadt-Hallmann and Kloepper,1996);不同培养基上分离获得的内生细菌种群数量不一样,不同部位内生细菌种群数量也有一定的差异,其中从叶片中分离到的内生细菌数量做多,而健康果实中分离到的内生细菌种群数量最少,这与何红等从辣椒植株不同部位分离内生细菌所获得的研究结果相同(何红等,2002)。
现已报道的对黄瓜枯萎病具有防治效果的拮抗菌株绝大部分是从土壤或植物根际土壤分离的,这些拮抗菌株易受外界条件的影响,田间防病效果不稳定,存在着一定的缺陷(李长松,1992);而植物内生细菌存在于植物体内,不易受外界环境的影响,可以较长时间发挥生物学作用(杨海莲等,1998;Sturz et al.,2000),因此,本研究从黄瓜体内分离获得的对黄瓜枯萎病菌具有拮抗效果的菌株具有较好的应用前景,但对于这些拮抗菌株对黄瓜枯萎病的田间防治效果如何?能否应用于生产实践有效地控制该病害,还有待于进一步研究。

表4 目标菌株在不同温度和不同盐度下的生长状况Table 4 Growth of the tested bacterial strains at different temperature and sodium chloride concentration

表5 内生细菌菌株对碳素化合物的分解和利用及生理生化测定结果Table 5 Growth of the tested bacterial strains at different temperature and sodium chloride concentration
陈志杰,张淑莲,张锋,梁银丽,徐福利.2006.温室黄瓜病虫害化学防治现状及其无公害防治对策.中国生态农业学报,14(2):141-143.
东秀珠,蔡妙英.2001.常见细菌系统鉴定手册.北京:科学出版社,364-384.
范寰.2000.防治黄瓜枯萎病拮抗细菌的筛选.天津轻工业学院学报,(3):29-40.
方中达.1998.植病研究方法.北京:中国农业出版社.
何红,蔡学清,洪永聪,关雄,胡方平.2002.辣椒内生细菌的分离及拮抗菌的筛选.中国生物防治,18(4):171-175.
洪鹏翔,邱思鑫,陈航,赵秀丹,胡方平.2007.4种茄科作物内生细菌的分离及拮抗菌的筛选.福建农林大学学报(自然科学版),36(4):347-351.
李长松.1992.拮抗细菌生物防治植物土传病害的研究进展.生物防治通报,8(4):168-172.
李平生.2003.黄瓜枯萎病及其防治.现代农业,(12):35.
吴加志.1996.植物土传,根际和内生细菌用于植物病害生物防治潜力的研究.中国微生态学杂志,8(3):4-13.
许煌泉,唐玮宁,郑有丽,钟仲贤,徐悌惟.1999.筛选假单胞菌株M18防治大棚黄瓜枯萎病害.上海交通大学学报,33(2):210-214.
杨海莲,孙晓璐,宋未.1998.植物内生细菌的研究.微生物学通报,25(4):224-227.
岳东霞,许长蔼,张要武,陈融.2002.黄瓜枯萎病拮抗细菌的筛选与防治.天津农业科学,8(4):8-9.
张震.2004.土传植物病害拮抗细菌根围生态学研究.杭州:浙江大学.
Paulita TC,Park CS,Baker R.1987.Biological control of Fusarium wilt of cucumber with non-pathogenic isolates of Fusarium oxysparum.Canada Journal Microbiology,33:349-353.
Quadt-Hallmann A,Kloepper JW.1996.Immunological detection and localization of the cotton endophyte Enterobacter asburiae JM22 in different plant species.Canada Journal Microbiology,42(11):1144-1154.
Sturz AV ,Christie BR,Nowak J.2000.Bacterial endophytes:potential role in developing sustainable systems of crop production.Critical Reviews in Plant Sciences,19(1):1-30.
