离子液体中磺化无定形炭催化菊糖制备5-羟甲基糠醛
2012-11-30公艳艳贾松岩冯建萍宋春山郭新闻
公艳艳 刘 民,* 贾松岩 冯建萍 宋春山,2 郭新闻,*
(1大连理工大学化工学院催化化学与工程系,精细化工国家重点实验室,辽宁大连116024;2EMS Energy Institute and Department of Energy and Mineral Engineering,Pennsylvania State University,University Park,Pennsylvania 16802,USA)
离子液体中磺化无定形炭催化菊糖制备5-羟甲基糠醛
公艳艳1刘 民1,*贾松岩1冯建萍1宋春山1,2郭新闻1,*
(1大连理工大学化工学院催化化学与工程系,精细化工国家重点实验室,辽宁大连116024;2EMS Energy Institute and Department of Energy and Mineral Engineering,Pennsylvania State University,University Park,Pennsylvania 16802,USA)
研究了以1-丁基-3-甲基咪唑氯盐([Bmim]Cl)离子液体作溶剂,磺化无定形炭为催化剂催化菊糖脱水制5-羟甲基糠醛(HMF)的反应.考察了溶剂、水量、反应温度、反应时间和催化剂用量对HMF收率的影响.实验结果表明,反应温度为100°C,反应时间60 min,R=5(R为水的物质的量与菊糖中所含果糖单位的物质的量的比值),m(催化剂):m(菊糖)=1:3时,HMF的收率可达50%.
菊糖;5-羟甲基糠醛;磺化无定形炭;离子液体;果糖
1 引言
随着化石资源的不断消耗和日益严重的环境问题,开发和利用可再生资源已引起人们的广泛关注.生物质资源仅次于煤、石油和天然气,是人类生存发展的重要资源之一.因此,采用绿色的化学方法和工艺将生物质转化成清洁能源和精细化学品,以代替逐渐枯竭的化石资源,是可持续发展的重要研究方向,对推动可再生能源产业的发展具有重大的意义.1,2
离子液体(ILs)作为一种新型绿色有机溶剂,得到了广泛的认识和应用,它被认为是一种环境友好型的溶剂和催化剂体系.3,4离子液体是在室温或者室温附近温度下呈液态的完全由离子构成的物质.与水、传统有机溶剂、超临界流体等反应溶剂相比,离子液体有一些突出优势,5例如:可设计性、良好的溶解性、导电性、不挥发性、良好的化学稳定性和热稳定性等.近几十年,离子液体在清洁能源研究中的重要意义和作用越来越受到化学工作者的重视.目前,离子液体可以作为溶剂或者催化剂应用在生物质转化过程中.
5-羟甲基糠醛(HMF)被认为是一种用途非常广泛的化学中间体.6HMF可以通过氧化脱氢、加氢、酯化、卤化、聚合、水解以及其它化学反应,合成许多有用的化合物和新型高分子材料,如乙酰丙酸、2,5-二甲基呋喃(DMF)、2,5-呋喃二甲酸等.其中DMF被认为是一种极具潜力的燃料.果糖、葡萄糖和纤维素等生物质是最近研究的对象,研究者主要关注如何将这些底物有效转化为HMF,目前常用的催化剂包括无机酸、7-9Lewis酸10-12和固体酸13-15等.
菊糖的主要成分是低聚果糖,而果聚糖是自然界中含量丰富的碳水化合物资源之一,是植物中继蔗糖和淀粉之后的第三大储藏性碳水化合物.以菊糖为原料制取HMF可能经过两步反应,第一步菊糖水解生成果糖,然后生成的果糖在酸性条件下脱水生成HMF(如图1所示),因此在成功实现果糖高效、快速制备HMF的基础上,如何以菊糖为原料一步制备HMF是对降低工业生产成本具有重要意义.目前对于酸催化菊糖制备HMF已有一些研究,常用的催化剂有无机酸,16-18酸性离子交换树脂,19酸性离子液体20等.无机酸等均相催化剂的催化性能较好,但是存在着设备腐蚀大、回收能耗大、环境污染严重等问题,不符合绿色化学的要求.
近年来,磺酸型固体酸的开发成为研究的热点,其研究思路是在一些载体(如中孔硅分子筛、中孔炭分子筛、无定形炭等)上通过各种方法引入磺酸基团.这种材料一般通过两种途径合成:一是对磺化的多环芳香化合物进行不完全碳化,二是对蔗糖、葡萄糖、淀粉和纤维素等生物质进行不完全碳化,然后再磺酸化.相比较而言,后者得到的固体酸的性能更稳定些,并且原材料成本较低.磺化炭材料21-23作为催化剂已经应用在生物质转化过程中.本文以制备简单且成本较低的磺化炭材料为催化剂,离子液体[Bmim]Cl为溶剂,研究了将菊糖一锅法转化为HMF的生产工艺.
2 实验部分
2.1 主要试剂
5-羟甲基糠醛(纯度98%)购自百灵威科技有限公司;蔗糖(分析纯)购自天津市博迪化工有限公司;菊糖(分析纯)购自阿拉丁试剂;1-丁基-3-甲基咪唑氯盐([Bmim]Cl,纯度99%),1-丁基-3甲基咪唑六氟酸磷盐([Bmim]PF6,纯度99%)购自河南利华制药有限公司.
2.2 催化剂制备
参照文献24,25制备磺化无定形炭.称取一定量蔗糖配制成水溶液(2 mol·L-1),将溶液倒入具有聚四氟乙烯内衬的晶化釜,置于180°C恒温箱中15 h,得到黑色悬浊液,将黑色悬浊液置于100°C烘箱中干燥12 h,研磨,得到黑色固体粉末.称取2 g上述黑色固体碳材料置于晶化釜,加入30 mL 96%-98%浓硫酸,置于200°C烘箱中放置15 h.取出冷却至室温后,用高于80°C去离子水洗涤过滤,直至滤液中检测不到SO2-
4为止,然后将得到的黑色固体粉末于100°C烘干,即得磺化无定形炭.

图1 酸催化菊糖水解、脱水生成HMF的步骤Fig.1 Pathways for acid-catalyzed hydrolysis and dehydration of inulin to produce 5-hydroxylmethylfurfural(HMF)
2.3 催化剂表征
催化剂的红外表征在德国Bruker公司EQUINOX 55型傅里叶变换红外(FT-IR)光谱仪上进行, KBr压片,扫描的波数范围在4000-400 cm-1.
催化剂的X射线光电子能谱(XPS)表征采用美国Thermo VG公司的Escalab 250能谱仪进行.以AlKα(1486.6 eV)为X光源,通能为50.0 eV,元素的结合能用C 1s(EB=284.8 eV)校正荷电位移.
采用德国Elementar公司的vario EL III型元素分析仪对催化剂进行元素组成分析,采用中和滴定法测定催化剂酸量.26将50 mg催化剂加入20 mL 2 mol·L-1的NaCl溶液中,室温下超声振荡1.5 h,使催化剂表面的H+和Na+交换达到平衡.用9 mmol·L-1的NaOH溶液滴定,在25°C下用pH计测定滴定后溶液的pH值,直到溶液显中性.
2.4 催化反应
反应器中依次加入300 mg[Bmim]Cl离子液体、15 mg菊糖,100°C下磁力搅拌15 min,待菊糖完全溶于[Bmim]Cl离子液体后,加入5 mg磺化无定形炭催化剂,开始计时,反应结束后用去离子水稀释反应后的混合液,并将其移入25 mL容量瓶中,定容,采用高效液相色谱分析其组成.产物主要为果糖和HMF,另有微量葡萄糖和低聚果糖.
2.5 HMF的测定
采用Aglient 1200高效液相色谱对反应产物进行定量分析.采用Aglient 1200 Wpals自动进样器, Aglient 1200系列示差折光检测器,色谱分析柱为BIO RAD Aminex HPX-87H Column 300 mm×7.8 mm柱子.分析过程中样品进样量为10 μL,流动相(0.005 mol·L-1硫酸溶液)流速为0.55 mL·min-1,分离柱温度设定为65°C,示差检测器温度为50°C,色谱运行时间约35 min.10
3 结果与讨论
3.1 催化剂的表征
3.1.1 FT-IR光谱
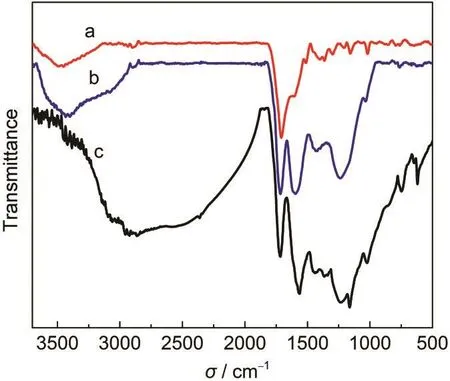
图2 无定形炭磺化前后样品的FT-IR谱图Fig.2 Fourier transform infrared(FT-IR)spectra of amorphous carbon before and after sulfonation(a)amorphous carbon;(b)sulfonated amorphous carbon; (c)recovery of amorphous carbon
图2为无定形炭磺化前后样品以及反应后磺化无定形炭的FT-IR谱图,从图中可发现,在3400-3500,1750,1600 cm-1处都有吸收峰.3400-3500 cm-1处的吸收峰归属于-OH键的伸缩振动;1750 cm-1处的吸收峰归属为C=O的吸收峰,1600 cm-1处的吸收峰归属为C=C键的伸缩振动.而将图2a和2b两个谱图相比,发现磺化后的样品(图2b)在 1750和1600 cm-1处的峰强度变强,可能是因为炭材料经过浓硫酸磺化,使糖分子之间发生脱水反应和酯化反应,从而导致C=O、C=C处的峰强度增强.更为重要的是,磺化后的炭材料在1250、1040 cm-1处出现了较明显的吸收峰.根据文献22,27报道,1250、1040 cm-1处吸收峰分别归属于-SO3H基团中O=S=O键的不对称和对称伸缩振动.催化剂在制备过程中,已经用足够的热水洗涤催化剂表面弱结合的-SO3H基团,因此这说明-SO3H基团被嫁接到了催化剂上.反应后的磺化无定形炭(图2c)在1750、1600 cm-1处的吸收峰强度几乎没有发生变化,并且在1250、1040 cm-1左右处仍有-SO3H基团的特征峰出现,但是强度有些减弱,可能因为磺酸根与离子液体发生了离子交换,一小部分磺酸根损失.
3.1.2 XPS光谱
图3为磺化炭材料的XPS谱图,284、533、168 eV处有明显的特征峰,分别归属于C 1s、O 1s、S 2p.催化剂的C 1s光谱拟合后裂分为3个峰,结合能位于284.2、286.1、288 eV,分别归属为C-C、C-OH、C=O.28O 1s光谱拟合后裂分为2个峰,533.1、531.3 eV分别归属为C-OH、C=O.S 2p光谱拟合后裂分为2个峰,其中位于168.2 eV处出现了明显的特征峰.根据文献29报道,结合能于168 eV左右的峰归属于-SO3H基团.然而,164 eV左右的相对较小的吸收峰可能为C-S-C中的的吸收峰.30根据谱图可计算出催化剂中S原子数含量是0.72%,说明-SO3H已经被成功引入炭材料.
3.1.3 催化剂的酸量

图3 磺酸化无定形炭的XPS谱图Fig.3 X-ray photoelectron spectroscopy(XPS)patterns of sulfonated amorphous carbon Grey(green in web version)line represents the original XPS data.
通过元素分析以及酸碱中和滴定测定了催化剂的酸量.从表1可以看出,酸碱中和滴定得到的酸量要比元素分析测得的数据大5倍左右,这与Zhang等23得到的数据类似.这是因为无定形炭经过磺化后,催化剂表面除了-SO3H外,还有大量的-COOH和-OH,22因此酸碱中和滴定得到的酸量是催化剂的总酸量.从XPS谱图中发现,S元素不只以-SO3H基团形式存在,部分S还以别的基团形式存在,因此元素分析测得的S含量不能完全代表-SO3H的含量.通过XPS以及元素分析计算出催化剂中-SO3H基团的浓度为0.42 mmol·g-1.
3.2 催化转化菊糖制HMF的反应考察
3.2.1 反应溶剂对HMF产率的影响
反应介质对产物的产率以及产物的稳定性有着重要的影响,因此首先考察了溶剂对催化转化菊糖制HMF的影响.图4显示了分别以水、[Bmim]Cl和[Bmim]PF6为溶剂时,菊糖转化制HMF的情况.从图中看出,当水为溶剂时,菊糖主要发生水解生成果糖,而生成的果糖并没有进一步发生脱水反应生成HMF,可能因为大量水的存在抑制了果糖的脱水反应;在30 min内,果糖产率逐渐增加,30 min达到最高值78%,而30 min后果糖产率略有下降并趋于稳定,可能是因为生成的果糖进一步发生了副反应导致产率下降.当[Bmim]Cl为溶剂时,在菊糖转化过程中,主要产物是果糖和HMF;当反应时间为5 min时,果糖产率达到最高收率为17%,HMF收率在5 min之内可以达到7%.这表明水解生成的果糖在[Bmim]Cl中可以迅速转化,并且随着时间的延长,果糖收率逐渐下降,HMF收率逐渐升高,反应30 min左右,果糖收率接近0,HMF产率趋于达到最高值.而当以憎水性的[Bmim]PF6为溶剂时,在反应过程中发现菊糖不溶于[Bmim]PF6,并且伴有少量的白烟生成,可能是因为离子液体中的PF-6与磺酸根离子发生反应,生成PF5和HF;果糖产率在5 min就高达51%,随着反应的进行果糖产率急剧下降,并且在整个反应过程几乎没有HMF生成,我们猜测可能是因为生成的PF5是聚合反应常用的催化剂,31使生成的果糖发生聚合反应.以上结果说明酸催化菊糖转化为HMF反应可能通过两步反应,第一步是菊糖水解生成果糖,第二步是生成的果糖发生脱水反应生成HMF;并且发现水的存在对HMF产率有很大的影响,大量水会抑制果糖的脱水反应,导致HMF收率很低.

表1 磺化无定形炭的酸性Table1 Acidity of sulfonated amorphous carbon
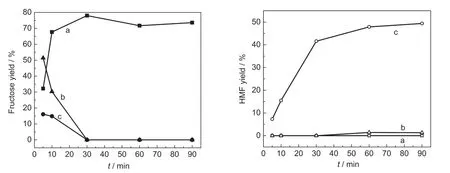
图4 反应溶剂对果糖及HMF产率的影响Fig.4 Effect of reaction solvent on the yield of fructose and HMF(a)water as the solvent,(b)[Bmim]PF6as the solvent;(c)[Bmim]Cl as the solvent; reaction conditions:15 mg inulin and 5 mg sulfonated amorphous carbon were added into 300 mg different solvents at 100°C.
3.2.2 水量对HMF产率的影响
水为溶剂时,可以发现HMF产率为0,我们猜测可能是因为大量水的存在抑制了果糖的脱水反应,因此更详尽地考察了不同加水量对HMF收率的影响.实验之前,我们对离子液体进行真空干燥,使离子液体中所含的水分降到最低.据文献32报道,当离子液体[Bmim]Cl中的水含量低于5%(质量分数)时,水对果糖的转化率和HMF的收率无影响,因此干燥后的离子液体中的极少量水对反应无影响.从图5可发现随着R的增大,HMF收率先升高后降低,当R=5时,HMF产率达到最高值50%,主要原因是初始加入的水有利于菊糖水解生成果糖,果糖再进一步脱水转化为HMF,而大量水的加入抑制了果糖脱水生成HMF.因此,在此反应中欲得到高产率HMF,应选择合适的加水量.
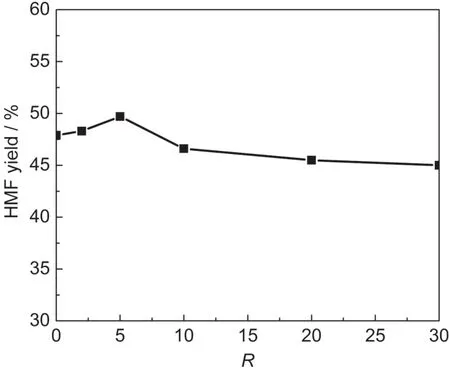
图5 水量对HMF产率的影响Fig.5 Effect of water concentration on the yield of HMFR represents the molar ratio of added water to fructose units in inulin; reaction conditions:15 mg inulin and 5 mg sulfonated amorphous carbon were added into 300 mg[Bmim]Cl at 100°C,then different amount of water was added.
3.2.3 反应温度对HMF产率的影响

图6 反应温度对果糖及HMF产率的影响Fig.6 Effects of temperature on the yield of fructose and HMFreaction conditions:15 mg inulin and 5 mg sulfonated amorphous carbon were added into 300 mg[Bmim]Cl at different temperatures, then 7.5 μL H2O(R=5)was added.

图7 催化剂用量对HMF及果糖产率的影响Fig.7 Effect of the catalyst dosage on the yield of HMF and fructosereaction conditions:15 mg inulin and a certain amount of catalyst were added into 300 mg[Bmim]Cl at 100°C,then 7.5 μL H2O(R=5)was added.
温度对一个化学反应来说,有着非常重要的影响.图6显示了反应温度对HMF产率的影响.实验结果表明,温度对菊糖转化为HMF的影响较大,温度越高,菊糖转化为HMF的反应速率越快.当反应5 min时,不同温度下HMF和果糖的收率差别很大,反应温度为120、100和80°C时,HMF的收率分别为45%、15%和5%左右,果糖的收率分别为0%、17%和13%左右.反应温度为80°C时,HMF的收率随着反应时间延长逐渐升高,反应90 min HMF产率达到最高值45%,随着反应时间的继续延长果糖产率逐渐下降;反应温度为100°C时,30 min之内果糖收率快速下降,HMF的收率大幅度增长,但是30 min之后HMF收率增长幅度变缓,产率趋于稳定,当反应60 min时,HMF的收率达到最高值50%;当反应温度为120°C时,HMF的收率在很短时间内就达到43%,随着时间的延长产率趋于稳定,并且收率略低于反应温度为100°C时的收率,可能是因为较高温度引起HMF发生一些副反应.上述结果表明,低温条件下,菊糖水解生成果糖以及果糖脱水生成HMF的速率相对较慢,HMF收率达到最高值所需反应时间长;而升高温度有利于加快反应速率,缩短HMF收率达到最高值的反应时间,但是温度过高,可能引起其他副反应或者反应产物的分解,因此选择100°C作为本反应的最佳反应温度.
3.2.4 催化剂用量对HMF产率的影响
图7显示了催化剂用量对HMF产率的影响.当反应5 min时,果糖产率在18%左右,而HMF收率随着催化剂用量的增加,由4%提高到15%.说明酸性条件下菊糖第一步水解生成果糖的反应很容易进行,催化剂用量的增加,导致反应体系内酸性增强,使得菊糖水解生成的果糖更容易进行脱水反应.随着时间的延长,果糖产率逐渐下降,HMF收率呈现上升的趋势,可能因为反应初期菊糖水解生成果糖的反应速率大于果糖脱水生成HMF的反应速率,而随着反应的进行,果糖脱水速率逐渐加快.当反应进行60 min后,HMF收率增加缓慢,原因可能有两个方面,一是因为反应平衡的接近,另一方面可能是随着菊糖水解转化为果糖,果糖脱水转化为HMF反应的深入,体系中的水含量不断增加,抑制了果糖脱水反应且稀释了反应体系内的酸性.
3.2.5 重复利用
在离子液体体系中,产物的分离纯化比在二甲基亚砜(DMSO)、N,N-二甲基乙酰胺(DMA)等强极性有机溶剂体系相比要简单,反应完成后,仅需要加入低沸点的有机溶剂(例如乙酸乙酯)萃取HMF,然后蒸馏出低沸点的有机溶剂即可得到高纯度的HMF.我们采用乙酸乙酯为萃取剂萃取反应后溶液中的HMF,多次萃取,直至上层乙酸乙酯溶液为无色为止,然后将下层溶液减压蒸馏,除去残留的乙酸乙酯和水.向减压蒸馏后的体系中加入新鲜的菊糖考察离子液体的重复利用,并且反应后将催化剂过滤出来,用去离子水和无水乙醇洗涤,烘干,考察其重复利用性.

图8 离子液体和催化剂的重复利用对HMF产率的影响Fig.8 Effects of recycling of ionic liquid and catalyst on the yield of HMFRuns(1,2,3):the recycling of IL and catalyst;Run 4:the recycling of catalyst;reaction conditions:405 mg inulin and 135 mg sulfonated amorphous carbon were added into 8.4 g[Bmim]Cl at 100°C,then 202 μL H2O(R=5)was added,t=1 h.
从图8中发现,用乙酸乙酯萃取反应后溶液中的HMF后,[Bmim]Cl离子液体和催化剂可以重复利用,HMF的产率保持在50%左右.Run 3中HMF的产率略有升高,可能因为重复使用的[Bmim]Cl离子液体含有残余的HMF;而在单独考察催化剂重复利用(Run 4)的结果中发现,一次循环后的催化剂活性有所下降,导致HMF的产率下降,产率为37%,可能是因为磺化无定形炭上的磺酸根基团与离子液体中的离子发生了离子交换,导致催化剂上的磺酸根部分损失,HMF产率下降.
4 结论
采用蔗糖为碳源,经过磺化处理而得到的磺化无定形炭催化剂,在离子液体[Bmim]Cl中催化菊糖一步转化制备HMF中,表现出了较好的活性.在反应温度为100°C,催化剂与菊糖质量比为1:3,R=5,反应60 min后,得到最高的HMF产率,达50%,但是催化剂磺化无定形炭与离子液体中的离子发生部分离子交换,使催化剂的活性部分下降,固体酸磺化无定形炭仍表现出了较高活性,避免了无机酸的回收、腐蚀问题,为环境友好的生物质转化技术提供了一条可能的路径.
(1) Huber,G.W.;Iborra,S.;Corma,A.Chem.Rev.2006,106,4044.
(2) Ragauskas,A.J.;Williams,C.K.;Davison,B.H.;Britovsek, G.;Cairney,J.;Eckert,C.A.;Frederick,W.J.;Hallett,J.P.; Leak,D.J.;Liotta,C.L.;Mielenz,J.R.;Murphy,R.;Templer, R.;Tschaplinski,T.Science 2006,311,484.
(3) Freemantle,M.Chem.Eng.News 1998,7,32.
(4) Wasserscheid,P.;Keim,W.Angew.Chem.Int.Edit.2000,39, 3772.
(5)Yan,L.F.;Zhu,Q.S.Chemistry 2001,11,673.[阎立峰,朱清时.化学通报,2001,11,673.]
(6)Kamm,B.;Kamm,M.;Schmidt,M.Lignocellulose-Based Chemical Products and Produce Family Trees;Wiley-VCH Verlag GmbH:Germany,2006;Vol.2,pp 97-149.
(7) Roman-Leshkov,Y.;Barrett,C.J.;Liu,Z.Y.;Dumesic,J.A. Nature 2007,447,982.
(8) Asghari,F.S.;Yoshida,H.Ind.Eng.Chem.Res.2006,45(7), 2163.
(9) Sherrard,E.C.;Kressman,F.W.Ind.Eng.Chem.1945,37,5.
(10) Zhao,H.B.;Holladay,J.E.;Brown,H.;Zhang,Z.C.Science 2007,316,1597.
(11) Ishida,H.;Seri,K.J.Mol.Catal.A-Chem.1996,112,163.
(12) Su,Y.;Brown,H.M.;Huang,X.W.;Zhou,X.D.;Amonette,J. E.;Zhang,Z.C.Appl.Catal.A-Gen.2009,361,117.
(13) Rinaldi,R.;Palkovits,R.;Schüth,F.Angew.Chem.Int.Edit. 2008,47,8047.
(14) Ohara,M.;Takagaki,A.;Nishimura,S.;Ebitani,K.Appl.Catal. A-Gen.2010,383,149.
(15) Qi,X.H.;Watanabe,M.;Aidaa,T.M.;Smith,R.L.,Jr.Green Chem.2008,10,799.
(16)Wu,S.X.;Fan,H.L.;Xie,Y.;Cheng,Y.;Wang,Q.;Zhang,Z. F.;Han,B.X.Green Chem.2010,12,1215.
(17) Bicker,M.;Hirth,J.;Vogel,H.Green Chem.2003,5,280.
(18) Chheda,J.N.;Roman-Leshkov,Y.;Dumesic,J.A.Green Chem. 2007,9,342.
(19) Qi,X.H.;Watanabe,M.;Aida,T.M.;Smith,R.L.,Jr.Green Chem.2010,12,1855.
(20) Hu,S.Q.;Zhang,Z.F.;Zhou,Y.Z.;Song,J.L.;Fan,H.L.; Han,B.X.Green Chem.2009,11,873.
(21) Onda,A.;Ochi,T.;Yanagisawa,K.Green Chem.2008,10,1033.
(22) Suganuma,S.;Nakajima,K.;Kitano,M.;Yamaguchi,D.;Kato, H.;Hayashi,S.;Hara,M.J.Am.Chem.Soc.2008,130,12787.
(23) Pang,J.F.;Wang,A.Q.;Zhang,T.Chem.Commun.2010,46, 6935.
(24) Sun,X.;Li,Y.Angew.Chem.Int.Edit.2004,43,597.
(25) Toda,M.;Takagaki,A.;Okamura,M.;Kondo,J.N.;Hayashi, S.;Hara,M.Nature 2005,438,177.
(26)Wang,H.Y.;Zhang,C.B.;He,H.;Wang,L.Acta Phys.-Chim. Sin.2010,26(7),1873. [王华瑜,张长斌,贺 泓,王 莲.物理化学学报,2010,26(7),1873.]
(27)Zhou,W.;Yoshino,M.;Kita,H.;Okamoto,K.Ind.Eng.Chem. Res.2001,40,4801.
(28) Zhou,J.M.;Li,H.Y.;Lin,G.D.;Zhang,H.B.Acta Phys.-Chim.Sin.2010,26(11),3080. [周金梅,李海燕,林国栋,张鸿斌.物理化学学报,2010,26(11),3080.]
(29) Okamura,M.;Takagaki,A.;Toda,M.;Kondo,J.N.;Tatsumi, T.;Domen,K.;Hara,M.;Hayashi,S.Chem.Mater.2006,18, 3039.
(30) Crisci,A.J.;Tucker,M.H.;Lee,M.Y.;Jang,S.G.;Dumesic,J. A.;Scott,S.L.ACS Catal.2011,1,719.
(31) http://zh.wikipedia.org(accessed December 2011).
(32)Qi,X.H.;Watanabe,M.;Aida,T.M.;Smith,R.L.Green Chem. 2009,11,1327.
September 27,2011;Revised:December 22,2011;Published on Web:December 29,2011.
Production of 5-Hydroxymethylfurfural from Inulin Catalyzed by Sulfonated Amorphous Carbon in an Ionic Liquid
GONG Yan-Yan1LIU Min1,*JIASong-Yan1FENG Jian-Ping1SONG Chun-Shan1,2GUO Xin-Wen1,*
(1State Key Laboratory of Fine Chemicals,Department of Catalysis Chemistry and Engineering,School of Chemical Engineering, Dalian University of Technology,Dalian 116024,Liaoning Province,P.R.China;2EMS Energy Institute and Department of
Energy and Mineral Engineering,Pennsylvania State University,University Park,Pennsylvania 16802,USA)
The production of 5-hydroxylmethylfurfural(HMF)from inulin over sulfonated amorphous carbon was studied in an ionic liquid,1-butyl-3-methylimidazolium chloride([Bmim]Cl).The effects of reaction solvent,water content,reaction temperature,reaction time,and catalyst dosage on the yield of HMF were investigated.Experimental results indicated that optimum reaction conditions required a reaction temperature of 100°C,a reaction time of 60 min,an R value of 5(R represents the molar ratio of added water to fructose units in inulin),and a mass ratio of catalyst to inulin of 1:3,affording HMF in yields of up to 50%.
Inulin;5-Hydroxymethylfurfural;Sulfonated amorphous carbon;Ionic liquid;Fructose
10.3866/PKU.WHXB201112292
O643
∗Corresponding authors.LIU Min,Email:lium@dlut.edu.cn;Tel:+86-411-84986134.GUO Xin-Wen,Email:guoxw@dlut.edu.cn; Tel:+86-411-84986133.
The project was supported by the National Natural Science Foundation of China(20803005).
国家自然科学基金(20803005)资助项目
