火针对大鼠脊髓损伤后运动功能及BDNF表达的影响*
2012-11-29程素利焦召华
李 岩,程素利,周 震,焦召华,陈 爽
(1.天津市公安医院,天津 300042;2.天津中医药大学,天津 300193;3.天津中医药大学第二附属医院,天津 300150)
脊髓损伤(SCI)是一种严重的中枢神经系统损伤,因中断了通过损伤区的神经元轴突,导致损伤节段以下瘫痪、感觉缺失及自主神经障碍,在身体、心理及经济上给个人和社会造成很大负担[1]。临床上,火针对SCI后功能恢复具有一定治疗作用[2],为探讨其产生疗效的可能作用机制,本课题组就火针对实验性SCI大鼠脑源性神经营养因子(BDNF)蛋白表达及运动功能的影响进行相关研究。
1 材料和方法
1.1 实验动物分组及动物模型制备 选择健康SD大鼠60只(雌雄不拘),体质量250~300 g(由北京维通利华实验动物技术有限公司提供,许可证号:SCXK(京)2007-0001);所有大鼠均在标准条件下统一喂养。
1.1.1 动物分组 采用随机对照研究方法,按抓出顺序编号并采用随机数字表分为假手术组,模型组,火针干预组,每组又分为 1 d,3 d,5 d,7 d,4 个时相,每个时相各5只大鼠(时相的选择根据相关国内外文献确定[3])。
1.1.2 动物模型制备 急性SCI动物模型建立采用改良的Allen’s法[4]。即采用20 g/L戊巴比妥钠(40 mg/kg体质量)腹腔注射麻醉,取后正中切口,切除T9棘突、部分T10棘突和部分椎板,暴露硬膜,质量为10 g的铁锤从25 mm高处自由落下,撞击硬膜囊,撞击能量为25 mm×10 g,损伤直径为2.5 mm。与脊髓接触的撞杆底端呈弧状凹陷,直径2.5 mm,与脊髓表面相吻合。撞击成功的标志为大鼠尾巴痉挛性摆动,双下肢及身体回缩样扑动,双下肢呈弛缓性瘫痪。假手术组只做T9-T10椎板切除术。术后小心护理饲养,每天挤压排尿3次,直到反射性膀胱排空建立。
1.2 治疗方法
1.2.1 穴位选取 根据“经脉所过,主治所及”针刺原则,参照中国针灸学会实验针灸分会制定的《动物针灸穴位图谱》及《实验针灸学》选取穴位。取大鼠脊髓损伤部位上下端的棘突间隙,相当于T7、T8及T11、T12部位,各旁开0.5 cm,共4个穴,8个针刺点。
1.2.2 操作方法 火针组:选择所刺穴位,体位固定,充分消毒后,左手持酒精灯于胸前,尽量接近针刺的部位;右手拇、食指、中指微屈夹持针柄,针尖方向指向欲刺部位,置火针于酒精灯火焰的外上1/3(即外焰)处,先加热针体,再加热针尖,要求加热至通红,然后施针于患处。采用快针法,每穴仅刺1次,深度为3~5 mm。造模后即行针刺1次,之后每隔24 h针刺1次。
1.3 行为学评分 行为学评分采用BBB法[5]对各组不同时相动物进行行为功能评分。
1.4 BDNF免疫组织化学染色
1.4.1 取材 行为学评分后处死动物,采用灌注法取材,即0.01 mol/L磷酸盐缓冲液(PBS)溶液,YZ9901型恒流泵60 mL/min持续6 min,快速冲洗血管床,可见肝脏发白,为灌注正确。4%多聚甲醛溶液,YZ9901型恒流泵40 mL/min持续8 min,身体逐渐僵硬颜色变白为止。小心剪开大鼠脊柱,注意保持脊髓的完整,以脊髓损伤区为中心取出长约1 cm脊髓段,将取下的标本放入新鲜固定液(4℃)固定,备做石蜡切片。
1.4.2 免疫组化SABC法检测 二甲苯脱蜡,梯度乙醇脱水;自来水和蒸馏水各洗5 min;0.3%H2O2的甲醇溶液室温孵育10 min;蒸馏水洗5 min,0.01 mol/L PBS浸泡5 min;0.5%Triton x-100浸泡10 min,增加组织通透性;0.01 mol/L PBS 冲洗,5 min×3 次;滴加即用型复合消化酶,37℃恒温水浴20 min;0.01 mol/L PBS冲洗,5 min×3次;10%正常山羊血清封闭,真空25℃孵育10 min;滴加适量一抗工作液(1∶100 BDNF抗体)在湿盒4℃放置48 h;室温放置1 h,0.01 mol/L PBS冲洗,5 min×3次;滴加适量生物素标记二抗工作液(1∶100,山羊抗兔 IgG),真空 25℃孵育 10 min;0.01mol/LPBS冲洗,5min×3次;滴加适量的SP-HRP(1∶100),真空 25℃孵育 10 min;0.01 mol/L PBS 冲洗,5 min×3次;DAB室温显色,显微镜下控制反应时间;自来水充分冲洗;苏木素轻度复染;再经梯度乙醇和二甲苯脱水,透明;中性树脂胶封片。
1.4.3 免疫组化结果判定 以PBS代替一抗作阴性对照,胞浆内出现棕黄色颗粒为BDNF阳性。
2 统计学处理
采用SPSS18.5统计软件包进行统计学分析,计量资料以均数±标准差(±s)表示,组间比较采用单因素方差分析,P<0.05为差异有统计学意义。
3 实验结果与分析
3.1 各组大鼠BBB评分比较 手术后,模型大鼠双后肢运动功能无明显变化,仅个别动物可出现1个或2个关节的轻微运动,BBB评分均为0~1分,随后BBB评分逐渐上升。1周后,火针治疗组与模型组比较,显示出一定的差异。采用火针治疗后,可促进大鼠后肢运动功能的恢复,与模型对照组比较差异有统计学意义。各组大鼠1周内BBB评分情况比较,结果见表1。
表1 各组大鼠一周内BBB评分情况比较(±s)Tab.1 Comparison of the BBB scores of rats in each group in a week(±s)分
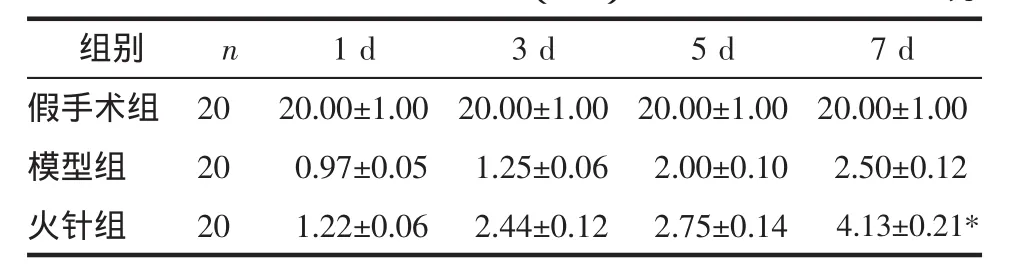
表1 各组大鼠一周内BBB评分情况比较(±s)Tab.1 Comparison of the BBB scores of rats in each group in a week(±s)分
注:与模型组比较,*P<0.05。
组别假手术组模型组火针组n 2020201 d 3 d 5 d 7 d 20.00±1.0020.00±1.0020.00±1.0020.00±1.0000.97±0.0501.25±0.0602.00±0.1002.50±0.1201.22±0.0602.44±0.1202.75±0.14004.13±0.21*
3.2 各组大鼠BDNF表达情况比较 采用光镜在×50、×100、×200、×400 等不同倍数下整体浏览切片后,×200采集图片,BDNF图像分析采用美国Media Cybernetics公司Image-Pro Plus图像分析软件测定各组标本阳性神经元细胞的个数。结果显示,假手术组各时间点BDNF均有少量表达,火针组和模型组在伤后BDNF阳性神经元数逐渐增加,3 d、5 d、7 d时相火针组与模型组相比均具有明显差异(P<0.05)。结果见表2。
表2 各实验组BDNF阳性运动神经元计数比较(±s)Tab.2 Comparison of the counts of BDNF positive motor neurons in each group(±s)分
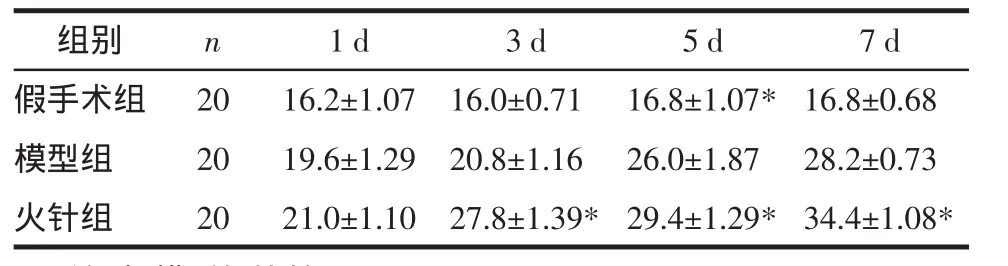
表2 各实验组BDNF阳性运动神经元计数比较(±s)Tab.2 Comparison of the counts of BDNF positive motor neurons in each group(±s)分
注:与模型组比较,*P<0.05。
组别假手术组模型组火针组n 2020201 d 3 d 5 d 7 d 16.2±1.0716.0±0.7116.8±1.07* 16.8±0.68☆19.6±1.2920.8±1.1626.0±1.87☆ 28.2±0.73☆21.0±1.1027.8±1.39* 29.4±1.29* 34.4±1.08*
3.3 BBB与BDNF相关性分析 对火针组大鼠BBB评分及BDNF阳性神经元计数进行相关性分析,相关系数r=0.991,回归方程为Y(BBB)=-3.393+0.214X(BDNF),表明两者呈高度正相关。
4 讨论
脑源性神经营养因子BDNF在中枢神经损伤后再生修复和防止神经细胞退行性变等多方面发挥着至关重要的作用[6]。本研究发现,火针能增加SCI大鼠脊髓BDNF的表达,与模型组比较差异有统计学意义(P<0.05),表明火针具有保护运动神经元,减轻变性坏死的作用;火针组的各时间点BBB评分均高于模型组,特别是在造模并干预7 d后效果更加显著(P<0.05),且与BDNF表达呈高度正相关,说明火针具有促进SCI后大鼠运动功能的恢复,其作用机制与促进BDNF表达有关。
近几年,国内外对SCI治疗的研究多集中在具有自我复制和多向分化潜能的神经干细胞(NSCs)上,外源性NSCs移植已在临床得到初步应用[7]。但外源性NSCs移植存在体内排异及伦理学的障碍,因此诱导内源性NSCs增殖并分化为神经元细胞,进而参与神经修复越来越被广泛关注[8]。但是,也有研究显示,SCI后诱导的内源性NSCs最终大多分化为星形胶质细胞,并参与了疤痕的产生,形成组织屏障,进而阻碍脊髓神经通路的重建[9]。因此如何诱导NSCs定向分化为神经元细胞是目前应用内源性NSCs治疗SCI的难点和热点。有研究已经证实,BDNF能促进NSCs增殖[10],并能诱导其分化为成熟神经元细胞,促进其突起生长[11]。同时,有学者进行了离体状态下BDNF对人脊髓NSCs增殖分化影响的研究,发现BDNF抗体封闭组神经球及神经元数目明显减少,证实了BDNF能促进NSCs增殖并向神经元分化[12]。
通过本研究发现,火针可通过促进BDNF表达,从而对SCI发挥神经保护作用。那么,在此基础上,火针是否同时具有神经修复作用呢?结果尚未可知。但大量文献已证实BDNF可促进NSCs增殖并向神经元分化,产生神经修复作用。因此,可初步推断火针可能会通过激活并增加BDNF表达,进而对NSCs产生一定的影响,但具体机制及效应如何,尚需进一步研究。
[1]Krishna Kumar Veeravalli,Venkata Ramesh Dasari,Jasti S.Rao.Regulation of proteases after spinal cord injury[J].Journal of Neurotrauma[J].2012,29:2251-2262.
[2]焦召华,李 岩,程素利,等.火针治疗脊髓损伤后排尿困难13例[A].“针灸临证经验、医案学术研讨会”论文汇编[D].天津:2012.
[3]李新枝.丙戊酸对大鼠急性脊髓损伤后BDNF及NT-3表达的影响[J].中国医药导报,2012,9(21):23-25.
[4]Khan T,Havey RM,Sayers ST,et al.Animal models of spinal cord contusion injuries[J].Lab Anim Sic,1999,49(2):161-172.
[5]Bethea JR,Castro M,Keane RW,et al.Traumatic spinal cord injury induces nuclear factor-kb activation[J].J Neurosci,1998,18(9):3251-3260.
[6]Gage FH.Mammalian neural stem cells[J].Science,2000,287(5457):1433.
[7]Zhang N,Wimmer J,Qian SJ,et al.Stem cells:Current approach and future prospects in spinal cord injury repair[J].Anat Rec(Hoboken),2010,293(3):519-530.
[8]Can Q,Benton RL,Whittemore SR.Stem cell repair of central nervous system injury[J].J Neurosei Res,2002,68(5):501-5l0.
[9]Johansson CB,Momma S,Clarke DL,et al.Identification of a neural stem cell in the adult mammalian central nervous system[J].Cell,1999,96:25-34.
[10]Crigler L,Robey RC,Asawachaicharn A,et al.Human mesenchymal stem cell subpopulations express a variety of neuro-regulatory molecules and promote neuronal cell survival and neuritogenesis[J].Exp Neurol,2006,198(1):54-64.
[11]Ahmed S,Reynolds BA,Weiss S.BDNF enhances the differentiation but not the survival of CNS stem cell derived neuronal precursors[J].Neurosci,1995,15(8):5765-5778.
[12]贺永胜,郭小兵,邓世康,等.人胚胎脊髓神经干细胞生长及分化过程中 BDNF 的作用研究[J].医学综述,2011,20(17):3163-3165.
