HPLC法同时测定七叶灵颗粒中特女贞苷与柚皮苷的含量Δ
2012-11-29顾嘉钦朱珺上海交通大学附属胸科医院药剂科上海200030
顾嘉钦,朱珺(上海交通大学附属胸科医院药剂科,上海200030)
HPLC法同时测定七叶灵颗粒中特女贞苷与柚皮苷的含量Δ
顾嘉钦*,朱珺#(上海交通大学附属胸科医院药剂科,上海200030)
目的:建立同时测定七叶灵颗粒中特女贞苷与柚皮苷含量的方法。方法:采用高效液相色谱法。色谱柱为Kromasil C18(250mm×4.6mm,5μm),流动相为乙腈-4%冰醋酸(17∶83,V/V),检测波长为224nm,流速为1mL·min-1,柱温为30℃。结果:特女贞苷与柚皮苷的进样量分别在0.04~1.00、0.08~2.00μg范围内与各自峰面积积分值呈良好的线性关系(r均为0.9999);平均加样回收率分别为101.17%和100.32%,RSD分别为2.10%和2.17%(n均为6)。结论:本方法简便、准确、重复性好,可用于七叶灵颗粒中特女贞苷与柚皮苷的含量测定。
高效液相色谱法;七叶灵颗粒;特女贞苷;柚皮苷;含量测定
肺癌是近50年增长最快的恶性肿瘤之一,居我国癌症发病率、死亡率之首[1]。七叶灵颗粒是我院自行研制的复方中药制剂,由生黄芪、黄精、女贞子、天花粉、灵芝、石见穿、七叶一枝花、山慈菇、骨碎补、陈皮10味药材组成。该药是我院根据中医扶正祛邪、调节阴阳平衡理论,总结30多年临床肿瘤治疗经验,在中医辩证论治基础上自行研制的抗肿瘤药物,也是目前为数不多的治疗肺癌的特色医院制剂。经多年来的实验研究和临床应用证实,七叶灵颗粒不仅有抑瘤作用,同时还能减轻化疗副作用,增加肿瘤细胞凋亡数,升高白细胞,提高晚期肺癌患者的生存率、近期疗效及生存质量,并延长其中位生存期[2~4]。中药制剂现代化的关键在于质量控制和质量标准现代化[5],因此笔者采用高效液相色谱(HPLC)法同时测定七叶灵颗粒中有效成分特女贞苷与柚皮苷的含量,为七叶灵颗粒提供一种质量控制方法。
1 仪器与试药
LC-10Ai系列HPLC仪,配有SPD-20A紫外检测器、SIL-10Ai自动进样器、CTO-20AC柱温箱、CBM-20A系统控制器(日本岛津公司)。
特女贞苷(纯度:92.1%)、柚皮苷对照品(中国食品药品检定研究院,批号分别为111926-201102、110722-200610);七叶灵颗粒(上海交通大学附属胸科医院研制,上海市蔡同德堂中药制药厂代加工,批号:20100901、20110101、20110701、20111101);甲醇、乙腈均为色谱纯。
2 方法与结果
2.1 色谱条件与系统适用性试验
色谱柱:Kromasil C18(250mm×4.6mm,5μm);流动相:乙腈-4%冰醋酸(17∶83,V/V);检测波长:224nm;流速:1mL·min-1;柱温:30℃;进样量:20μL。理论板数按特女贞苷峰计算应不小于4000。在该色谱条件下,特女贞苷峰与柚皮苷峰分离良好,且与其他杂质峰也分离良好。
2.2 对照品溶液的制备
取特女贞苷对照品14.1mg(含量测定以92.1%计),精密称定,置于50mL量瓶中,加甲醇至刻度,制成0.2597mg·mL-1的特女贞苷对照品溶液。于2~8℃低温保存,备用。
取柚皮苷对照品8.1mg,精密称定,置于10mL量瓶中,加甲醇至刻度,制成0.81mg·mL-1的柚皮苷对照品溶液。于2~8℃低温保存,备用。
2.3 供试品溶液的制备
取七叶灵颗粒10g,精密称定,置具塞锥形瓶中,精密加入50%乙醇50mL,称重,加热回流1h,放冷,再称重,用50%乙醇补足失重,摇匀,滤过,取续滤液,即得。
2.4 阴性对照溶液的制备
按处方配比取各味药(缺女贞子、骨碎补、陈皮),根据七叶灵颗粒制备工艺制成阴性样品,再按“2.3”项下方法制备阴性对照溶液。
2.5 方法学考察
2.5.1 标准曲线的制备 取“2.2”项下2种对照品溶液,分别用甲醇稀释制成浓度为20μg·mL-1的特女贞苷对照品溶液和40μg·mL-1的柚皮苷对照品溶液,分别吸取2、5、10、20、30、50μL进样,测定峰面积。以浓度(X)为横坐标,峰面积积分值(Y)为纵坐标,绘制标准曲线,得特女贞苷、柚皮苷的回归方程分别 为 Y=2.65×104X+842(r=0.9999,n=6)、Y=7.16×104X+8497(r=0.9999,n=6)。结果表明,特女贞苷、柚皮苷的进样量分别在0.04~1.00、0.08~2.00μg范围内与各自峰面积积分值呈良好线性关系。
2.5.2 精密度试验 精密吸取浓度为20μg·mL-1的特女贞苷对照品溶液和40μg·mL-1的柚皮苷对照品溶液各20μL,在上述色谱条件下连续进样5次,测定峰面积。结果,特女贞苷和柚皮苷峰面积的RSD分别为2.28%和1.97%(n均为5),表明仪器精密度良好。
2.5.3 特女贞苷峰与柚皮苷峰的鉴别试验 经多次调整流动相种类和配比,在流动相为乙腈-4%冰醋酸(17∶83,V/V)时,七叶灵颗粒样品中特女贞苷峰与柚皮苷峰分离良好,通过液相色谱-质谱(LC-MS)检测可证明该峰为特女贞苷峰与柚皮苷峰,详见图1、图2。
2.5.4 空白干扰试验 分别取对照品溶液、供试品溶液、阴性对照溶液各20μL,在上述色谱条件下进样测定。结果发现,特女贞苷峰与柚皮苷峰处阴性对照无干扰。色谱见图3。
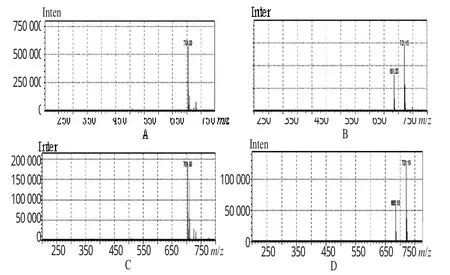
图1 特女贞苷的MS图A.ESI(+)模式下的特女贞苷对照品(m/z 686.6,35.1min峰);B.ESI(-)模式下的特女贞苷对照品(m/z 686.6,35.1min峰);C.ESI(+)模式下的供试品(35.2min峰);D.ES(I-)模式下的供试品(35.2min峰)Fig 1MS chromatograms of specnuezhenideA.specnuezhenide control under ESI(+)mode(m/z 686.6,35.1min);B.specnuezhenide control under ESI(-)mode(m/z 686.6,35.1min);C.test sample under ESI(+)mode(35.2min);D.test sample under ESI(-)mode(35.2min)

图2 柚皮苷的MS图A.ESI(+)模式下的柚皮苷对照品;B.ESI(-)模式下的柚皮苷对照品;C.ESI(+)模式下的供试品(40.53min峰);D.ESI(-)模式下的供试品(40.53min峰)Fig 2MS chromatograms of naringinA.naringin control under ESI(+)mode;B.naringin control under ESI(-)mode;C.test sample under ESI(+)mode(40.53min);D.test sample under ESI(-)mode(40.53min)
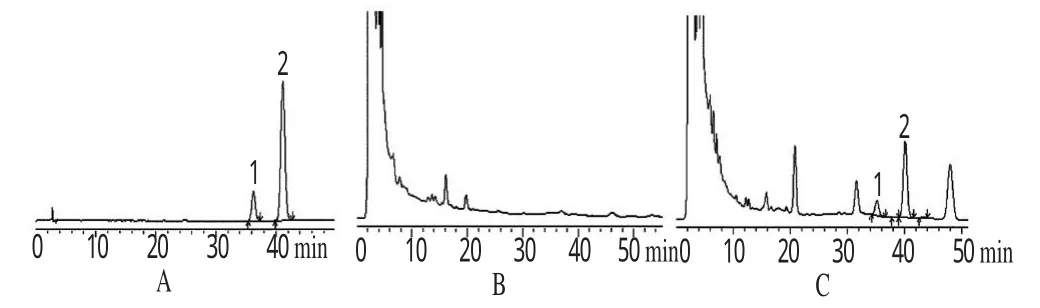
图3 高效液相色谱图A.混合对照品;B.阴性对照;C.供试品;1.特女贞苷;2.柚皮苷Fig 3 HPLC chromatogramsA.mixed control;B.negative control;C.test sample;1.specnuezhenide;2.naringin
2.5.5 稳定性试验 取同一供试品溶液20μL,分别于0、1、2、3、4、5d时进样,测定峰面积。结果,特女贞苷和柚皮苷峰面积的RSD分别为3.01%和2.14%(n均为6),表明供试品溶液在5d内稳定性良好。
2.5.6 重复性试验 取同一批七叶灵颗粒,按“2.3”项下方法平行制备6份供试品溶液,在上述色谱条件下进样20μL,测定样品含量。结果,样品中特女贞苷的含量为(85.36±3.73)μg·g-1,RSD=4.37%(n=6);柚皮苷的含量为(159.67±27.42)μg·g-1,RSD=1.72%(n=6),表明本方法重复性良好。
2.5.7 加样回收率试验 取已知含量的同一批(批号:20111101)样品6份,每份5g,精密称定,分别加入特女贞苷对照品约0.5mg和柚皮苷对照品约1mg,按“2.3”项下方法制备供试品溶液,各取20μL进样,在上述色谱条件下测定峰面积,计算加样回收率,结果分别见表1和表2。
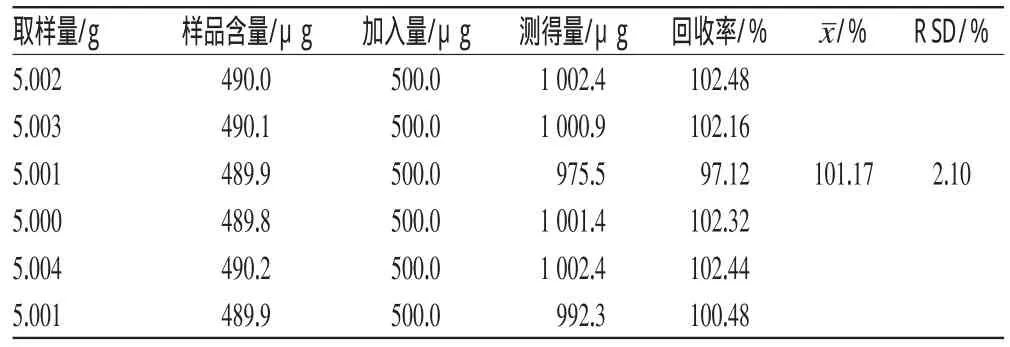
表1 特女贞苷的加样回收率试验结果(n=6)Tab 1Results of recovery test of specnuezhenide(n=6)
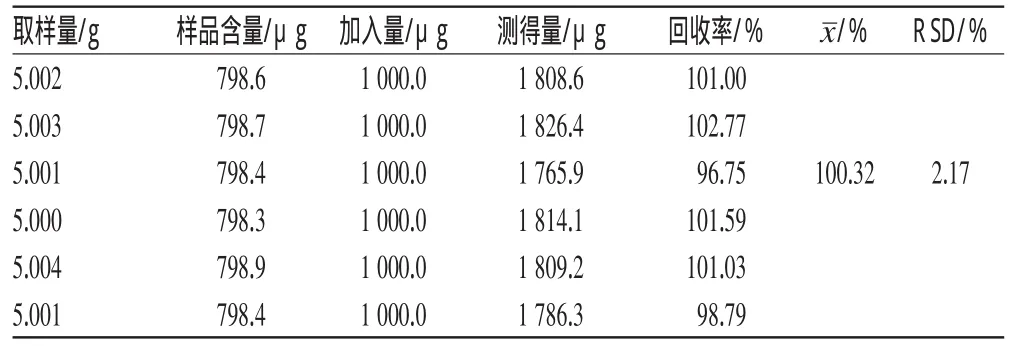
表2 柚皮苷的加样回收率试验结果(n=6)Tab 2Results of recovery test of naringin(n=6)
2.6 样品含量测定
取4批样品,分别按“2.3”项下方法制备供试品溶液,再按上述方法操作,取20μL进样测定,计算样品中特女贞苷和柚皮苷的含量,结果见表3。
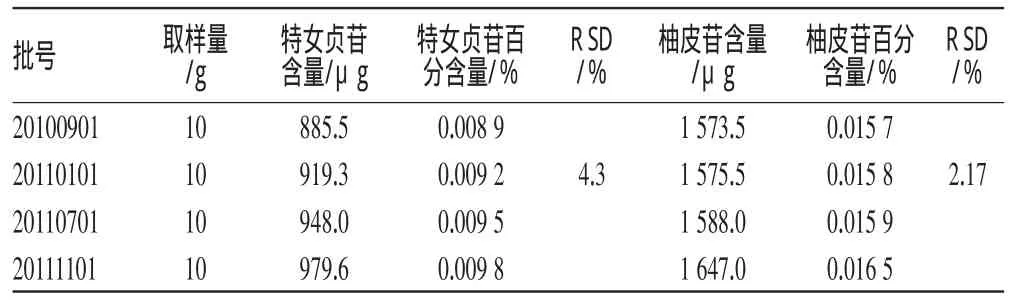
表3 样品含量测定结果(n=4)Tab 3Results of content determination of samples(n=4)
从4批样品含量测定结果来看,七叶灵颗粒含特女贞苷与柚皮苷量稳定,可应用于质量标准。
3 讨论
女贞子是一味常用的扶正固本药,具有抗炎抑菌、升高白细胞、促进免疫等作用[6],《中国药典》[7]中其主要检测成分为特女贞苷,且专属性强。骨碎补也是一味常用中药,现代药理及临床研究表明,骨碎补具有良好的促进骨折愈合、抗骨质疏松、抗炎、促进牙齿生长、防治中毒性耳聋、降血脂等活性[8],《中国药典》[7]中其主要检测成分为柚皮苷;文献报道陈皮中也含有柚皮苷[9],因此在空白试验中去除了这3味药材。
由于七叶灵颗粒由10味药材组成,成分复杂,为能同时检测特女贞苷与柚皮苷,笔者参考了《中国药典》[7]及文献[10]方法,以甲醇-水作为展开剂,特女贞苷出峰好,但柚皮苷出峰不尖锐;通过不断探索和调整,使用乙腈-4%冰醋酸(17∶83,V/V)为展开剂,可避开前后杂质干扰,且特女贞苷与柚皮苷出峰尖锐、分离度好、理论板数高。由于前后均有杂质峰,因此梯度洗脱受到限制,故未采用梯度洗脱方法,而是通过空白对照试验和借助LC-MS鉴别出特女贞苷峰与柚皮苷峰。
七叶灵颗粒制作工艺采用的是水提法,因此为避免损失,在参考《中国药典》[7]及文献[10]方法的基础上,本试验对比了超声法与回流法的提取效果,结果相同时间内特女贞苷的提取回收率回流法大于超声法,因此采用回流法提取。试验还对乙醇和甲醇进行了回流对比试验,发现乙醇回流较甲醇回流的特女贞苷提取回收率更高,柚皮苷则差异不大,因此选择乙醇回流法。通过不同浓度乙醇回流试验,发现低浓度乙醇(30%)较高浓度乙醇(70%)回流的特女贞苷提取回收率高,而柚皮苷基本相同,但低浓度乙醇回流杂质多,且不宜滤过,故最终确定采用50%乙醇进行回流试验。本试验还比较了不同时间回流对结果的影响,发现回流1、2、4h的结果差异不大,这可能与颗粒剂原本就是水提物质与糊精,回流1h足以将特女贞苷与柚皮苷溶于溶媒内有关,因此选择使用50%乙醇回流1h的提取方法,该方法操作简单、结果稳定。
[1] 罗荣城,韩焕兴.肿瘤综合治疗新进展[M].北京:人民军医出版社,2003:295.
[2] 崔 清,金长娟.“七叶灵”颗粒抑制H460细胞生长和转移作用靶点的实验研究[J].中国中医药现代远程教育,2009,76(8):157.
[3] 金长娟,沙慧芳,赵兰香,等.七叶灵方诱导裸鼠人肺腺癌A549移植瘤细胞凋亡的实验研究[J].中西医结合学报,2004,2(4):285.
[4] 崔 清,王少墨,郭毅峻,等.“七叶灵”颗粒配合化疗治疗晚期肺癌临床研究[J].上海中医药杂志,2007,41(3):14.
[5] 文世伟,黄跃洲,许 静.试论中药制剂现代化的关键问题及策略[J].中国药房,2008,19(27):2157.
[6] 秦红霖,高 月.女贞子化学成分及药理研究进展[J].中药新药与临床药理,2007,18(1):84.
[7] 国家药典委员会.中华人民共和国药典(一部)[S].2010年版.北京:中国医药科技出版社,2010:43、239.
[8] 刘玲玲,曲 玮,梁敬钰.骨碎补化学成分和药理作用研究进展[J].海峡药学,2012,24(1):4.
[9] 李庆耀,梁生林.陈皮的药用研究进展[J].中成药,2008,30(2):246.
[10] 王卫清,黄 海,洪松彬.高效液相色谱法测定女贞子中特女贞苷含量的实验研究[J].健康必读,2011,7:356.
Content Determination of Specnuezhenide and Naringin in Qiyelin Granules by HPLC
GU Jia-qin,ZHU Jun(Dept.of Pharmacy,Shanghai Chest Hospital,Shanghai Jiaotong University,Shanghai 200030,China)
OBJECTIVE:To establish the method for the content determination of specnuezhenide and naringin in Qiyelin granules.METHODS:HPLC method was adopted.The determination was performed on Kromasil C18(250mm×4.6mm,5μm)column with mobile phase consisted of acetonitrile-4%acetic acid(17∶83,V/V)at flow rate of 1mL·min-1.The detection wavelength was 224nm,and the column temperature was 30℃.RESULTS:The linear range was 0.04~1.00μg for specnuezhenide(r=0.9999)and 0.08~2.00μg for naringin(r=0.9999)with average recovery of 101.17%(RSD=2.10%,n=7)and 100.32%(RSD=2.17%,n=6),respectively.CONCLUSION:The method is simple,accurate and reproducible.It can be used for the content determination of specnuezhenide and naringin in Qiyelin granules.
HPLC;Qiyelin granules;Specnuezhenide;Naringin;Content determination
R283.625;R927.2
A
1001-0408(2012)43-4086-03
DOI10.6039/j.issn.1001-0408.2012.43.21
2012-07-17
2012-09-10)
