普罗布考联合阿托伐他汀对急性冠脉综合征血脂蛋白相关磷脂酶A2的影响*
2012-11-28杨丽刘寅刘婷陈倩
杨 丽 刘 寅 刘 婷 陈 倩
动脉粥样硬化(AS)是一种炎性反应性疾病,多种炎症介质可能是冠心病新的危险因素。研究表明脂蛋白相关磷脂酶A2(Lp-PLA2)作为一种新的炎性反应介质具有促进冠状动脉粥样硬化的作用[1]。它能通过水解低密度脂蛋白(LDL)上的氧化卵磷脂而刺激细胞因子的产生,导致急性冠脉综合征(ACS)的发生。普罗布考作为降脂药物的同时具有抗氧化、抗炎、抗动脉粥样硬化、改善内皮功能等作用。本研究旨在对比阿托伐他汀联合普罗布考与单用阿托伐他汀对于ACS患者治疗前后血Lp-PLA2变化的影响,并且探讨抗AS的机制。
1 对象与方法
1.1 研究对象 选取2010年5月—9月因ACS于本院就诊并经冠状动脉造影(CAG)检查证实冠脉左主干、左前降支、左回旋支、右冠状动脉中至少1支血管狭窄程度≥50%的患者94例,根据病情及冠脉病变需要,部分患者行经皮冠状动脉介入治疗(PCI)。随机分为2组,单药组48例,男33例,女15例,年龄47~76岁,平均(60.94±9.54)岁,其中急性心肌梗死5例,不稳定心绞痛43例,有42例行PCI治疗;联合组46例,男34例,女12例,年龄41~77岁,平均 (57.87±10.36)岁,其中急性心肌梗死8例,不稳定心绞痛38例,有36例行PCI治疗。所有患者均接受心电图、胸部X线片、超声心动图、肝肾功能等检查,排除心脏瓣膜病、心肌病、恶性肿瘤、急慢性感染性疾病、严重肝肾功能不全及近期曾服用维生素C或维生素E等具有抗氧化作用的药物者。2组患者均于行CAG前及治疗后6~8周测定血浆Lp-PLA2、总胆固醇(TC)、三酰甘油(TG)、低密度脂蛋白胆固醇(LDL-C)、高密度脂蛋白胆固醇(HDL-C)。2组年龄(t=0.306)、性别(χ2=1.495)及一般临床资料比较差异均无统计学意义(P>0.05),见表1。
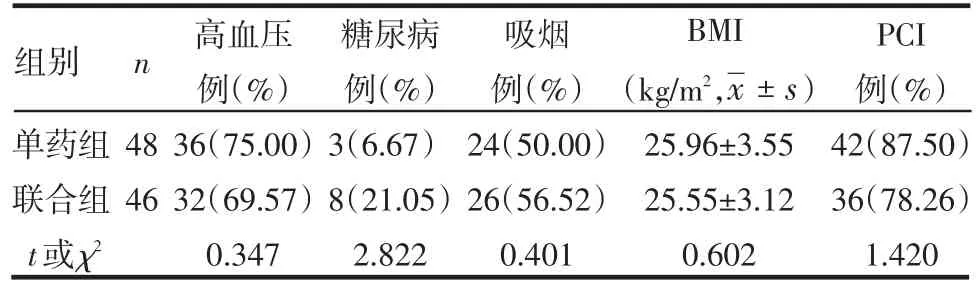
Table 1 Comparison of clinical data between two groups表1 2组一般临床资料比较
1.2 方法 在常规予以肠溶阿司匹林、氯吡格雷、硝酸酯类、血管紧张素转换酶抑制剂/血管紧张素受体拮抗剂及β受体阻滞剂等治疗基础上,单药组常规予以阿托伐他汀20 mg,1次/晚,联合组在单药组基础上加用普罗布考250 mg,2次/d。所有入选患者均于CAG前及治疗后6~8周清晨空腹取静脉血2 mL,置于EDTA抗凝管内,-4℃冷藏,24 h内以3 000 r/min离心10 min后取上层血浆置于-80℃冰冻保存。采用酶联免疫吸附法测定标本Lp-PLA2含量,Lp-PLA2检测试剂盒购自中美合资天津康尔克生物科技有限公司。
1.3 统计学处理 采用SPSS 13.0软件进行统计学处理。计量资料用±s表示,组间及组内比较采用t检验,计数资料以例(%)表示,采用χ2检验,P<0.05为差异有统计学意义。
2 结果
2.1 2组治疗前后血脂变化 治疗前2组TC、TG、LDL-C、HDL-C比较差异无统计学意义(P>0.05);治疗后2组TC、TG、LDL-C较治疗前均有所下降,单药组治疗后HDL-C较治疗前升高,联合组治疗后HDL-C较治疗前下降,差异有统计学意义(P<0.01)。联合组TC、LDL-C及HDL-C治疗后均低于单药组(P<0.O5),2组治疗后TG比较差异无统计学意义(P>0.05),见表2。
Table 2 Changes of blood lipids before and after treatment in two groups表2 2组治疗前后血脂变化 (mmol/L,±s)
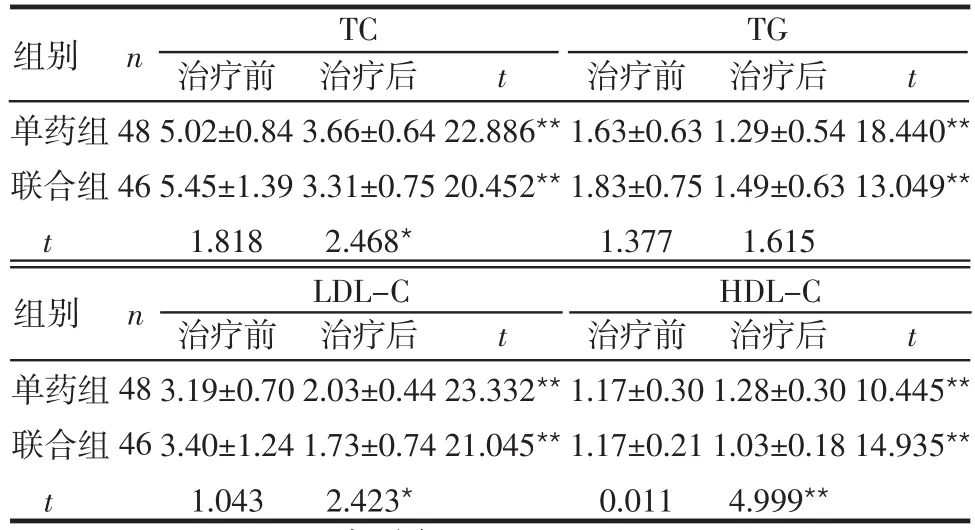
Table 2 Changes of blood lipids before and after treatment in two groups表2 2组治疗前后血脂变化 (mmol/L,±s)
*P<0.05,**P<0.01;表3同
组别 n TC TG t治疗后3.66±0.64 3.31±0.75 2.468*48 46单药组联合组t治疗前5.02±0.84 5.45±1.39 1.818 t 22.886**20.452**治疗前1.63±0.63 1.83±0.75 1.377治疗后1.29±0.54 1.49±0.63 1.615 18.440**13.049**组别 n LDL-C HDL-C t治疗后2.03±0.44 1.73±0.74 2.423*48 46单药组联合组t治疗前3.19±0.70 3.40±1.24 1.043 t 23.332**21.045**治疗前1.17±0.30 1.17±0.21 0.011治疗后1.28±0.30 1.03±0.18 4.999**10.445**14.935**
2.2 2组治疗前后Lp-PLA2水平比较 2组治疗前Lp-PLA2水平比较差异无统计学意义(P>0.05)。2组治疗后Lp-PLA2水平较治疗前均下降;治疗后Lp-PLA2水平联合组低于单药组,差异均有统计学意义(P<0.01),见表3。
Table 3 Comparison of Lp-PLA2 levels before and after treatment in two groups表3 2组治疗前后Lp-PLA2水平比较 (mg/L,±s)
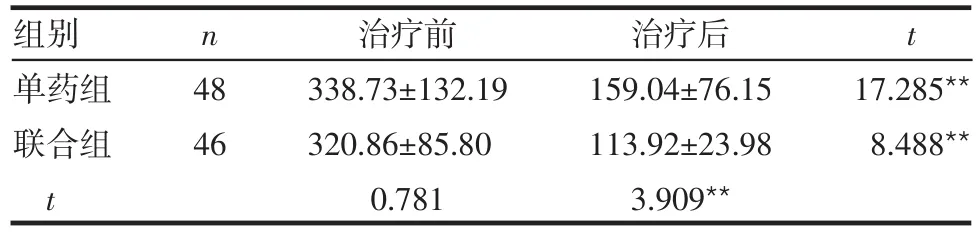
Table 3 Comparison of Lp-PLA2 levels before and after treatment in two groups表3 2组治疗前后Lp-PLA2水平比较 (mg/L,±s)
组别单药组联合组t n t 48 46治疗前338.73±132.19 320.86±85.80 0.781治疗后159.04±76.15 113.92±23.98 3.909**17.285**8.488**
3 讨论
ACS的病理机制主要是冠脉动脉粥样硬化斑块不稳定。有研究表明,氧化和炎症是导致急性冠脉综合征发病的重要机制[2]。Lp-PLA2作为与ACS发生有关的炎症因子之一,是近年来研究的热点。Lp-PLA2是由441个氨基酸残基组成的一种丝氨酸脂酶,相对分子质量45.4,是非钙依赖的磷脂酶,主要由成熟的巨噬细胞和淋巴细胞合成和分泌,并受炎性介质的调节[3]。人循环中的Lp-PLA2以与脂蛋白颗粒结合的形式存在,其中2/3与LDL结合,1/3与HDL、VLDL结合[4]。Lp-PLA2能水解动脉内膜上的LDL上的氧化卵磷脂,生成溶血磷脂酰胆碱(1ysoPC)和氧化脂肪酸(OX-FFA),LysoPC作为一种单核细胞趋化因子,促进单核细胞由管腔向内膜聚集衍生为巨噬细胞,巨噬细胞吞噬氧化(ox)-LDL变成泡沫细胞,促进基质金属蛋白酶(MMP)、白细胞介素等炎症介质的产生及平滑肌细胞增殖,导致斑块不稳定,增加斑块破裂和血栓形成的危险[5],从而造成心血管事件的发生。Li等[6]研究显示,发生心血管事件的患者血Lp-PLA2水平明显高于未发生心血管事件的患者。
他汀类药物作为胆固醇合成过程中限速酶的抑制剂,除具有调脂作用外,还具有改善内皮功能、稳定斑块、抑制炎症细胞浸润、减少炎症递质释放、抑制血小板聚集和血栓形成等多方面非调脂作用。有研究显示,大剂量的阿托伐他汀可显著降低Lp-PLA2水平[7]。本研究结果显示,2组ACS患者经阿托伐他汀治疗后TC、LDL-C及Lp-PLA2水平较治疗前均显著下降,单药组HDL-C较治疗前升高,提示阿托伐他汀具有抗炎、稳定斑块的作用。
普罗布考最初是作为一种降脂药物应用于临床,它可显著降低血浆TC和LDL-C,还能促进胆固醇逆转运,使泡沫、细胞内的脂质外流,从而维持细胞胆固醇动态平衡。近年研究显示,普罗布考的抗动脉粥样硬化作用是源于其抗氧化性能,它分子内所含的酚羟基很容易被氧化而发生断链,捕捉氧离子并与之结合后形成稳定的酚氧基,有效降低血浆氧自由基浓度,抑制(ox)-LDL形成,抑制过氧化脂质形成,从而能有效抑制巨噬细胞Lp-PLA2、MMP等分泌及其活性,这是其稳定斑块的重要机制之一[8]。本研究对ACS患者在常规治疗的基础上加用普罗布考,结果显示,联合组较单药组除TC、LDL-C等血脂指标下降更为明显外,Lp-PLA2水平降低也更为显著,考虑原因为血液中Lp-PLA2主要与LDL-C结合,Lp-PLA2水平因LDL-C的下降而下降,另外Lp-PLA2水平的进一步降低还可能因为普罗布考抑制巨噬细胞分泌Lp-PLA2所致。这进一步证实了普罗布考的抗炎作用,提示他汀类药物联合普罗布考治疗能进一步抑制炎症反应、稳定斑块。与单用阿托伐他汀相比,联合组治疗后HDL-C明显下降,提示普罗布考降低HDL-C的作用不能被阿托伐他汀所抵消。动物实验显示普罗布考显著增加肝脏中HDL-C的主要受体B族I型清道夫受体的表达,促进HDL-C被肝细胞摄取并清除代谢的过程[9],并能通过显著增加胆固醇酯转移蛋白和载脂蛋白E的血浆浓度和活性,从而增强胆固醇的逆转运[10]。
综上所述,与单用他汀类药物治疗相比,普罗布考联合阿托伐他汀更能显著降低ACS患者炎症标志物Lp-PLA2水平,并通过降脂、抗炎、抗氧化等多方面协同作用而达到抗动脉粥样硬化、稳定斑块,改善ACS预后,为冠心病及动脉粥样硬化的治疗和预防开辟了新的有效途径。
[1]Bfilakis ES,Khera A,Saeed B,et al.Association of lipoprotein-associated phospholipase A2 mass and activity with coronary and aortic atheroselerosis:findings from the Dallas Heart Study[J].Clin Chem,2008,54(12):l975-1981.
[2]Naghavi M,Libby P,Falk E,et al.From vulnerable plaque to vulnerable patient:A call for new definition and risk assessment strategies:part I and partⅡ[J].Circulation,2003,108(14,15):1664-1778.
[3]Stafforini DM.Biology of platelet-activating factor acetylhydrolace(PAF-AH,lipoprotein associated phospholipase A2)[J].Cardiovasc Drugs Ther,2009,23(1):73-83.
[4]Zalewski A,Macphee C.Role of lipoprotein-associated phospholipase A2 in atherosclerosis:biology.epidemiology,and possible therapeutic target[J].Arterioscler Thromb Vasc Biol,2005,25(5):923-931.
[5]Kolodgie FD,Burke AP,Skorija KS,et al.Lipoprotein-associated phospholipase A2 protein expression in the natural progression of human coronary atherosclerosis[J].Arterioseler Thromb Vase Biol,2006,26(11):2523-2529.
[6]Li N,Li S,Yu C,et al.Plasma Lp-PLA2 in acute coronary syndrome:association with major adverse cardiac events in a community-based cohort[J].Postgrad Med,2010,122(4):200-205.
[7]O’Donoghue M,Morrow DA,Sabatine MS,et al.Lipoprotein-associated phospholipase A2 and its association with cardiovascular outcomes in patients with acute coronary syndromes in the PROVE IT-TIMI 22(PRavastatin Or atorVastatin Evaluation and Infection Therapy-Thrombolysis In Myocardial Infarction)trial[J].Circulation,2006,113(14):1745-1752.
[8]Iqbal M,Sharma SD,Okara S.Prohucol as a potent inhibitor of oxygen radical-induced lipid peroxidation and DNA damage:in vitro studies[J].Redox Rep,2004,9(3):167-172.
[9]Hong SC,Zhao SP,Wu ZH.Effect of probucol on HDL metabolism and class B type I scavenger receptor(SR-BI)expression in the liver of hypercholesterolemic rabbits[J].Int J Cardiol,2007,115(1):29-35.
[10]Umeji K,Umemoto S,Itph S,et al.Comparative effects of pitavastatin and probucol on oxidative stress,Cu/Zn superoxide dismutase,PPAR-gamma,and aortic stiffness in hypercholesterolemia[J].Am J Physiol Heart Circ Physiol,2006,291(5):H2522-2532.
