血小板微颗粒对人脐静脉内皮细胞VEGF表达的影响*
2012-11-28李曦铭贾红丹张迎怡毛用敏崔让庄丛洪良
解 畅 李曦铭 贾红丹 张迎怡 毛用敏 崔让庄 丛洪良
血小板微颗粒(platelet microparticles,PMPs)是血小板活化后脱落的一种膜颗粒,也是血小板活化的标志之一。以往的研究显示PMPs参与以血管和血管发生为基础的生物学过程,促进内皮细胞、平滑肌细胞等的增殖,抑制其凋亡,促进内皮细胞的迁移和生长,对于新生血管的形成有重要作用[1]。然而对PMPs诱导血管发生及内皮细胞增殖的机制研究甚少,对PMPs与内皮细胞作用的形式及下游转导途径阐述多属间接。本实验应用流式细胞术从富含血小板的血浆中提取高纯度的PMPs,研究不同浓度PMPs及其与细胞作用不同时间对内皮细胞表达血管内皮生长因子(vascular endothelial growth factor,VEGF)、其Ⅱ型受体KDR及其下游转导通路重要酶的差异,探讨PMPs影响内皮细胞VEGF表达及新生血管形成的可能机制。
1 材料与方法
1.1 仪器与材料 人脐静脉内皮细胞系由天津市心血管病学研究所提供。流式细胞仪(BD FACS Calibur)及CD61a-FITC抗体购自美国BD公司;直径1 μm的标准微球购自Sigma公司。UNIQ-10柱总RNA抽提试剂盒及实验所需引物购自上海生工生物工程技术服务有限公司。将人脐静脉内皮细胞(human umbilical vein endothelial cells,HUVECs)复苏,在37℃、5%CO2的条件下常规培养,实验采用3~4代细胞;按1×105/mL密度接种于9.6 cm2的6孔板中,生长接近100%时,进行PMPs的干预。提取PMPs的枸橼酸钠抗凝静脉血均来源于天津市胸科医院检验科,征得所有患者同意并签署知情同意书。
1.2 PMPs的提取 枸橼酸钠抗凝静脉血,800 r/min离心10 min,去除血细胞,上清为富血小板血浆(platelet-rich plasma,PRP)。3 000 r/min 离心5 min,弃上清,沉淀为血小板,每管中加入0.5 mL磷酸盐缓冲液(phosphate buffered saline,PBS)、5 μL100 mmol/L Ca2+、200 mmol/L Mg2+悬浮混匀血小板。在不同血小板悬浊液中分别加入不同浓度的凝血酶和二磷酸腺苷(adenosine diphosphate,ADP),通过预实验,本实验最终选用10 μmol/L ADP为激活剂,激活血小板,应用流式细胞仪检测,比较血小板释放PMPs数量,另设一管为对照管,不加入激活剂。共同37℃水浴20 min。4 600 r/min离心30 min,去除血小板凝聚物。将其上清液13 000 r/min离心60 min,得到去除血小板后纯化的PMPs沉淀,用0.5 mL1×Tyrode’s Buffer悬浮。所得悬浊液中均加入20 μL CD61a-FITC抗体(为异硫氰酸荧光素标记的整合素b3型抗体,结合位点位于GPⅢα,购自Becton Drive公司),避光20 min上流式细胞仪检测,并据此设定流式细胞仪检测PMPs的各项参数及设门。
1.3 不同浓度PMPs干预内皮细胞CRL-1730 按参考文献[1]方法配制PMPs不同干预浓度。选用DMEM/F12(购自GIBCO公司)完全培养基,内含10%胎牛血清(fetal bovine serum,FBS),100 U/mL青霉素+100 mg/L链霉素,在95%空气和5%CO2混合气体中常规培养。后以每孔CRL-1730细胞量为1×106分入9.6 cm2的6孔板中,24 h后换液,生长接近100%时,即内皮细胞约数为2.5×106时进行PMPs的干预。选取0、10、30、50、100 mg/L 5种不同干预浓度的PMPs作用于HUVECs,每个浓度4孔细胞样本。将配制好的不同干预浓度的PMPs悬浊液每孔1 mL加入内皮细胞中。放入37℃5%CO2培养箱中孵育4 h。4 h后以0.5 mL PBS洗涤细胞,吸去PBS,加入0.5 mL 0.05%胰酶,37℃5%CO2培养箱保温4~5 min,吹打细胞,转移至离心管中,10 000 r/min离心3 min,弃上清,1 mL PBS洗细胞2次(每次离心10 000 r/min,3 min),离心获得干预后的内皮细胞,-80℃冻存。
1.4 不同时间PMPs作用内皮细胞CRL-1730 PMPs浓度采取50 mg/L,每一作用时间共4孔细胞样本,放入37℃CO2培养箱中分别孵育0、2、4、24 h。分别收集不同作用时间的细胞,步骤方法同前。
1.5 RT-PCR检测 应用UNIQ-10柱总RNA抽提试剂盒提取上述制备好的冻存的HUVECs中总RNA,逆转录得到cDNA。VEGF、其受体KDR及其下游传导通路中重要酶磷脂酰肌醇-3激酶(phosphatidylinositol-3 kinase,PI3K)以及胞外信号调节激酶(extracellular signal-regulated kinase,ERK)4种目的基因引物,见表1。PCR扩增其产物,观察内皮细胞中4种因子mRNA的表达情况。琼脂糖凝胶平板电泳法检测PCR扩增产物,使用GEL-PRO凝胶成像分析系统对凝胶进行扫描,测量目的基因与内参基因扩增条带的灰度值及比值。

Table 1 Gene primer design and length表1 目的基因引物设计及长度
1.6 统计学方法 采用SPSS 17.0统计软件进行数据处理,计量数据以均数±标准差表示(±s)表示,多组均数之间比较采用单因素方差分析,两两比较采用LSD-t检验,以P<0.05为差异有统计学意义。
2 结果
2.1 不同浓度PMPs干预对CRL-1730 VEGF121、KDR、ERK、PI3K mRNA表达的影响 与0 mg/L组比较,不同干预浓度的PMPs均可显著抑制内皮细胞VEGF121mRNA的表达(均P<0.05),增加内皮细胞KDR mRNA的表达(均P<0.05),ERK mRNA表达水平在PMPs 50 mg/L组显著高于0 mg/L组(P=0.004),PI3K mRNA表达水平在PMPs100 mg/L组显著高于0 mg/L组(P=0.004),见表2、图1。
Table 2 Comparison of VEGF121,KDR,ERK and PI3K mRNA expression in endothelial cells intervened with different concentrations of PMPs表2 不同浓度PMPs对内皮细胞VEGF121、KDR、ERK及PI3K mRNA表达影响的比较 (±s)
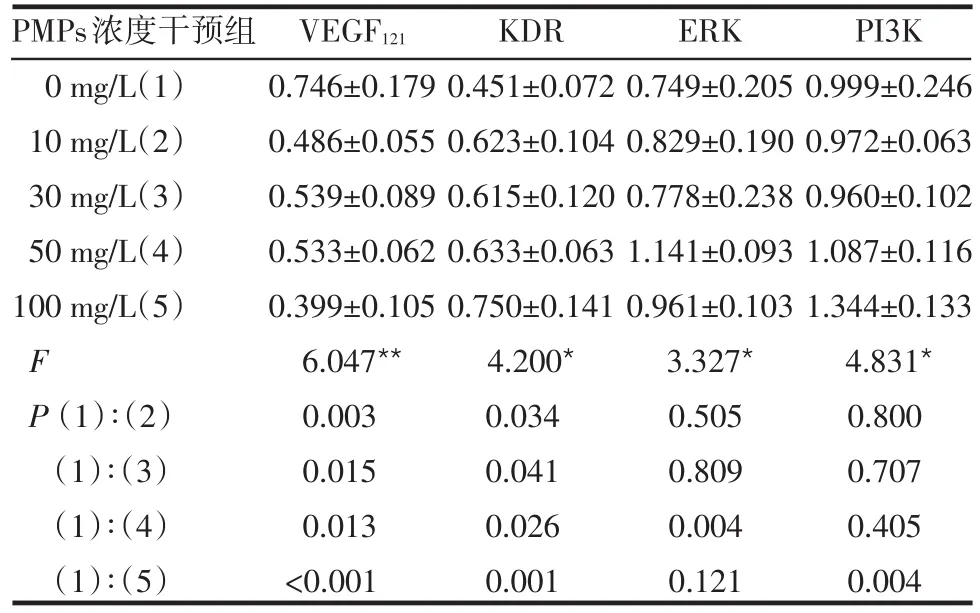
Table 2 Comparison of VEGF121,KDR,ERK and PI3K mRNA expression in endothelial cells intervened with different concentrations of PMPs表2 不同浓度PMPs对内皮细胞VEGF121、KDR、ERK及PI3K mRNA表达影响的比较 (±s)
*P<0.05,**P<0.01
PMPs浓度干预组0 mg/L(1)10 mg/L(2)30 mg/L(3)50 mg/L(4)100 mg/L(5)F P(1)∶(2)(1)∶(3)(1)∶(4)(1)∶(5)VEGF121 0.746±0.179 0.486±0.055 0.539±0.089 0.533±0.062 0.399±0.105 6.047**0.003 0.015 0.013<0.001 KDR 0.451±0.072 0.623±0.104 0.615±0.120 0.633±0.063 0.750±0.141 4.200*0.034 0.041 0.026 0.001 ERK 0.749±0.205 0.829±0.190 0.778±0.238 1.141±0.093 0.961±0.103 3.327*0.505 0.809 0.004 0.121 PI3K 0.999±0.246 0.972±0.063 0.960±0.102 1.087±0.116 1.344±0.133 4.831*0.800 0.707 0.405 0.004
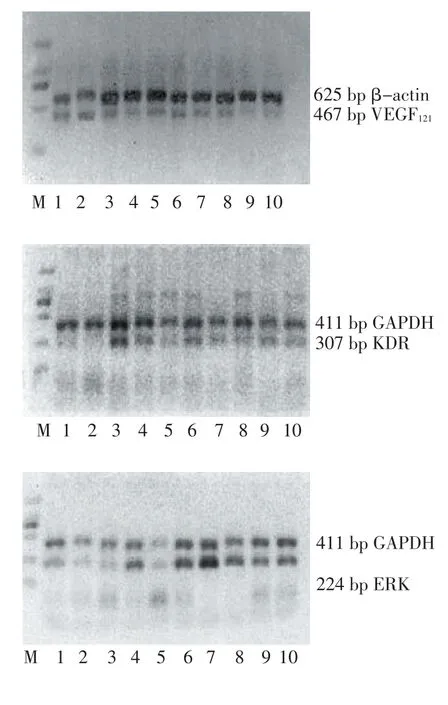
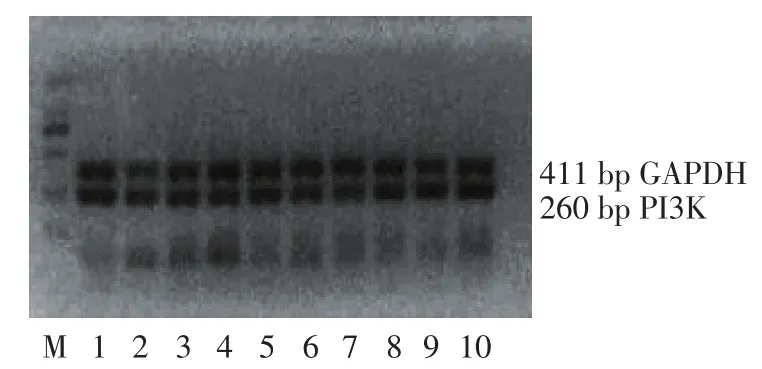
Figure 1 VEGF121,KDR,ERK and PI3K mRNA expression measured by RT-PCR图1VEGF121、KDR、ERK、PI3K的RT-PCR产物电泳图
2.2 PMPs干预不同时间对CRL-1730 VEGF121、KDR、ERK、PI3K mRNA表达的影响 干预4、24 h后与0 h组比较VEGF121表达差异有统计学意义(均P<0.05),而PMPs作用4 h、24 h却可增加KDR mRNA的表达(均P<0.05)。PMPs作用于内皮细胞24 h后与0 h组比较可显著增加内皮细胞PI3K mRNA的表达(P=0.004),见表3、图2。
Table 3 Comparison of VEGF121,KDR,ERK and PI3K mRNA expression in the endothelial cells with different intervention times表3 不同干预时间PMPs对内皮细胞VEGF121、KDR、ERK及PI3K mRNA表达影响的比较 (±s)

Table 3 Comparison of VEGF121,KDR,ERK and PI3K mRNA expression in the endothelial cells with different intervention times表3 不同干预时间PMPs对内皮细胞VEGF121、KDR、ERK及PI3K mRNA表达影响的比较 (±s)
*P<0.05,**P<0.01
PMPs时间干预组0 h(1)2 h(2)4 h(3)24 h(4)F P(1)∶(2)(1)∶(3)(1)∶(4)VEGF121 0.746±0.179 0.669±0.060 0.530±0.123 0.318±0.091 9.320**0.380 0.023<0.001 KDR 0.451±0.072 0.580±0.087 0.637±0.063 0.634±0.135 3.710*0.064 0.013 0.021 ERK 0.749±0.206 0.800±0.146 0.978±0.136 0.562±0.206 3.577*0.667 0.071 0.132 PI3K 0.999±0.246 0.762±0.092 1.294±0.495 2.622±1.213 6.359**0.585 0.497 0.004

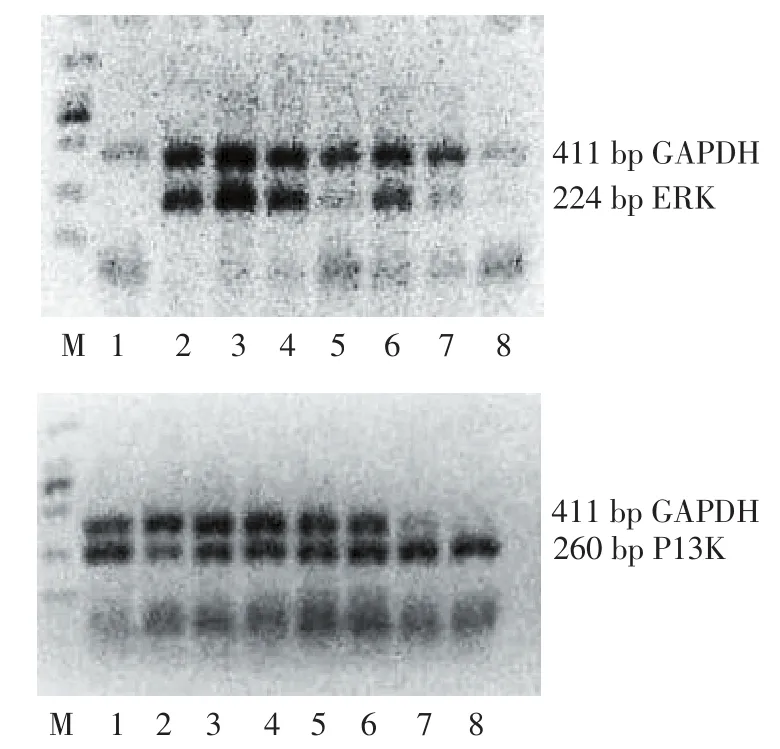
Figure 2 VEGF121,KDR,ERK and PI3K mRNA expression measured by RT-PCR图2 VEGF121、KDR、ERK及PI3K的RT-PCR产物电泳图
3 讨论
PMPs是血小板被活化后释放的微小颗粒,透射电镜观察PMP为直径0.1~1.0 μm的小囊泡[2]。此微粒包括血小板表面蛋白质类及来源于血小板的部分胞质成分,均为有生物学活性的物质[3],除凝血相关作用外,还可通过与靶细胞的相互作用启动靶细胞的生物学效应。VEGF是最有力的血管生成因子,它通过和血管内皮细胞的特异性受体结合,具有强大的促内皮增殖、促血管生成作用,此外其还是一种趋化因子,使外向生长内皮细胞归巢到血管损伤部位,修复损伤的血管[4]。Kim等[5]也证实了PMPs在体外有促进内皮细胞增殖、迁移、趋化和血管形成的功能。
Brill等[1]对PMPs促血管形成等进行了研究,主动脉环实验显示,在PMPs 30 mg/L时新血管萌芽的面积明显高于对照组;PMPs50 mg/L及更高浓度时其诱导产生的血管萌芽面积与VEGF和bFGF诱导的血管面积相一致,进一步实验显示加入VEGF受体抑制剂可完全抑制PMPs所引起的新生血管萌芽(0.7 mm2vs 5.3 mm2),bFGF和PDGF中和抗体只能部分抑制新生血管形成(1.7 mm2vs 2.4 mm2),因此其认为PMPs促进新生血管形成过程中多种细胞因子发挥了重要作用,其中VEGF是关键因子。Brill等[1]也对PMP促血管生成的传导通路进行了研究,认为至少有3个信号转导因子是PMPs作用的关键点:Scr、PI3K和ERK,PMP内的细胞因子启动了血管内皮细胞中的特殊信号转导通路,诱发细胞增殖、移动和血管形成。
本研究与Brill等的实验结论基本一致。在本研究中,采用了不同浓度PMPs对HUVECs进行刺激,结果显示在培养的内皮细胞中加入PMPs进行刺激,细胞内VEGF mRNA的表达水平逐渐下降,与0 mg/L组比较差异有统计学意义。50 mg/L PMPs刺激0、2、4、24 h,内皮细胞中VEGF mRNA表达量随时间延长逐渐下降,即内皮细胞自身的VEGF mRNA表达可能受到负反馈抑制而减少,而内皮细胞VEGFⅡ型受体(KDR)mRNA表达随PMPs干预浓度上升明显增加,VEGF下游两条信号转导通路中的两个关键酶PI3K及ERK mRNA表达也随PMPs浓度和时间的增加逐渐增高,表明被激活的信号转导通路的上游配体VEGF可能不是来源于内皮细胞自身,而是来源于PMPs自身所释放的。并且已有文献证实,活化后的血小板微颗粒PMPs可以释放血管内皮生长因子VEGF和成纤维细胞生长因子bFGF[6],这可能是PMPs能够启动VEGF这一信号转导通路,促进内皮细胞增殖的主要原因。最近的研究也证实,血管生成因子(VEGF和FGF-2)的水平和PMPs水平有着很强的相关性[7]。
PMPs是血小板脱落的膜颗粒,此微粒包含了血小板表面蛋白质类及来源血小板的部分胞质成分,PMPs可以介导血管原性的应答,来源于血小板微颗粒的多种细胞因子,如VEGF、碱性成纤维生长因子(bFGF)和血小板衍生生长因子(PDGF)参与了血管的发生。随着PMPs浓度的增加,VEGF释放可能也随之增加,VEGF与受体KDR结合后与PMPs未干预时比较可以显著激活下游的PI3K/Akt和Ras信号转导通路[8],VEGF下游信号转导通路PI3K和Ras途径中的两个关键酶PI3K及ERK mRNA表达也明显升高,即PMPs可能通过PI3K/Akt及MAPK/ERK信号转导途径促进内皮细胞、平滑肌细胞等的增殖,抑制其调亡,参与以血管和血管发生为基础的生物学过程。PMPs与类风湿性关节炎、尿毒症、肿瘤、2型糖尿病、冠心病[9-10]等许多种疾病密切相关,其中很多机制与PMPs促进血管新生有关,深入研究必将对临床相关疾病的治疗起到一定作用。
[1]Brill A,Dashevsky O,Rivo J,et al.Platelet-derived microparticles induce angiogenesis and stimulate post-ischemic revascularization[J].Cardiovasc Res,2005,67(1):30-38.
[2]Chen B,Zhong YJ,Huang CY,et al.Effects of platelet-derived membrane microparticles on angiogenesis in chick chorioallantoic membranes[J].J Exp Hematol,2007,15(5):1070-1073.
[3]Li X,Cong H.Platelet-derived microparticles and the potential of glycoprotein IIb/IIIa antagonists in treating acute coronary syndrome[J].Tex Heart Inst J,2009,36(2):134-139.
[4]谭强,邱录贵,李广平,等.循环早期内皮祖细胞与外向生长内皮细胞在血管新生中的作用[J].中华高血压杂志,2010,18(7):658-664.
[5]Kim HK,Song KS,Chung JH,et al.Platelet microparticles induce angiogenesis in vitro[J].Br J Haematol,2004,124(3):376-384.
[6]Helley D,Banu E,Bouziane A,et al.Platelet microparticles:a potential predictive factor of survival in hormone-refractory prostate cancer patients treated with docetaxel-based chemotherapy[J].Eur Urol,2009,56(3):479-484.
[7]Pintucci G,Froum S,Pinnell J,et al.Trophic effects of platelets on cultured endothelial cells are mediated by platelet-associated fibroblast growth factor-2(FGF-2)and vascular endothelial growth factor(VEGF)[J].Thromb Haemost,2002,88(5):834-842.
[8]Kim CK,Choi YK,Lee H,et al.The farnesyltransferase inhibitor LB42708 suppresses VEGF-induced angiogenesis by inhibiting Ras-dependent MAPK and PI3K/Akt signal pathways[J].Mol Pharmacol,2010,78(1):142-150.
[9]Ueba T,Nomura S,Inami N,et al.Plasma level of platelet-derived microparticles is associated with coronary heart disease risk score in healthy men[J].J Atheroscler Thromb,2010,17(4):342-349.
[10]于会宁,丛洪良,毛用敏,等.血小板微颗粒对人脐静脉内皮细胞黏附因子表达的影响[J].天津医药,2011,39(1):47-49.
