重症甲型H1N1流感病毒肺炎患者多脏器病理研究
2012-11-28茹永新杨敬平李月川徐喜媛赵轼轩庞天翔
茹永新 杨敬平 李月川 贾 玮 赵 勇 李 睿 徐喜媛 赵轼轩 庞天翔
甲型H1N1流感是变异的甲型H1N1流感病毒引起的以呼吸道症状为主要表现的传染性疾病。该病2009年3月起源于墨西哥和美国西南部,2009年5月开始在国内蔓延,据我国卫生部通报,截至2009年12月31日境内感染近12万例,死亡648例[1]。尽管普遍认为流感病毒引发的急性肺损伤或呼吸窘迫综合征和原有心、肺及代谢性疾病的加重是患者病情加重或死亡的主要原因,但多脏器病理活检在揭示疾病本质和死因方面仍有不可替代的作用。本研究在分析12例重症甲型H1N1流感病毒性肺炎的临床表现的基础上,对其中5例死亡患者进行多个脏器的病理学研究,报告如下。
1 资料与方法
1.1 一般资料 本组12例患者均于2009年11月—12月发病,9例在内蒙古医学院第三附属医院呼吸重症监护病房(RICU)住院治疗,3例在天津市胸科医院RICU住院治疗。结合临床症状、影像学、心电图、痰菌培养和逆转录聚合酶链反应(RT-PCR)检测结果,依据卫生部《甲型H1N1流感诊疗方案(2009年第3版)》,所有患者确诊为重症甲型H1N1流感病毒性肺炎。本组患者均为男性,年龄30~79岁,平均(57.0±16.7)岁,所有患者以发热、咳嗽发病,其中气短10例,肌痛9例,咯血2例;胸部影像学提示肺炎、间质肺炎12例(其中伴纤维化4例)。心电图示窦性心动过速5例、完全性右束支传导阻滞2例、心肌缺血表现2例、房颤1例、室内传导阻滞1例、窦性心律1例。痰细菌培养鲍曼不动杆菌、白假丝酵母、链球菌、金黄色葡萄球菌各1例,阴性8例。经住院治疗,7例痊愈出院,5例死亡。
1.2 病理研究方法 5例死亡患者临床死亡后5 min内纤维支气管镜下取支气管黏膜组织,经皮穿刺取肺、肝、心和腓肠肌组织。标本用3%戊二醛固定,部分标本行苏木素-伊红和吉姆萨染色,部分按照透射电镜标本制备。电镜标本块用瑞典LKB超薄切片机切成50 nm厚度切片,醋酸铀和硝酸铅染色,日本东芝H600电镜观察[2]。
1.3 统计学方法 采用SPSS 13.0软件进行数据分析处理,计量资料采用±s或M(P25,P75)表示。
2 结果
2.1 实验室检查结果 2例白细胞(WBC)升高,其余10例在正常范围。11例动脉氧分压[p(O2)]降低,8例动脉二氧化碳分压[p(CO2)]降低。11例乳酸脱氢酶(LDH)和α-羟丁酸脱氢酶(HBDH)升高,6例肌酸激酶(CK)升高,8例天冬氨酸转氨酶(AST)升高,10例C反应蛋白(CRP)升高,见表1。
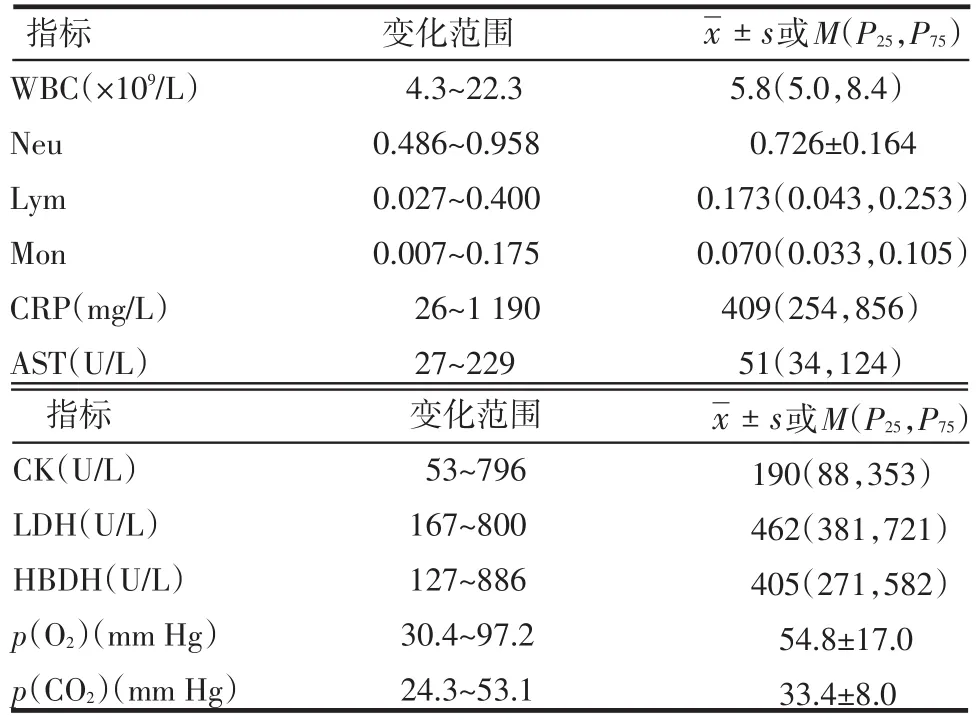
Table 1 Laboratory results of patients表1 患者实验室检查结果
2.1 光镜及电镜下表现 见图1~4。
2.2.1 支气管黏膜和肺 光镜下支气管黏膜广泛坏死,上皮细胞脱落溶解,其间掺杂成熟粒细胞和单核巨噬细胞(图1A),黏膜完整区域黏膜下层纤维组织结构正常,炎性细胞少,局部扁平上皮细胞化生。电镜下坏死组织中和上皮细胞内偶见病毒颗粒(图4A),坏死组织中有板层小体,1例患者上皮细胞同时含球菌和病毒颗粒。
肺组织广泛实变,Ⅱ型肺上皮细胞、成纤维细胞和细胞外基质为主要成分(图1B),Ⅰ型上皮细胞少,残留肺泡腔内大量脱落、坏死上皮细胞和少量中性粒细胞、巨噬细胞和淋巴细胞。Ⅱ型肺泡上皮细胞高度增生,充满肺泡,空泡化明显,肺泡和上皮细胞内有大量板层小体(图1C、1D、3A)。肺毛细血管数量少,部分坏死,周围有大量渗出,血管腔内有病毒颗粒。部分肺组织纤维化,成纤维细胞增多,周围有大量束状胶原(图3B)。电镜下Ⅱ型肺泡上皮细胞、血管内皮细胞和成纤维细胞均含病毒颗粒,细胞结构损伤严重。
2.2.2 心肌和腓肠肌 心肌和腓肠肌部分组织损伤,肌细胞含脂滴,肌节紊乱,肌纤维排列紊乱、断裂、溶解,自噬体形成;部分区域灶性坏死,肌细胞溶解坏死,结构消失(图2A、B);部分区域肌组织纤维化,成纤维细胞增多,周围有大量胶原。血管内皮细胞破坏和溶解,周围渗出明显;浦肯野纤维或细胞损伤(图3C)。病毒颗粒分布于心肌和腓肠肌细胞、成纤维细胞和血管内皮细胞,坏死区域密度最高;组织结构相对正常区域和结构完整细胞内病毒颗粒少(图4B、C)。
2.2.3 肝组织 肝细胞广泛脂肪化或空泡形成,部分细胞出现不同程度核损伤或呈凋亡形态,核仁显著,小叶中央静脉周围和汇管区肝细胞坏死,坏死和损伤部位炎性细胞少;血管周围和肝窦内渗出明显,窦内皮和血管内皮细胞损伤明显(图2C、2D、3D)。病毒主要分布于坏死和损伤区域肝细胞、血管内皮细胞和肝窦上皮细胞,以及巨噬细胞内,损伤较轻和结构完整细胞中病毒少,血管和窦腔偶见病毒(图4D)。
2.2.4 病毒颗粒结构 受累及组织细胞中H1N1病毒呈多形性,少数病毒结构完整,直径120 nm左右,由表到里依次为齿轮样低密度蛋白壳、单层膜、空白间隙和高密度核酸蛋白芯;大部分病毒颗粒缺乏齿轮样低密度蛋白壳,直径100 nm左右,由单层膜、核酸蛋白芯和两者间隙组成,间隙局部增宽时,颗粒外观呈椭圆形;偶见丝状或长条形结构,横断直径与病毒核酸颗粒大小一致,周围有病毒颗粒。
3 讨论
本组12例患者有发热、咳嗽和气短,胸部影像显示肺炎、肺间质炎,4例有肺纤维化表现;血细胞分析除2例白细胞总数升高外,10例患者在正常范围,咽拭子检测甲型H1N1流感病毒阳性,符合甲型H1N1流感病毒上呼吸道感染特点;血气分析,11例p(O2)降低,8例p(CO2)降低,说明大部分患者呼吸功能严重障碍。综合临床表现、肺部影像学及其他实验室检查结果,本组患者病情明显重于国内报道平均水平[3],符合重症甲型H1N1流感病毒肺炎诊断要点[4]。5例死亡患者中4例合并肺部细菌感染,其中1例电镜发现脱落和死亡的黏膜及肺泡上皮细胞中同时存在病毒和细菌,符合细菌感染与甲流患者病情加重和死亡相关的报道[5]。
美国有学者研究34例25~49岁甲型H1N1流感死亡患者肺病理,主要表现包括气管炎、支气管炎和弥漫性肺泡损伤,免疫组化和RT-PCR显示气管、支气管、肺泡上皮细胞及肺泡巨噬细胞甲型H1N1流感病毒阳性,部分患者合并细菌性肺炎[6]。这些特点与本组5例死亡患者支气管和肺部分病理改变相同,说明流感病毒可引起不同年龄患者相同的呼吸系统病理损伤。此外,本组5例死亡患者支气管鳞状上皮局部化生,Ⅱ型肺泡上皮细胞增生,充满肺泡,成纤维细胞增生并合成大量胶原,使肺组织严重实变和纤维化,与日本报道的肺病理基本一致[7-9],说明肺实变和纤维化是重型甲型H1N1流感病毒性肺损伤的重要病理特征,是患者呼吸功能衰竭的重要原因。
流感患者死因一般包括3个方面:(1)强大的病毒毒力,如1918年世界性大流感中多数患者数天内死亡,2005年南亚H5N1禽流感中患者主要死于病毒性肺炎引起的急性呼吸窘迫综合征[10]。(2)病毒感染诱发的继发性细菌感染。(3)病毒感染导致的心、肺慢性疾病或糖尿病等基础疾病加重。通常流感病毒没有足够毒力通过单独侵犯肺部导致患者死亡,因此现在认为1918年的大部分年轻流感患者死于继发性细菌感染[5]。同样,目前认为甲型H1N1流感病毒肺炎继发细菌性肺炎和基础疾病加重是患者病情加重和死亡的主要因素。
自2009年甲型H1N1流感在全世界爆发以来,多数患者有不同程度肌痛,部分患者有心肌缺血、心律失常和心功能受损表现;病情较重患者血清LDH、α-HBDH、CK和AST升高[11],这些病理特点已经作为临床诊断和重症患者分类的重要指标。这些病理变化普遍被认为是病毒性肺炎诱发的多脏器损伤或原有基础疾病加重所致[5],尚少见病毒侵犯肺组织同时直接侵犯其他脏器以及此方面的病毒和病理研究报道。
本组12例患者发病后11例出现不同程度心律失常和心肌缺血,7例肌痛明显,11例LDH和HBDH升高,6例CK升高,8例AST增高,提示心肌、其他系统肌肉或肝脏受累。光镜和电镜研究5例死亡患者心肌、肝脏和骨骼肌,发现各脏器除出现不同程度局灶性溶解和坏死外,损伤和坏死部位含大量病毒颗粒,炎性细胞浸润少,损伤较轻或结构正常部位病毒颗粒少,证实器官损伤与病毒直接侵入破坏有关,与继发性损伤,尤其是单核/巨噬系统或淋巴细胞浸润关系不大。CRP升高常见于细菌感染、组织损伤或坏死,以及心肌梗死和心功能不全,单纯病毒感染多为阴性或弱阳性,所以通常用于鉴别细菌与病毒感染。本组12例患者中10例显著升高,一方面可能与多脏器损伤有关,另一方面与合并细菌感染相关。
综上,笔者认为甲型H1N1流感病毒不仅能直接感染肺组织,引起病毒性肺炎和严重肺损伤,而且可以侵犯多个器官,引起多脏器损伤和功能衰竭,导致患者病情加重和死亡。
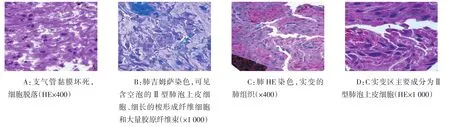
Figure 1 Photos of bronchus and lung tissues图1 支气管和肺组织
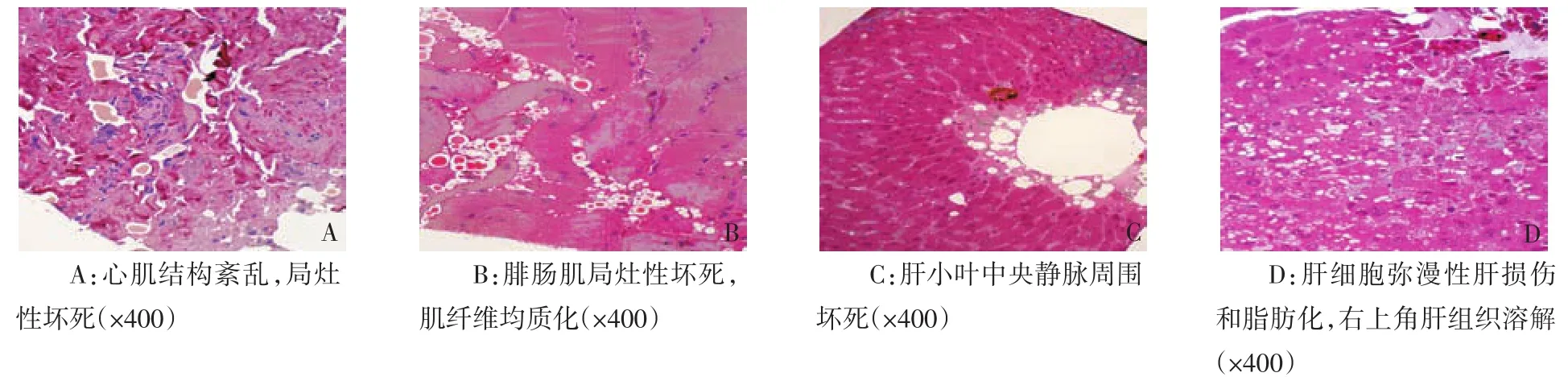
Figure 2 Photos of myocardium,gastrocnemius and liver(HE staining)图2 心肌、腓肠肌和肝组织(HE染色)

Figure 3 Photos of ultrastructural pathology图3 超微病理
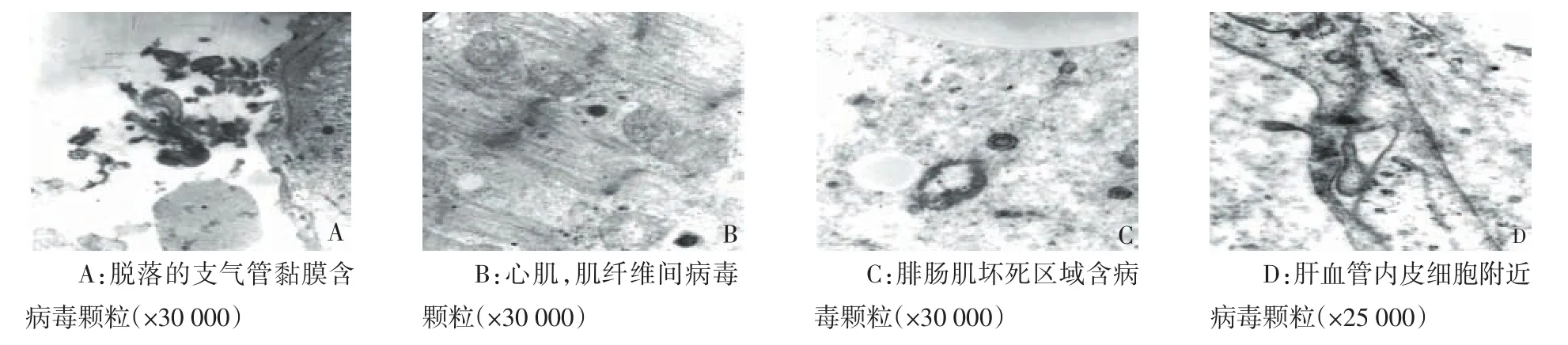
Figure 4 Photos of virus particles图4 病毒颗粒
[1]中华人民共和国卫生部.2009年12月份全国甲型H1N1流感防控工作情况[EB/OL].[2010-01-02].http://www.moh.gov.cn/publicfiles/business/htmlfiles/mohwsyjbgs/s7863/201001/45434.htm.
[2]Ru YX,Zhao SX,Liu EB,et al.Ultrastructural characteristics of bone marrow in patients with hematological disease:a study of 13 cases[J].Ultrastruct Pathol,2007,31(5):327-332.
[3]Cao B,Li XW,Mao Y,et al.Clinical features of the initial cases of 2009 pandemic influenza A(H1N1)virus infection in China[J].N Engl J Med,2009,361(26):2507-2517.
[4]李冠华,张力,李月川,等.重症甲型H1N1流感病毒肺炎的临床和病理特征[J].天津医药,2010,38(1):32-35.
[5]McCullers JA.Insights into the interaction between influenza virus and pneumococcus[J].Clin Microbiol Rev,2006,19(3):571-582.
[6]Gill JR,Sheng ZM,Ely SF,et al.Pulmonary pathologic findings of fatal 2009 pandemic influenza A/H1N1 viral infections[J].Arch Pathol Lab Med,2010,134(2):235-243.
[7]Mauad T,Hajjar LA,Callegari GD,et al.Lung pathology in fatal novel human influenza A(H1N1)infection[J].Am J Respir Crit Care Med,2010,181(1):72-79.
[8]Nakajima N,Hata S,Sato Y,et al.The first autopsy case of pandemic influenza(A/H1N1pdm)virus infection in Japan:detection of a high copy number of the virus in type II alveolar epithelial cells by pathological and virological examination[J].Jpn J Infect Dis,2010,63(1):67-71.
[9]Takiyama A,Wang L,Tanino M,et al.Sudden death of a patient with pandemic influenza(A/H1N1pdm)virus infection by acute respiratory distress syndrome[J].Jpn J Infect Dis,2010,63(1):72-74.
[10]Beigel JH,Farrar J,Han AM,et al.Avian influenza A(H5N1)infection in humans[J].N Engl J Med,2005,353(13):1374-1385.
[11]Perez-Padilla R,de la Rosa-Zamboni D,Ponce de Leon S,et al.Pneumonia and respiratory failure from swine-origin influenza A(H1N1)in Mexico[J].N Engl J Med,2009,361(7):680-689.
