EGR-1基因转染对高糖环境中小鼠肾小球系膜细胞TGF-β及PDGF-B表达的影响
2012-11-27候明辉郭雅卿李鸿燕
刘 洁 候明辉 刘 莉 张 耀 孟 杰 郭雅卿 李鸿燕
(河北大学附属医院内分泌科,保定071000)
早期生长反应因子(The early growth responsive gene-1,EGR-1)为即刻早期反应基因(Immediate early genes,IEGs)家族中最重要的一员,在神经、循环、泌尿、呼吸等多个系统控制细胞增殖、分化和凋亡[1]。研究表明,在大鼠抗Thy-1.1抗体肾炎模型中,EGR-1在系膜细胞增殖和系膜基质形成的高峰期表达上调,表明其通过调节系膜细胞增殖和细胞外基质聚积参与了肾小球硬化过程[2]。但是,其具体的作用机制尚不明了。
体内外实验证明,糖尿病肾病时,肾小球系膜细胞转化生长因子-β(TGF-β)及血小板源性生长因子-B(PDGF-B)表达增加,可促进系膜细胞增殖,在糖尿病肾病(Diabetic nephropathy,DN)的发生发展中起重要作用。目前关于EGR-1与TGF-β、PDGF-B的关系,及其在DN发病机制中的作用国内外尚无研究报道。本实验通过体外转染EGR-1基因,观察高糖环境下EGR-1基因对系膜细胞TGF-β、PDGF-B表达及Ⅳ型胶原分泌的影响,探讨EGR-1与系膜细胞增殖和细胞外基质代谢之间的关系,进一步揭示EGR-1在DN发生、发展中的作用机制。
1 材料与方法
1.1 材料 小鼠肾脏系膜细胞株SV40MES13由美国模式菌种收集中心提供;pcDNA3.1-Egr-1、pc DNA3.1由美国Invitrogen生命技术公司提供;LipofectamineTM2000(美国Invitrogen公司);DMEM/F12培养基(美国Gibco BRL公司);胎牛血清(杭州四季青公司);潮霉素 B(Roche公司);兔抗小鼠EGR-1单克隆抗体(Santa Cruz公司);兔抗小鼠TGF-β、PDGF-B单克隆抗体(Santa Cruz公司);Ⅳ型胶原ELISA试剂盒、MTT(美国Sigma公司)。
1.2 方法
1.2.1 细胞培养 从液氮中取出冻存的小鼠系膜细胞迅速复苏后转入25 cm2塑料培养瓶,CO2培养箱(5%CO2,37℃)静置培养24~48小时,待细胞充分贴壁后每隔2~3天换液1次,约3~5天细胞长满瓶底进行细胞传代。系膜细胞生长至75%~85%融合,分别用无血清DMEM/F12传统培养基洗一次,换无血清培养基孵育24小时,使细胞同步化,分成4个实验组,即正常对照组(A组,非转染的系膜细胞,5.5 mmol/L葡萄糖环境)、高糖组(B组,非转染的系膜细胞,30 mmol/L葡萄糖环境)、高糖+空质粒组(C组,转染空质粒的系膜细胞,30 mmol/L葡萄糖环境)和高糖+EGR-1质粒转染组(D组,转染EGR-1质粒的系膜细胞,30 mmol/L葡萄糖环境)(按Lipofectamine 2000说明书方法进行转染),于12、24、48小时末收集各组细胞上清液,-80℃保存,用于Ⅳ型胶原的测定。用预冷的PBS洗涤细胞两次,将各瓶液体倒干,然后加入预冷的裂解液300 μl,冰浴静置1小时,然后4℃、14 000 r/min离心25分钟,吸取上清。采用考马司亮蓝法测定上清液蛋白浓度,分装,-80℃保存。
1.2.2 MTT法检测小鼠系膜细胞的增殖 取对数生长期的系膜细胞以密度1×105ml-1接种于96孔板内,100 μl/孔,培养 24小时后,用无血清的DMEM/F12培养液,继续培养24小时,使细胞同步于G0期,然后弃上清,按上述分组给予高糖刺激,分别作用12、24、48小时后测系膜细胞的增殖。于各组实验结束前4小时加入20 μl的MTT溶液(5 mg/ml),37℃继续孵育4小时,弃去上清,每孔加入150 μl DMSO终止反应,振荡溶解,于酶标仪波长490 nm处读取吸光度(A)值。试验重复3次,每组设6个复孔。
1.2.3 免疫细胞化学检测各组系膜细胞中EGR-1、TGF-β、PDGF-B蛋白表达 采用6孔板细胞爬片,分别于12、24、48小时终止培养,细胞用0.01 mol/L PBS冲洗数次,4%多聚甲醛固定30分钟;蒸馏水和PBS各冲洗5分钟;3%H2O2甲醇室温孵育10分钟灭活内源性过氧化物酶;PBS冲洗2次,每次5分钟;0.1%Trix X-100打孔37℃,20分钟,PBS冲洗2次,每次5分钟;正常山羊血清37℃封闭45分钟;滴加1∶150稀释的一抗,4℃过夜(PBS代替一抗做阴性对照);PBS冲洗,5分钟×3次;滴加生物素化二抗工作液,37℃孵育25分钟;PBS冲洗,5分钟×3次;滴加辣根过氧化物酶标记的链酶卵白素工作液,37℃孵育20分钟;PBS冲洗,5分钟×3次;DAB显色,镜下观察显色情况;蒸馏水冲洗,终止显色;梯度酒精脱水,透明、封片。每个指标检测6孔细胞。
1.2.4 Western印迹法检测各组系膜细胞中EGR-1、TGF-β、PDGF-B蛋白表达 每个样品取50 μg总蛋白,加6×SDS加样缓冲液,在沸水中变性4分钟,经10%SDS-PAGE凝胶电泳后电转移至PVDF膜;5%脱脂奶粉37℃封闭PVDF膜1.5小时,一抗(EGR-1 一抗工作液浓度为 1∶200,TGF-β、PDGF-B一抗工作液浓度为1∶300,GAPDH一抗工作液浓度为1∶500),4℃过夜。TTBS洗膜后加辣根过氧化物酶标记的羊抗兔或小鼠二抗(1∶18 000稀释),37℃孵育2小时;TTBS洗膜,滴加ECL试剂,将PVDF膜放入X光片暗盒,在暗室中压片,显影,定影。用美国UVP公司LabWorks 4.5软件对Western条带进行定量分析,读取积分光密度值(IOD)。
1.2.5 酶联免疫吸附法(Enzyme linked immunosorben assay,ELISA)检测细胞上清液中的Ⅳ型胶原含量 待细胞培养终止后收集培养液,1 000 r/min离心5分钟以除去培养液中的细胞成分,取上清液以备检测。本实验采取双抗体夹心ABC-ELISA法。操作严格按照试剂盒说明书进行。
2 结果
2.1 EGR-1促进小鼠系膜细胞的增殖 从12小时开始,B组较A组小鼠系膜细胞吸光光度值开始升高,48小时达到高峰,差异有统计学意义(P<0.01),C组和B组相比差异无统计学意义(P>0.05),但D组变化趋势更明显,与C组和B组相比差异有统计学意义(P<0.05),见表1。
2.2 各组系膜细胞 EGR-1、TGF-β、PDGF-B蛋白表达 免疫细胞化学和Western blot结果显示:从12小时开始,B组较A组小鼠系膜细胞EGR-1、TGF-β、PDGF-B蛋白水平开始升高,随时间延长增强更明显,且此趋势持续到48小时,有统计学意义(P<0.05),C组和B组相比差异无统计学意义(P>0.05),但D组变化趋势更明显,与C、B组相比差异有统计学意义(P<0.05),见图1~6。
2.3 EGR-1诱导肾小球系膜细胞Ⅳ型胶原的分泌从12小时开始,B组小鼠系膜细胞上清液中Ⅳ型胶原浓度较A组开始升高,48小时达到高峰,差异有统计学意义(P<0.01),C组与B组相比差异无统计学意义(P>0.05),但D组系膜细胞上清液中
Ⅳ型胶原浓度升高最明显,与其他组相比差异有统计学意义(P<0.05),见表2。
表1 EGR-1对高糖环境下系膜细胞增殖的影响(±s,n=6)Tab.1 Effects of EGR-1 on proliferation of glomerular mesangial cell(±s,n=6)
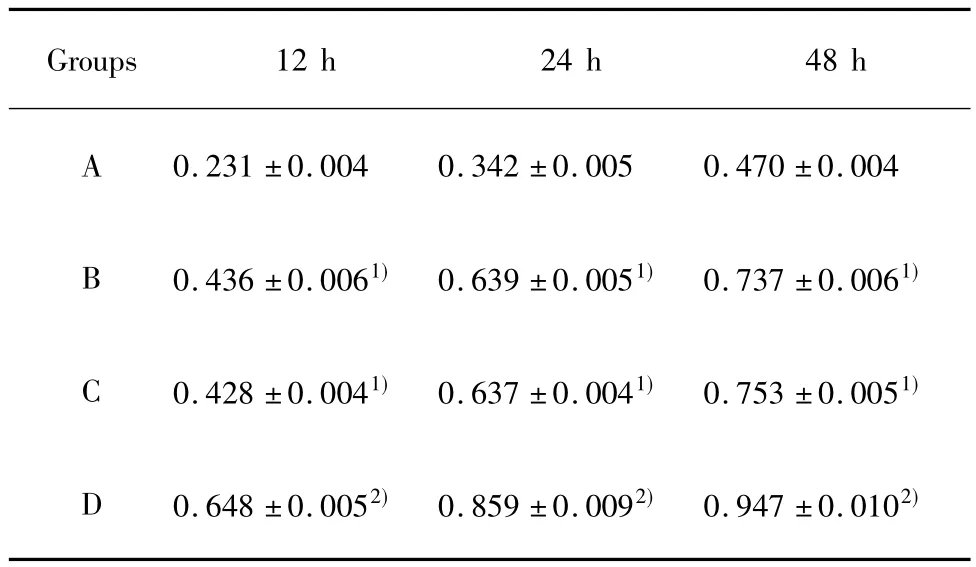
表1 EGR-1对高糖环境下系膜细胞增殖的影响(±s,n=6)Tab.1 Effects of EGR-1 on proliferation of glomerular mesangial cell(±s,n=6)
Note:A.NG;B.HG;C.HG+pcDNA3.1;D.HG+pcDNA3.1-Egr-1.1)P<0.01 vs group A;2)P<0.05 vs group B and C.
Groups 12 h 24 h 48 h A 0.231±0.004 0.342±0.005 0.470±0.004 B 0.436±0.0061) 0.639±0.0051) 0.737±0.0061)C 0.428±0.0041) 0.637±0.0041) 0.753±0.0051)D 0.648±0.0052) 0.859±0.0092) 0.947±0.0102)
表2 各组细胞上清液中Ⅳ型胶原浓度(μg/L,±s,n=6)Tab.2 Concentration of type Ⅳ collagen in the supernatant of mesangial cells of every group(μg/L,±s,n=6)

表2 各组细胞上清液中Ⅳ型胶原浓度(μg/L,±s,n=6)Tab.2 Concentration of type Ⅳ collagen in the supernatant of mesangial cells of every group(μg/L,±s,n=6)
Note:A.NG;B.HG;C.HG+pcDNA3.1;D.HG+pcDNA3.1-Egr-1.1)P<0.01 vs group A;2)P<0.05 vs group B and C.
Groups 12 h 24 h 48 h A 6.33±0.125 7.04±0.78 8.15±1.12 B 11.05±1.031) 13.06±1.001) 16.08±0.881)C 10.99±1.161) 12.73±0.431) 15.96±0.491)D 13.48±0.962) 15.69±0.502) 19.16±0.712)
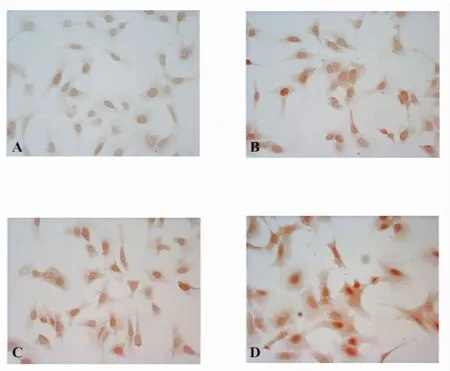
图1 高糖培养48小时后各组系膜细胞EGR-1的表达(免疫细胞化学,×400)Fig.1 Immunocytochemical staining for EGR-1 in glomerular mesangial cells after 48 hours(×400)

图2 高糖培养48小时后各组系膜细胞TGF-β的表达(免疫细胞化学,×400)Fig.2 Immunocytochemical staining for TGF-β in glomerular mesangial cells after 48 hours(×400)

图3 高糖培养48小时后各组系膜细胞PDGF-B的表达(免疫细胞化学,×400)Fig.3 Immunocytochemical staining for PDGF-B in glomerular mesangial cells after 48 hours(×400)

图4 不同时间点各组系膜细胞EGR-1的蛋白表达(Western印迹)Fig.4 Western blot for EGR-1 protein in glomerular mesangial cells in every group
3 讨论
糖尿病肾病(Diabetic nephropathy,DN)是糖尿病最严重的微血管并发症之一,已经成为导致终末期肾衰竭的主要原因。肾小球系膜细胞具有收缩、吞噬和产生细胞外基质等多种功能,在维持肾脏正常生理功能及肾脏病变的发生发展中起重要作用[3]。系膜细胞可以产生细胞外基质、蛋白酶(丝氨酸蛋白酶和基质金属蛋白酶等)和蛋白酶抑制剂(丝氨酸蛋白酶抑制剂和金属蛋白酶组织抑制剂等)。正常生理条件下,它们之间处于一种动态平衡。但在糖尿病状态下,高糖、血管紧张素Ⅱ、炎症、氧化应激产物等有害刺激作用下,蛋白酶的功能减退或蛋白酶抑制剂活性增强时,就会引起细胞外基质的沉积和肾小球硬化。
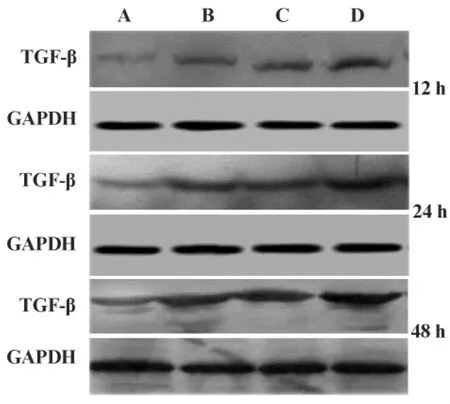
图5 不同时间点各组系膜细胞TGF-β的蛋白表达(Western印迹)Fig.5 Western blot for TGF-β protein in glomerular mesangial cells in every group
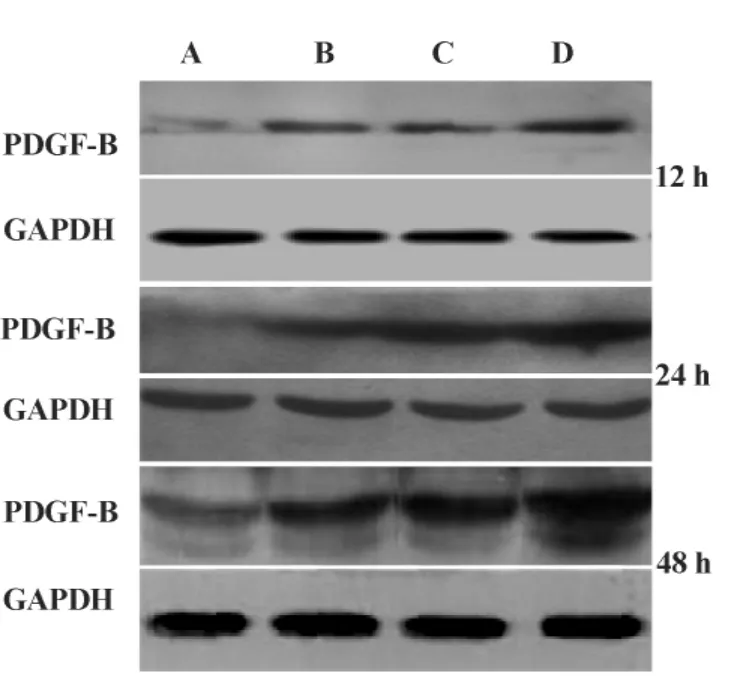
图6 不同时间点各组系膜细胞PDGF-B的蛋白表达(Western印迹)Fig.6 Western blot for PDGF-B protein in glomerular mesangial cells in every group
早期生长反应元件(Early growth response-1,EGR-1)也称为NGFI-A、zif268、krox-24 及TIS8,为锌指转录因子,也是即刻反应基因(Immediate-early gene)的产物[4,5],位于人的第5 对染色体 q23-31,长2.1 kb,编码3.3 kb成熟的mRNA,其下游为EGR-1基因的外显子区域,编码由543个氨基酸组成的EGR-1蛋白产物,分子量为80~82 kD。人与小鼠的EGR-1基因在核酸与蛋白水平方面的同源性分别为87%和94%。EGR-1中心区域尚有三个完全一致的半胱氨酸/组氨酸型锌指结构,与富含GC的DNA序列特异结合,发挥转录因子的作用[6]。
EGR-1仅在快速反应的器官表达,而在慢反应的器官和组织表达却很弱,甚至不表达。在成熟小鼠的脑、甲状腺、心脏、肺、肾等部位呈高表达,而肝、脾、睾丸等为低表达;在人体组织中只有少数器官,包括脑、心、肺能达到相对高的水平,在人体正常的乳腺组织中亦可检测到EGR-1的高表达[7,8]。在多种刺激物如电离射线、紫外线照射、张力刺激、低氧、缺血/再灌注损伤、化疗药物、多肽生长因子、切应力和尿素等的作用下可见到EGR-1表达增加,使细胞由G0期进入G1期,导致细胞增殖[9]。国外文献报道,在泌尿系统已有研究发现在单侧输尿管梗阻致肾间质纤维化模型,应用电穿孔技术使DNA酶导入成纤维细胞特异地阻断EGR-1表达,相应地减少了TGF-β1、α-SMA和Ⅰ型胶原mRNA的表达,减少了肌成纤维细胞形成,抑制了肾间质纤维化[1,2]。此外EGR-1在系膜细胞增殖和系膜基质积聚性病变中表达明显,在系膜细胞肥大、增生和系膜基质增多等方面起着重要作用,在体外培养的大鼠系膜细胞中EGR-1表达升高可促使系膜细胞增殖,应用反义寡核苷酸将EGR-1阻断后,系膜细胞增殖降低。本实验结果表明,与正常糖组相比较,高糖组肾小球系膜细胞EGR-1基因表达升高,系膜细胞增殖及Ⅳ型胶原分泌明显;与高糖组相比较,EGR-1基因转染组系膜细胞增殖及Ⅳ型胶原分泌更加显著,说明高糖可促进EGR-1基因高表达,EGR-1基因可诱导系膜细胞的增殖及Ⅳ型胶原分泌。Soon等[10]研究证明EGR-1可通过上调系膜细胞中基质金属蛋白酶-9(MMP-9)的表达,抑制细胞外基质降解,促进系膜外基质沉积,加重肾小球硬化,与上述研究结果一致。
研究表明,EGR-1也是关键调节因子,调控多个基因的表达[11]。寡核苷酸为基础的基因芯片分析揭示了依赖于EGR-1的基因数目超过300个[12]。在许多基因的启动子中都有功能性EGR-1的结合位点。通过与靶基因结合,EGR-1可调节一系列与细胞生长分化和细胞凋亡、炎性细胞趋化、免疫刺激等相关的多种基因表达。其可调控细胞间黏附分子-1(Intercelluaradhesionmolecule-1,ICAM-1)、血小板衍生生长因子(Platelet derived growth factor,PDGF)A/B链、转化生长因子-β(Transforming growth factor-β,TGF-β)、巨噬细胞集落刺激因子(Macrophage-colony stimulating factor,M-CSF)、组织因子(Tissue factor,TF)、尿激酶型纤维蛋白溶酶原激活剂(Urokinase-type plasminogen activator,u-PA),bFGF、IL-2、TNF-α、CD44,以及 EGR-1 自身启动子的表达,从而发挥信号传导通路中介作用[13,14]。本实验结果表明,高糖刺激下肾小球系膜细胞 EGR-1、TGF-β、PDGF-B 表达升高,转染 EGR-1基因后,系膜细胞TGF-β和PDGF-B表达升高更加显著,提示EGR-1可促进TGF-β、PDGF-B的表达,进一步促进系膜细胞的增殖及细胞外基质分泌,加速肾小球硬化,进而在DN肾损害和纤维化中起重要作用,但其具体作用机制尚需进一步研究证实。
总之,目前对EGR-1基因具体的生物学功能尚不清楚,探讨EGR-1基因高表达对肾小球系膜细胞TGF-β和PDGF-B的表达及系膜细胞增殖,细胞外基质沉积的影响,对进一步明确EGR-1基因在糖尿病肾病发生、发展中的作用机制具有重要意义,将为临床提供糖尿病肾病早期干预的新靶点,为人类防治糖尿病肾病提供理论依据。
1 Gerhard H,Claudia G,Vikas P et al.Transcription factor Egr-1 regulates glomerular mesangial cell proliferation[J].Biol Chem,1996;271(45):28306-28310.
2 Harald D,Rupprecht,Yoshitaka A et al.Nitric oxide inhibits growth of glomerular mesangial cells:Role of the transcription factor EGR-1[J].Kidney International,1999;57(2000):70-82.
3 Kanwar Y S,Wada J,Sun L et al.Diabetic nephropathy:mechanisms of renal disease progression[J].Exp Biol Med,2008;233(1):4-11.
4 Blaschke F,Bruemmer D,Law R E.Egr-1 is a major vascular pathogenic transcription factor in atherosclerosis and restenosis[J].Rev Endocr Metab Disord,2004;5(3):249-254.
5 Khachigian L M.Early growth response-1 in cardiovascular pathobiology[J].Circ Res,2006;98(2):186-191.
6 Yifan Lu,Tong Li,Hamid Y et al.Early growth response 1(Egr-1)regulates phosphorylation of microtubule-associated protein tau in mammalian brain[J].Biol Chem,2011;286(13):20569-20581.
7 庄楚香,吴名耀.Egr-1在小鼠和人体正常组织中的表达及其生理学功能[J].汕头大学医学院学报,2001;14(3):166-168.
8 吴名耀,庄楚香.Egr-1在小鼠和人组织中的表达及其与细胞增殖的关系[J].中国组织化学与细胞化学杂志,2002;11(1):72-74.
9 Danuta S,Bernd G,Christina S et al.Mycophenolic acid inhibits the autocrine PDGF-B synthesis and PDGF-BB-induced mRNA expression of Egr-1 in rat mesangial cells[J].Nephrol Dial Transplant,2009;24(1):52-61.
10 Soon Y,Ji H,Andrew B et al.Transcription factor Egr-1 is essential for maximal matrix metalloproteinase-9 transcription by tumor necrosis factor[J].Mol Cancer Res,2010;8(4):507-519.
11 Khachigian L M.Early growth response-1 in cardiovascular pathobiology[J].Circ Res,2006;98(2):186-191.
12 Frédéric B,Simon D,Katherine B et al.EGR-1 activation by EGF inhibits MMP-9 expression and lymphoma growth[J].Blood,2010;116(5):759-766.
13 Yunlu Xu,Fatouma T,Wu Qu et al.Advanced glycation end product(AGE)-receptor for AGE(RAGE)signaling and up-regulation of egr-1 in hypoxic macrophages[J].Biol Chem,2010;285(30):23233-23240.
14 Ossie F,Dyson,Christopher M et al.Interferon tau regulates PGF2 release from the ovine endometrial epithelial cells via activation of novel JAK/EGFR/ERK/EGR-1 pathways[J]Biol Chem,2010;285(11):37491-37502.
