Poly I:C刺激下原发性干燥综合征患者单核细胞分泌Ⅰ型干扰素能力增强①
2012-09-12胡志德谷明莉黄元兰郭方宇邓安梅
孙 懿 胡志德 谷明莉 黄元兰 薛 苗 郭方宇 邓安梅
(第二军医大学长海医院实验诊断科,上海200433)
干燥综合征(Sjögren Syndrome,SS)是一种主要发生于中老年女性的自身免疫性疾病,受累的器官主要是唾液腺和泪腺,长期的自身免疫性反应导致唾液腺和汗腺功能逐渐丧失,患者因而表现出口干、眼干等症状[1]。SS可以是原发性疾病(原发性干燥综合征,pSS),也可以继发于其它自身免疫性疾病(继发性干燥综合征,sSS)。
以往的研究表明,Ⅰ型干扰素通路过度活化是SS发病机制的重要环节[2,3]。外周血高水平的Ⅰ型干扰素增强了SS患者淋巴细胞和腺体组织内多个干扰素诱导基因的表达,促进了自身免疫反应的发展[4-6]。长期以来,临床免疫学家对SS外周血高水平Ⅰ型干扰素的来源进行了大量深入的研究,发现病毒感染可能是引起外周血Ⅰ型干扰素水平增高的原因之一[7]。当病毒入侵机体时,位于抗原递呈细胞表面的模式识别受体(PRR),如 TLR家族的TLR3、TLR7/8和TLR9以及RLR家族的 RIG-Ⅰ和MD5等,组成了机体对抗病毒感染的第一道防线。这些PRR在感知到病毒后,通过极为复杂且精细的信号转导途径,启动宿主的抗原递呈细胞内Ⅰ型干扰素的表达和释放,促进病原体的清除[8]。Ⅰ型干扰素是把“双刃剑”,虽然适度的、及时的Ⅰ型干扰素反应有助于病毒的清除,但是过度的、持续的Ⅰ型干扰素反应则会导致组织的慢性损伤,引发自身免疫性疾病[9]。值得注意的是,并非所有的病毒感染患者最终都会发展成SS,这表明在pSS发生与发展的过程中,除了病毒感染这一“外因”以外,机体免疫系统的固有个体特性这一“内因”还发挥着不可忽视的作用。
外周血单核细胞是Ⅰ型干扰素的重要来源,因此我们提出如下假说:pSS患者的单核细胞与健康个体单核细胞在分泌Ⅰ型干扰素的能力上可能存在差异,而这种差异可能是导致pSS发生或发展的重要因素。在本研究中,我们以Poly I:C刺激pSS患者和健康个体的单核细胞,观察其释放Ⅰ型干扰素的能力是否存在差异。
1 材料与方法
1.1 研究对象 收集2010年2月至2011年8月期间第二军医大学长海医院和长征医院风湿科收治的新诊断的pSS患者14例,其诊断符合2002年美国-欧洲联合制定的干燥综合征诊疗指南[10],所有pSS患者均无恶性肿瘤以及血液系统疾病,且最近一月以内无感染性疾病病史。pSS患者男女比例为2/12,年龄为(49.1±11.2)岁。另从同期来我院进行体检的个体中选取14名作为健康对照,健康对照组男女比例为2∶12,平均年龄为(45.9±13.5)岁。本研究经长海医院及长征医院医学伦理学委员会批准,所有受试对象均签署知情同意书。
1.2 细胞的分离与培养 于患者和健康对照治疗前采集空腹静脉血10 ml,2 000 r/min离心10分钟,收集上层血浆至-80℃保存备用。采用密度梯度离心法(淋巴细胞分离液LymphoprepTM购自挪威AXIS-SHIELD公司)分离出SS患者和健康对照者的外周血单个核细胞(PBMC)。之后采用磁珠分选法从部分PBMC中分离出CD14+的单核细胞,磁珠分离试剂盒购自美国Miltenyi biotec公司,分选过程按照生产商提供的操作说明进行。对于分选得到的CD14+的单核细胞,经流式细胞术鉴定纯度在90%以上时才进行下一步实验。所有分离得到的CD14+的单核细胞(阳性选择)、去CD14+单核细胞的PBMC(阴性选择)以及未经分离的PBMC均冻存于液氮中,待细胞收集完成后统一复苏培养,进行下一步实验。
待细胞复苏完成后,调整细胞浓度至2×105ml-1,以含10%胎牛血清或患者/健康对照血清,100 U/ml青霉素和100 μg/ml链霉素的RPMI1640培养基置于96孔板中37℃,5%CO2培养24小时后,同时加入终浓度不等的Poly I:C(购自Sigma公司)对细胞(包括PBMC,去除了单核细胞的PBMC以及CD14+单核细胞)进行刺激,于刺激后第12和24小时收集细胞上清液进行 IFN-α和 IFN-β的ELISA检测。
1.3 IFN-α 和 IFN-β 的 ELISA 检测 IFN-α 和IFN-β的ELISA检测试剂盒购自R&D公司,检测过程按生产商提供的操作说明进行。
1.4 统计学分析 两组资料间的比较采用独立样本t检验或者配对t检验,多组样本间的比较采用单因素方差分析。所有统计学处理均在SPSS17.0 for Windows中完成,定义P<0.05为有统计学差异。
2 结果
2.1 pSS患者外周血PBMC对Poly I:C刺激呈现高反应性 我们首先分析Poly I:C刺激诱导pSS患者PBMC表达和释放IFN-α和IFN-β的能力。结果发现,50 μg/ml的 Poly I:C可以诱导 pSS患者和健康个体的 PBMC释放 IFN-α和 IFN-β,但pSS患者 PBMC释放 IFN-α和 IFN-β的能力显著高于健康对照(图1A)。我们进一步观察来自pSS患者和健康个体的去除了CD14+单核细胞的PBMC对50 μg/ml的 Poly I:C的反应性。结果发现:在去除了CD14+单核细胞的PBMC中,Poly I:C可以诱导其释放IFN-α和IFN-β,但其释放水平相对较低。虽然在部分时间点上pSS患者与健康个体间的差异有统计学意义,但该两组细胞释放IFN-α和IFN-β的整体差异不显著(图1B)。该结果提示:pSS患者PBMC对Poly I:C刺激具有高反应性,且这种高反应性可能与单核细胞有关。
2.2 pSS患者外周血单核细胞对Poly I:C刺激呈现高反应性 进一步研究发现:50 μg/ml的Poly I:C刺激CD14+单核细胞可以诱导相对较高浓度的IFN-α和IFN-β的释放,且来自于pSS患者的单核细胞,其释放IFN-α和IFN-β的能力显著高于来自于健康个体的单核细胞(图2A)。此外,我们还发现Poly I:C诱导单核细胞释放IFN-α和IFN-β具有浓度依赖性(图2B)。这些结果表明:Poly I:C刺激下pSS患者单核细胞分泌Ⅰ型干扰素能力增强。
2.3 pSS患者血清可以增强单核细胞对Poly I:C的反应性 我们分析了pSS病人或者健康个体血清对单核细胞释放IFN-α和IFN-β的影响。结果发现:不论是来自健康个体的单核细胞还是来自pSS的单核细胞,在含pSS患者混合血清的培养基中,其释放IFN-α和IFN-β的能力明显增强(与含健康个体血清的培养基相比)。另一方面,不论是以含pSS患者混合血清的培养基,还是以含健康个体血清的培养基进行培养,pSS患者单核细胞释放IFN-α和IFN-β的能力均强于健康个体单核细胞(图3)。这些结果表明:pSS的患者的血清可以增强Poly I:C诱导单核细胞释放IFN-α和IFN-β的能力。
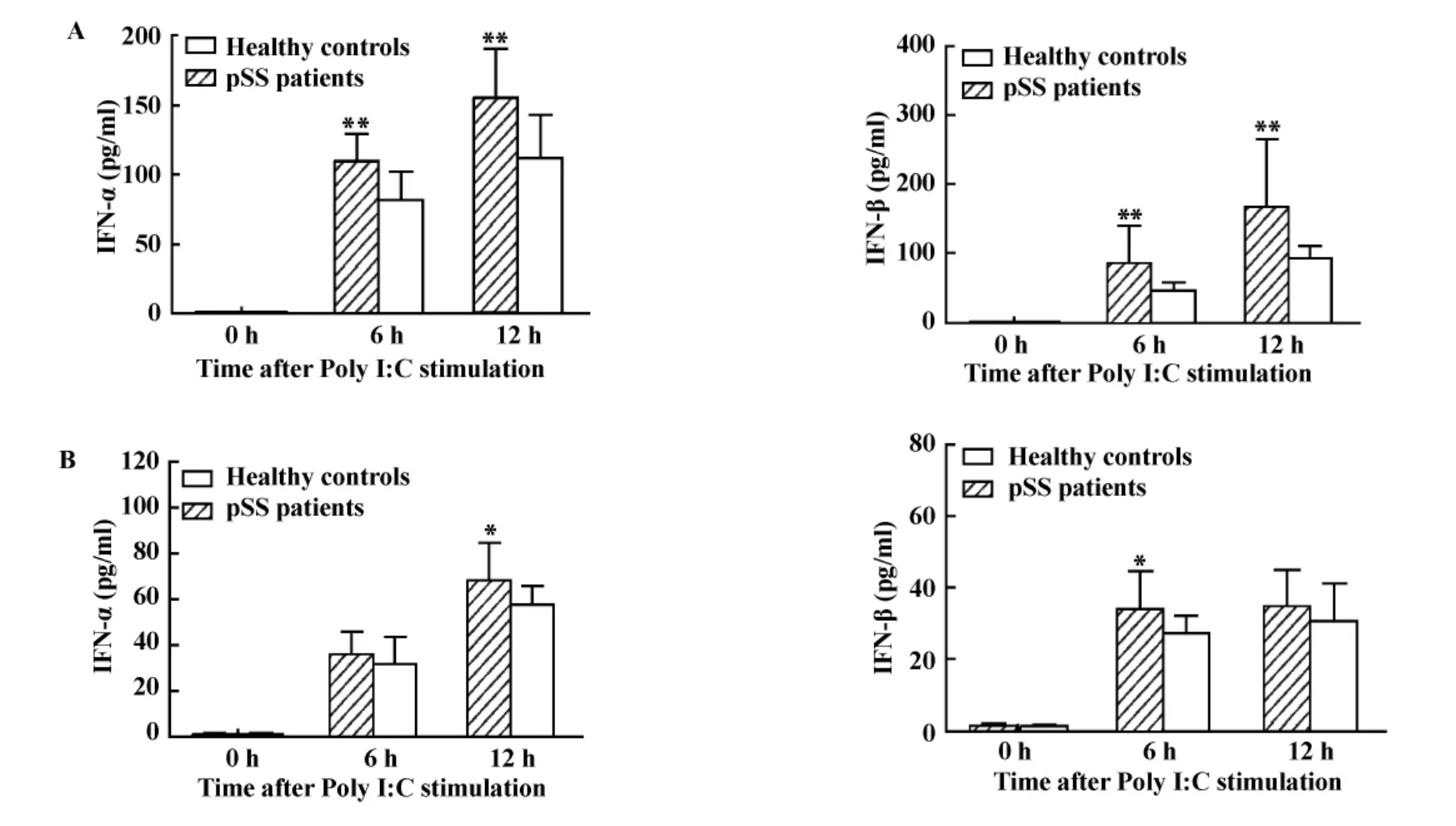
图1 Poly I:C诱导pSS患者和健康个体的外周血PBMCs释放IFN-α和IFN-β(n=14)Fig.1 IFN-α and IFN-β were induced by the peripheral blood cells stimulated with Poly I:C(n=14)
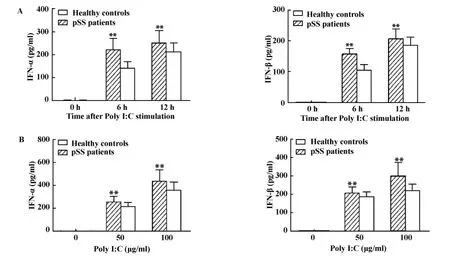
图2 Poly I:C诱导pSS患者和健康个体的单核细胞细胞释放IFN-α和IFN-β(n=14)Fig.2 IFN-α and IFN-β were induced by monocytes stimulated with Poly I:C(n=14)
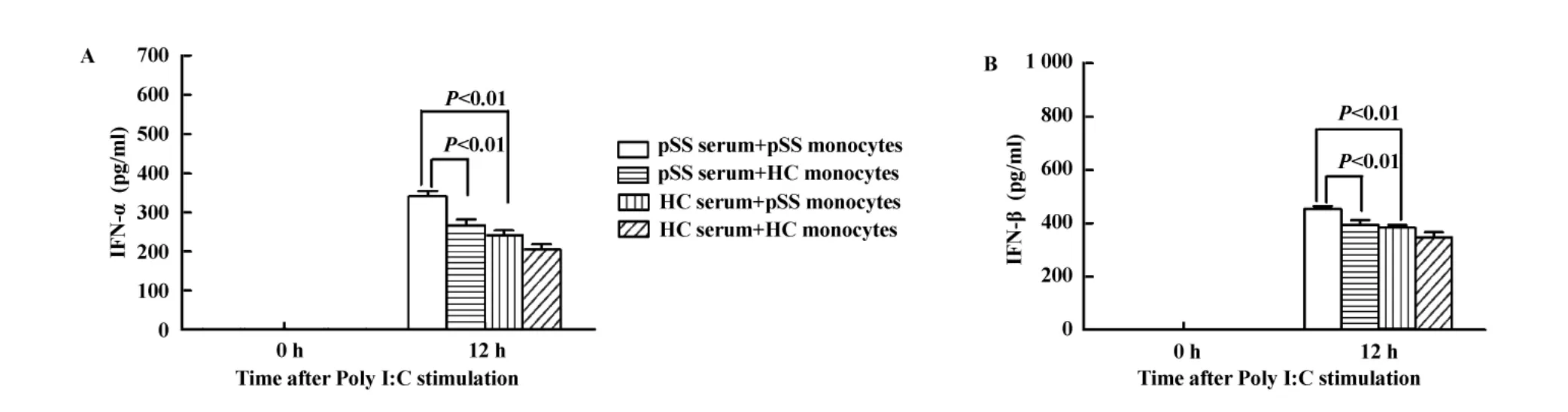
图3 pSS患者血清可以增强Poly I:C诱导单核细胞释放IFN-α和IFN-β的能力(n=4)Fig.3 Serum from pSS patients enhance the production of IFN-α and IFN-β induced by Poly I:C(n=4)
3 讨论
单核细胞是外周血中数量最多的抗原递呈细胞,其细胞表面表达了多种模式识别受体,可以感知外界或者自身的抗原,进而发动针对抗原的免疫炎症反应。已知Poly I:C是一种双链RNA类似物,在抗原递呈细胞上的受体主要是TLR3。Poly I:C通过激活单核细胞内的TLR3可诱导干扰素等多种细胞因子的表达。在正常情况下,这是机体免疫系统应对病毒感染的有力武器,因为干扰素等多种细胞因子不仅具有直接的抑制病毒复制的功能,还可以促进针对病毒的获得性免疫应答过程。然而,Ⅰ型干扰素(包括IFN-α和IFN-β)的产生与释放必需受到精细的调节,失控的Ⅰ型干扰素反应可能会引起组织损伤,甚至自身免疫性疾病[2,9]。
本研究发现,pSS患者的单核细胞对Poly I:C刺激呈现出高反应性,表现在接受Poly I:C刺激后,pSS患者的单核细胞可以释放较多的IFN-α和IFN-β。pSS患者单核细胞的这一异常特性可能与pSS的发生或者发展密切相关。虽然目前对于pSS发生的根本原因尚不清楚,但是已经明确了Ⅰ型干扰素在其发生发展过程中发挥着十分重要的作用[2,7]。此外,研究发现 pSS的发生可能与病毒感染有关[8]。这些已有的研究结果以及本研究提示我们:在外界抗原刺激下,单核细胞过度活化,产生了较高水平的Ⅰ型干扰素可能是pSS发生或者发展的原因之一。
同时,我们还发现,采用pSS患者的血清培养单核细胞本身可以增强Poly I:C诱导IFN-α和IFN-β释放的能力。这表明:在pSS发生或者发展的过程中,单核细胞在pSS的发病进程中,除了固有的“高反应性”这一内因之外,患者血清特有的“辅助活化”功能这一外因仍然不可忽视。
总之,本研究发现pSS患者的单核细胞存在功能异常,且pSS患者的血清可以增强Poly I:C诱导IFN-α和IFN-β释放的能力。提示我们,在pSS的发病进程中,单核细胞发挥着不可忽视的作用,值得深入研究。
1 Fox R I.Sjogren's syndrome[J].Lancet,2005;366(9482):321-331.
2 Mavragani C P,Crow M K.Activation of the type I interferon pathway in primary Sjogren's syndrome[J].J Autoimmun,2010;35(3):225-231.
3 Bave U,Nordmark G,Lovgren T et al.Activation of the type I interferon system in primary Sjogren's syndrome:a possible etiopathogenic mechanism[J].Arthritis Rheum,2005;52(4):1185-1195.
4 Kimoto O,Sawada J,Shimoyama K et al.Activation of the interferon pathway in peripheral blood of patients with Sjogren's syndrome[J].J Rheumatol 2011;38(2):310-316.
5 Gottenberg J E,Cagnard N,Lucchesi C et al.Activation of IFN pathways and plasmacytoid dendritic cell recruitment in target organs of primary Sjogren's syndrome[J].Proc Natl Acad Sci USA,2006;103(8):2770-2775.
6 Hjelmervik T O,Petersen K,Jonassen I et al.Gene expression profiling of minor salivary glands clearly distinguishes primary Sjogren's syndrome patients from healthy control subjects[J].Arthritis Rheum,2005;52(5):1534-1544.
7 Nikolov N P,Illei G G.Pathogenesis of Sjogren's syndrome[J].Curr Opin Rheumatol,2009;21(5):465-470.
8 James J A,Harley J B,Scofield R H.Role of viruses in systemic lupus erythematosus and Sjogren syndrome[J].Curr Opin Rheumatol,2001;13(5):370-376.
9 Sozzani S,Bosisio D,Scarsi M et al.Type I interferons in systemic autoimmunity[J].Autoimmunity,2010;43(3):196-203.
10 Vitali C,Bombardieri S,Jonsson R et al.Classification criteria for Sjogren's syndrome:a revised version of the European criteria proposed by the American-European Consensus Group[J].Ann Rheum Dis,2002;61(6):554-558.
