浙江杨梅品种遗传差异的SRAP分析
2012-11-24喻卫武周明兵王同标
葛 梦,喻卫武,周明兵,王同标,杨 萍*
(1.浙江农林大学林业与生物技术学院,浙江 临安 311300;2.浙江农林大学亚热带森林培育国家重点实验室培育基地,浙江 临安 311300;3.浙江省台州市黄岩区院桥杨梅良种场,浙江 台州 318025)
杨梅(Myrica rubra)特产于中国,主要分布在长江流域以南,海南省以北的山地。浙江、江苏、福建、湖南、江西、广东等省都将其作为重要果树种植,其中以浙江省栽培面积最广且品质最佳[1]。目前,浙江杨梅栽培种主要以东魁、荸荠种、晚稻杨梅、丁岙梅这四大传统良种为主,同时近年来又从自然变异中选育出早荠蜜梅、晚荠蜜梅等新品种[2~3]。虽然这些杨梅品种在果实品质、熟期、叶形、植株形态等性状上有着一定的差异,可以通过农艺性状的比较进行区分[4],但仅从农艺性状上无法了解其分子水平上的遗传差异程度。
近年来,分子标记技术在研究杨梅亲缘关系和遗传多样性上应用广泛[5~11]。相关序列扩增多态性(SRAP)标记是Li等[12]提出的利用特定引物对ORFs区域(Open Reading Frames)进行扩增的新型分子标记,与其它标记比较,其结合了大多数标记的优点:在基因组中分布均匀,简便、稳定、效率较高,是遗传多样性和图谱构建等研究较理想的标记[13]。目前已被应用于多种植物的遗传多样性研究[14~15],但在杨梅的研究中尚未见报道。
本文采用SRAP标记技术评价9个浙江主栽杨梅品种的遗传多样性,以期为杨梅分类和杂交育种的亲本选择提供依据。
1 材料和方法
1.1 材料
以浙江省主要栽培的9个杨梅品种为试验材料(表1),于2011年5月取自台州市黄岩区院桥杨梅良种苗圃。采取各品种生长健壮、无病虫害的嫩叶,于实验室-70℃冰箱保存备用。

表1 试验材料Table1 Materials used in the study
1.2 方法
1.2.1 DNA提取 采用改进的 CTAB法提取杨梅基因组DNA[16],DNA用TE溶解,经紫外分光光度计、0.8%琼脂糖凝胶电泳检测浓度和纯度。将经检验合格的DNA样品定量至100 ng/μL,于-20℃储存备用。
1.2.2 SRAP分析 引物采用Li等[12]发表的引物(表2),由上海Sangon合成。PCR反应体系如下:在20 μL体积中,含60 ng模板DNA;正、反向引物各10 mmol/L;0.2 mol/L dNTPs;2 mmol/L MgCl2;1U Taq DNA聚合酶;1×PCR反应缓冲液。反应条件为:94℃预变性5 min;94℃变性1 min,35℃退火1min,72℃复性1 min,5个循环;94℃变性1 min,50℃退火1 min,72℃复性1 min,35个循环;72℃终延伸10 min;4℃结束保存。PCR产物用2%的琼脂糖凝胶电泳分离检测。
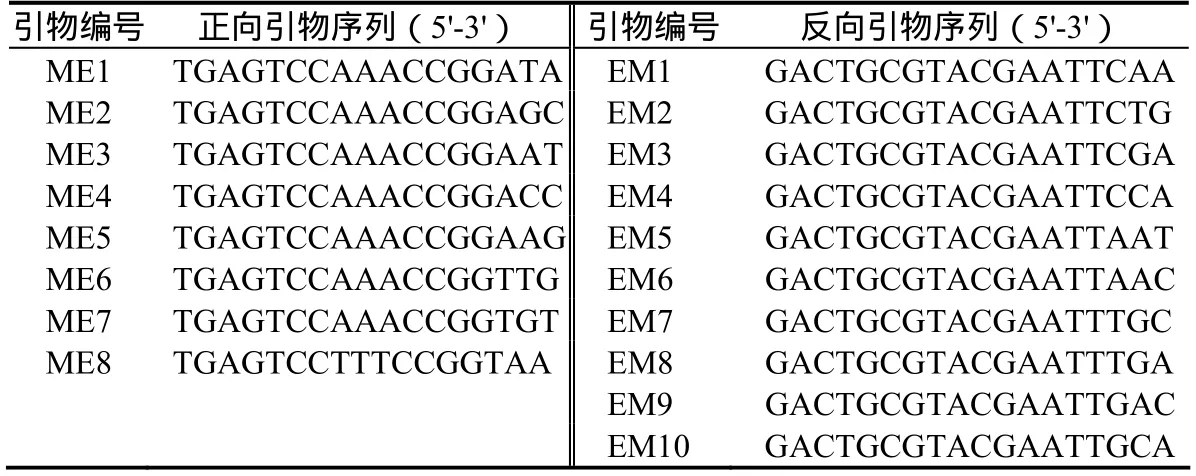
表2 SRAP分析所用引物及其序列Table2 The sequence and primers of SRAP
1.3 数据处理
读取电泳条带,按每个样品电泳条带有或无记录,条带存在时赋值为1,无条带赋值为0。根据Nei-Li相似系数法分别计算各个品种间的遗传相似性系数(GS)和遗传距离(GD, GD = 1-GS),聚类用不加权组平均法进行。用NTSYS-pc软件按照Nei-Li进行作图,对得到的遗传相似性系数矩阵进行相关性分析。
2 结果与分析
2.1 SRAP多态性分析
通过8个正向引物和10个反向引物组成的80个引物组合对供试杨梅品种的DNA进行预扩增,从中筛选了24对多态性好、扩增稳定的引物组合。利用这24对SRAP引物对9个杨梅品种进行PCR扩增分析。图1为引物组合ME6+EM2的PCR扩增产物电泳图。对电泳结果进行统计分析,结果如表3。从表3中可以看到,24对多态性引物共扩增得到157条条带,其中多态性条带121条,平均每对引物产生6.54条条带和5.04条多态性条带。不同的引物组合产生的多态性条带的百分率相差较大,从33.33%到100%不等,平均为75.98%。同时,不同引物组合检测到的SRAP标记的等位变异数不同,ME8+EM3在供试材料中仅检测到2种等位变异,而ME1+EM1、ME4+EM5和 ME5+EM10检测到最多的等位变异数(8种),平均每个引物组合检测到5.33种等位变异。此外,由表3可知,不同引物组合的多态信息含量(PIC)各不相同,24个引物组合的PIC值为0.423 5 ~ 0.856 4,平均0.668 9。

图1 引物组合ME6+EM2的PCR扩增产物琼脂糖凝胶电泳结果Figure1 PCR products from primers ME6 +EM2 by agarose gelelectrophoresis

表3 SRAP引物组合及扩增结果Table3 SRAP primer combinations and amplified bands
2.2 遗传距离和聚类分析
根据遗传相似表(表4),9个样品的遗传系数为0.523 2 ~ 0.860 9,表明各个样本之间存在着较为广泛的遗传多样性,品种间的变异较为丰富。其中亲缘关系最近的是早荠蜜梅和晚荠蜜梅以及黑晶和黄岩水梅,最远的是晚稻杨梅和黄岩水梅。
根据UPGMA聚类的结果(图2),在遗传相似系数为0.77时,可将9个杨梅品种分为3类。其中黄岩水梅、黑晶、早荠蜜梅、晚荠蜜梅、早大梅、东魁聚为一类;其余样品均单独聚为一类。浙江省的传统4大良种——东魁、荸荠种、丁岙梅、晚稻杨梅分别位于不同的大类中。

图2 9个杨梅品种聚类图Figure2 Dendrogram of 9 M.rubra cultivars

表4 9个杨梅材料的遗传相似表Table4 Genetic similarity matrix of 9 Myrica rubra cultivars based on SRAP
3 结论
本文采用SRAP标记技术对9个浙江主栽的杨梅品种进行遗传差异研究,从80对引物中筛选出24对多态性引物进行PCR扩增。共扩增出157个位点,其中多态性位点121个,从分子水平基本反映了这些品种的亲缘关系的远近程度,证实了浙江杨梅主栽品种具有比较丰富的遗传多样性,该结果可以为杨梅分类、杂交育种研究的亲本选择等提供参考依据。
4 讨 论
4.1 供试样品间的遗传关系与新品种选育
本研究利用24对SRAP引物对浙江省主要的9个杨梅品种进行遗传差异研究,其遗传系数为0.523 2 ~ 0.860 9,各对引物的多态信息含量(PIC)平均达到0.738 4,表明9个杨梅品种间存在比较丰富的遗传差异,这与前人用RAPD、ISSR等标记得到的结果类似[6,10]。
SRAP聚类分析表明供试杨梅材料的遗传相似程度与原产地地理分布相关。供试样品中东魁、荸荠种、晚稻杨梅和丁岙梅是浙江省主要栽培的四大传统良种[4],栽培历史悠久,并各自分属于台州黄岩、宁波慈溪、舟山定海和温州瓯海的地方品种,原产地的地理分布相对独立。在用UPGMA方法聚类时,于遗传相似系数0.80处,均被归为不同的类,这与林伯年等[7]利用ISSR标记和张水明[11]利用SSR标记分析得到的结果相符。黄岩水梅、黑晶、早大梅、东魁均是台州地区的品种[4],在聚类图中集中分布,遗传距离比较近。早荠蜜梅和晚荠蜜梅都是由荸荠种中选育的良种,在聚类图上两者的遗传距离非常近,但与荸荠种的遗传距离较远,甚至位于不同的大组中;张水明利用SSR标记得到的结果也显示早荠蜜梅、晚荠蜜梅和荸荠种杨梅的亲缘关系较远,并认为可能由于他们变异的来源不同导致:早荠蜜梅为荸荠种的实生早熟变异,晚荠蜜梅为荸荠种的晚熟营养系变异[11]。
根据遗传相似系数和聚类得到的结果,在进行杨梅杂交育种时可根据育种目标选择具有不同优良性状且遗传差异较大的品种作为父母本。
4.2 SRAP在杨梅中的可行性分析
24对多态性引物共扩增出121条多态性条带,平均5.08条,且单引物最多能产生8条多态性条带,这与M Ferriol等[14]在甜瓜、林忠旭等[15]在棉花研究中得到的结果相当。试验结果显示SRAP在杨梅中扩增得到的条带清晰,产率较高,可以在杨梅中产生较好的多态性。
SRAP扩增ORFs区域是基因序列的重要组成部分,也是产生不同品种间差异的重要因素[17]。SRAP技术在育种目标性状的评价方面明显优于RAPD标记[18],有较高的多态性标记比率[15],是一个评价遗传多样性、品种鉴定和系统发生的有效工具[19]。本研究结果显示SRAP标记的聚类结果与品种来源的地域基本吻合,说明利用SRAP标记评价杨梅品种的遗传多样性是可行的,并且可以通过扩大引物对数和供试杨梅品种数,在分子水平上为杨梅各品种的指纹图谱构建、种质资源的鉴定、筛选和利用等提供理论依据。
[1]缪松林,王定祥.杨梅[M].杭州:浙江科学技术出版社,1987.17-40.
[2]戚行江,梁森苗,郑锡良, 等.特早熟杨梅新品种‘早荠蜜梅’[J].园艺学报,2003,30(6):759.
[3]戚行江, 梁森苗, 郑锡良,等.优质晚熟杨梅新品种‘晚荠蜜梅’[J].园艺学报,2004,31(1):136.
[4]郑勇平.杨梅[M].北京:中国林业出版社,2002.21-23.
[5]邱英雄,傅承新,孔航辉.杨梅不同品种的ISSR分析[J].农业生物技术学报,2002,10(4):343-346.
[6]钱剑林,俞文生,王化坤,等.江浙地区杨梅主要品种的ISSR分析[J].植物资源与环境学报,2006,15(3):17-20.
[7]林伯年,徐林娟,贾春蕾.RAPD技术在杨梅属植物分类研究中的应用[J].园艺学报,1999,26(4):221-226.
[8]潘鸿,何新华,李一伟,等.广西野生杨梅资源遗传多样性的ISSR分析[J].果树学报,2008,25(3):353-357.
[9]谢小波,求盈盈,戚行江,等.杨梅雌、雄种质遗传关系的RAPD和ISSR分析[J].果树学报,2008,25(2):198-202.
[10]谢小波,求盈盈,戚行江,等.浙江杨梅品种遗传差异的RAPD和ISSR分析[J].浙江农业学报,2008,20(1):1-5.
[11]张水明.基于AFLP和SSR分子标记的中国杨梅遗传多样性分析[D].杭州:浙江大学,2009.
[12]Li G, Quiros C F.Sequence-related amplified polymorphism (SRAP), a new markers system based on a simple PCR reaction: Its application to mapping and gene tagging in Brassica[J].Theor Appl Genet, 2001, 103(2~3): 455-461.
[13]谭碧玥,王源秀,徐立安.分子标记SRAP及其在林木研究中的应用[J].世界林业研究,2009,22(5):44-50.
[14]Ferriol M, Pico B, Nuez F.Genetic diversity of a germplasm collection of cucurbita pepo using SRAP and AFLP markers[J].Theor Appl Genet,2003, 107(2): 271-282.
[15]林忠旭,张献龙,聂以春.新型标记SRAP在棉花F2分离群体及遗传多样性评价中的适用性分析[J].遗传学报,2004,31(6):622-626.
[16]孙志栋,柴春燕,袁妮娜,等.杨梅基因组 DNA提取方法筛选和优化研究[J].生物技术通报,2007(6):105-112.
[17]李慧芝,尹燕枰,张春庆,等.SRAP在葱栽培品种遗传多样性研究中的适用性分析[J].园艺学报,2007,34(4):929-934.
[18]Ferrol M, Pico B, Cordava P F.Molecular diversity of a germplasm collection of sqash (Cucurbita moschata) determined by SRAP and AFLP makers[J].Crop Sci, 2004(44): 653-664.
[19]Budak H, Shearman R C, Parmaksiz I.Molecular characterization of Buffalograss germplasm using sequence-related amplified polymorphism markers[J].Theor Appl Genet, 2004, 108(2): 328-33.
