麦胚蛋白水解物抗氧化活性及其作用模式
2012-11-23张丽萍毛晶晶刁静静
张丽萍 毛晶晶 刁静静 王 雪
麦胚蛋白水解物抗氧化活性及其作用模式
张丽萍1,2毛晶晶2刁静静1王 雪2
(黑龙江省农产品加工工程技术研究中心1,大庆 163319)
(黑龙江八一农垦大学食品学院2,大庆 163319)
采用中性蛋白酶水解麦胚蛋白0.5~6 h,测定水解物的DH(degree of hydrolysis)、硫代巴比妥酸值(TBARS值)、POV值(Prroxide value)、Cu2+螯合能力、二苯代苦味肼基自由基清除能力(DPPH自由基)。结果表明,麦胚蛋白水解度随着水解时间的延长而增加;水解物5 h与未水解的蛋白及0.02%VC相比,在大豆卵磷脂脂质氧化体系(Liposome体系)中具有较强的抑制脂质氧化的能力,还具有较强的Cu2+螯合能力和清除自由基能力,未水解的蛋白具有较弱的抗氧化能力;通过对未水解的麦胚蛋白及不同浓度蛋白水解物的抗氧化指标测定和分析,认为水解物的抗氧化活性与蛋白本身的结构、肽链长短及氨基酸残基有关。
麦胚蛋白 水解 抗氧化活性
小麦是我国主要粮食作物之一,年产量在1亿吨以上[1]。麦胚是小麦加工的副产物,其中蛋白质含量高达30%以上,而且麦胚蛋白是一种完全蛋白,含有人体必需的8种氨基酸[2],还蕴含着许多具有生物活性的氨基酸序列。肽类尤其是一些小分子肽不仅有比蛋白质更好的消化吸收性能,还具有诸如对人体的生理调节和防病抗病的生理机能,如乳清蛋白[3]、牛乳酪蛋白[4]、鱼蛋白[5]、蛋黄蛋白[6]、猪肉蛋白[7]、胶原蛋白[8]、大豆蛋白[9]等蛋白的水解物。目前对于麦胚生物活性肽的研究已经很多,Toshiro等[10]对脱脂麦胚先后进行了3%α-淀粉酶酶解3 h及0.5%碱性蛋白酶酶解8 h,酶解物经YMCAODS、AG50W-X8阳离子交换及HPLC分离纯化后得到了16种2~7个氨基酸残基的降血压活性肽。辛志宏等[11]用碱性蛋白酶水解小麦胚芽蛋白得到的水解物对血管紧张素转化酶也有较强的抑制活性,水解物经Sephadex G-15纯化、制备RP-HPLC分离,得到一种对ACE有强烈抑制作用的组分,其序列为Ala-Met-Tyr。程云辉等[12]对麦胚抗氧化肽水解用酶进行了筛选,最终得出碱性蛋白酶Proleather FG-F是制备麦胚抗氧化肽的最适水解酶。综上所述,对于麦胚蛋白水解物抗氧化和降血压活性研究的较多,但是对于麦胚蛋白水解物抗氧化活性的机理探讨很少。
本研究对不同浓度的麦胚蛋白水解物进行硫代巴比妥酸反应物值(TBARS值)、过氧化物值(POV值)、Cu2+螯合能力、DPPH自由基清除能力进行了测定,探讨了麦胚蛋白水解物的抗氧化机制。
1 材料与方法
1.1 材料
麦胚蛋白:北大荒丰缘麦业有限责任公司;中性蛋白酶(60 000 U/g):NOVO公司;大豆卵磷脂、抗坏血酸钠、二苯代苦味肼基自由基(DPPH):Sigma公司;抗坏血酸(VC)、组氨酸:北京索莱宝科技有限公司;硫酸铜、吡啶、硫代巴比妥酸、氯仿:均为分析纯,大庆市隆宽试剂有限公司。
DK-S24型电热恒温水浴锅:上海森信试验仪器有限公司;DELTA320型pH计:梅特勒-托利多仪器有限公司;AR2140电子天平:奥豪斯国际贸易(上海)有限公司;LD4-1.8台式离心机:北京京立离心机有限公司;JJ-1精密增力电动搅拌器:江苏省金坛市金城国胜实验仪器厂。
1.2 方法
1.2.1 麦胚蛋白的制备
首先采用正己烷去除麦胚中的小麦胚芽油,将脱脂后的小麦胚芽用粉碎机粉碎过后过100目筛,称取50 g小麦胚芽粉加入500 mL蒸馏水,称5 g NaCl用少量水溶解后加入上述溶液中,调至pH 9.0,用磁力搅拌器搅拌30 min,再于5 000 r/min离心10 min,取上清液,在水浴锅中保温至65℃,调至pH 6.3,加入0.3%的α-淀粉酶,水解3 h,调至pH 4.0,待沉淀完全后,二次离心10 min,取沉淀,用蒸馏水溶解并调至pH 7.0,透析脱盐,干燥备用[11]。所提蛋白质量分数为95%。
1.2.2 麦胚蛋白水解物的制备
将麦胚蛋白与适量的水混合,配制成质量分数分别为2%、5%和8%的样品溶液,用1 mol/L的NaOH调节溶液pH 7.0,加人一定量的中性蛋白酶,于50℃水浴下振荡水解,反应过程中不断加入1 mol/L的NaOH,使pH保持恒定,记录耗碱量,用于计算水解度。待水解结束后在搅拌条件下迅速升温至95℃,保持10 min使酶灭活。
1.2.3 水解度的测定(degree of hydrolysis,DH)
水解度的测定采用pH-Stat法[13],水解度的计算公式按下式计算:

式中:h为单位质量蛋白质中被水解的肽键的量/mmol/g;htot为单位质量蛋白质中肽键的总量/mmol/g,麦胚蛋白htot=8.3 mmol/g;V为水解过程中所消耗的碱量/mL;cb为碱液的浓度/mol/L;m为水解液中蛋白质的质量/g;1/α为校正系数,中性蛋白酶的1/α=1.40。
1.2.4 大豆卵磷脂脂质氧化体系的制备
为了研究麦胚蛋白水解的抗氧化性能,用大豆卵磷脂脂质氧化体系模拟脂肪氧化体系,其制备方法参照Decker等[14]的方法,稍作修改。称取一定量的大豆卵磷脂溶于0.12 mol/L KCl,0.005 mol/L组氨酸缓冲溶液(pH 6.8)中,制成含有2 mg/mL卵磷脂的溶液,均质,并用超声波在4℃下超声处理45 min。然后取5 mL的卵磷脂脂质体,加入1 mL麦胚蛋白水解物,向脂质体和蛋白水解液的混合物中加入0.1 mL 0.05 mol/L FeCl3和0.1 mL 0.01 mol/L抗坏血酸钠引发脂质氧化,然后将样品放在37℃水浴中保温1 h,通过测定TBARS值脂肪氧化情况。
1.2.5 TBARS值的测定
参照Sinnhuber等[16]的方法,做适当的修改。取1 mL样品加入2 mol/L 3 mL硫代巴比妥酸溶液、20 mmol/L 17 mL三氯乙酸 - 盐酸溶液,混匀后,沸水浴中反应30 min,冷却,取5 mL样品加入等体积的氯仿,3 000 r/min下离心10 min,532 nm下读取吸光值。TBARS值以每升脂质氧化样品溶液中丙二醛

式中:A532为溶液的吸光值;Vs为样品的体积;9.48为常数。
1.2.6 POV值的测定
参照Kong[16]的方法,1 mL的Liposome样品与10 mL的醋酸/氯仿(3∶2)混合,混匀后加入0.3 mL饱和碘化钾,摇匀,加入30 mL蒸馏水和0.3 mL的0.1%的淀粉指示剂。用2 mmol/L硫代硫酸钠滴定,直到蓝色消失。没加Liposome的作为空白。计算公式如下:

式中:S为滴定样品所消耗的硫代硫酸钠/mL;V为滴定空白样品所消耗的硫代硫酸钠/mL;C为硫代硫酸钠的浓度/mmol/L;Vs为样品的量/mL。
1.2.7 Cu2+螯合能力
参照Wang[17]等的方法,用邻苯二酚紫(PV)作为金属螯合指示剂。向1 mL 2 mmol/L的CuSO4溶液、1 mL 10%的吡啶与20μL 10%的PV混合物中添加1 mL的麦胚蛋白水解物,PV与CuSO4结合形成蓝色物质,在有螯合剂存在时PV与Cu2+离子分离,溶液蓝色消失。PV溶液颜色的变化可以在632 nm处测量。
麦胚蛋白水解物对金属离子的螯合作用可按下式计:
螯合作用=[1-(A样品/A空白)]×100%
1.2.8 DPPH自由基清除能力
参照Zhang等[18]的方法,稍作修改。取样品溶液2 mL加入2 mL 0.1 mmol/L的DPPH溶液,用2 mL 95%乙醇溶解0.1 mmol/L DPPH作为对照,在室温下避光反应30 min,测定517 nm的吸光值,同时以乙醇为空白,所有测定值均为3次平均值,DPPH自由基清除率按下式计算:
DPPH·抑制率=[1-(A样品/A对照)]×100%
1.2.9 统计分析
采用Sigmaplot 9.0软件作图,数据统计采用Statistix 8.1软件中Linear Models程序进行,差异显著性(P<0.05),分析使用Turkey HSD程序。试验结果均为3次测定结果的平均值。的毫克数数表示。计算公式如下:
2 结果与分析
2.1 不同质量分数麦胚蛋白的水解度
图1反映的是不同质量分数麦胚蛋白的水解度,通常用水解度DH来反映蛋白质酶解过程中肽键的断裂程度[12]。从图1可知,水解度随着水解时间的延长而增加,到6 h时,2%,5%和8%麦胚蛋白的水解度分别达到了18.3%,18.01%和15.4%。水解初期水解度迅速增加,到5 h后水解度增加不显著(P>0.05)。而且水解度随着质量分数的增加而降低,在反应初期,不同质量分数麦胚蛋白的水解度差异显著(P<0.05),尤其是0.5~3 h之间,到了4 h后,2%和5%之间的水解度差异不显著(P>0.05),这可能是由于蛋白质量分数的增加使得酶与底物之间的作用范围变大的结果[15]。

图1 不同质量分数麦胚蛋白的水解产物的水解度
2.2 不同质量分数麦胚蛋白的水解产物对Liposome脂质氧化体系的抑制能力
图2是不同质量分数麦胚蛋白的水解产物对脂质氧化体系抑制能力的测定结果。从图2可知,麦胚蛋白水解物在Liposome脂质体系中的抑制能力随着质量分数的增加而增加,而且随着水解时间的延长,水解物的抑制能力逐渐增强,其中在5 h时的抑制能力达到最强,与未水解蛋白的TBARS值相比较,差异显著(P<0.05),其抗氧化能力也明显强于0.02%VC的(P<0.05)。Hirose等[19]研究中假设蛋白水解物可以在脂质粒的外边形成一层保护膜使其不被氧化,所以麦胚蛋白之所以具有抗氧化能力,可能是由于麦胚蛋白水解后一些两性的、有活性的小肽,以及一些麦胚蛋白残基容易扩散在水-油体系的外边,这些物质可以吸收或者是与Liposome体系中的磷脂膜紧密结合,从而达到抗氧化的能力。在6 h时的抑制能力有所减弱,这是因为经过长时间水解,蛋白质分解成更小分子的肽,这些小肽不足以包裹Liposome体系中的磷脂膜,从而影响抗氧化效果。8%水解物的抗氧化能力比2%的水解产物强,与5%水解物的抗氧化能力差异不显著(P>0.05)。这是由于随着底物浓度的增加,酶与底物充分接触,肽键断裂的多,得到的具有抗氧化性的小肽相对比较多,而随着底物浓度的继续加大,酶与底物之间的结合达到相对平衡[20]。通过TBARS值指标的测定得出5%的麦胚蛋白在5 h时的水解产物具有较强的抗氧化能力。

图2 不同质量分数麦胚蛋白的水解产物对脂质氧化体系的抑制能力
2.3 POV值的测定
图3是不同质量分数麦胚蛋白的水解产物对卵磷脂体系中POV值的测定结果。由图3可知麦胚蛋白水解物在Liposome体系中的POV值随着水解物的水解时间呈明显的降低趋势(P<0.05),随着质量分数的增加POV值显著降低(P<0.05),与0.02%VC相比,0.5 h后的水解产物的POV值都显著低于VC的,这就说明麦胚蛋白水解物具有显著的抗氧化能力,从图3中也可以看出5 h的水解产物具有较强的抗氧化能力,8%麦胚蛋白的水解产物与5%麦胚蛋白的水解产物相比,抗氧化能力差异不显著(P>0.05),与2%的麦胚蛋白的水解产物相比差异显著(P<0.05),检测结果与以上的TBARS值的测定结果一致。
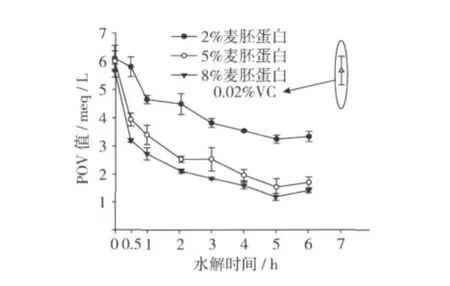
图3 不同质量分数麦胚蛋白的水解产物对POV值的影响
2.4 Cu2+螯合能力
图4是不同质量分数麦胚蛋白水解物对Cu2+螯合能力的测定结果。由图4可以看出,麦胚蛋白水解物具有Cu2+螯合能力,未水解的麦胚蛋白基本上不具有铜离子螯合能力,到5 h时,5%的水解物的螯合能力达到了57%,显著高于0.02%VC(Cu2+螯合能力为18%)。而且铜离子螯合能力随着水解时间的延长呈递增的趋势,随着底物浓度的增加而增强,5%和8%的麦胚蛋白水解物金属螯合能力差异不显著(P>0.05),到6 h时,金属离子的螯合能力明显降低(P<0.05)。研究表明肽的螯合能力与他的抗氧化能力有关[21],这是由于随着水解时间的延长,浓度的增加,肽链的断裂增加了羧基的含量,提高了Cu2+与羧基的结合,进而消除了脂质体系中的游离Cu2+离子。
2.5 DPPH自由基清除能力
图5是不同质量分数麦胚蛋白在不同水解时间下的水解产物对DPPH自由基清除能力的测定结果。麦胚蛋白水解物的清除自由基能力以测定DPPH·清除能力为指标,DPPH·是稳定的基团,并且反应程度取决于抗氧化剂的供氢能力,反应溶液颜色由紫色变为黄色,这表明麦胚蛋白水解物具有DPPH自由基清除能力。由图5可以看出,DPPH·清除能力从0.5 h后显著增加(P<0.05),到5 h时,2%、5%和8%麦胚蛋白的水解产物的清除能力从0 h(0 h水解产物即未水解的麦胚蛋白)的19%、23%和25%分别达到了57%、61%和67%,这就说明未水解麦胚蛋白也具有一定的抗氧化活性。3 h开始到5 h,水解物的自由基清除能力差异不显著,与0.02%VC相比差异不显著(P>0.05)。到6 h时,水解物的自由基清除能力又有所降低,这可能由于肽分解成更小分子质量的肽或者是游离氨基酸,减少了其作为氢供体的极性。

图5 不同质量分数麦胚蛋白水解物的DPPH自由基清除能力
2.6 讨论
蛋白多肽的抗氧化活性受很多因素的影响,水解物所表现出的抗氧化作用包含复杂的反应机制,除了能在油脂外层形成包膜外,还包含了电子/氢供体、自由基清除、及金属离子螯合等其他抗氧化机制。图6是麦胚蛋白水解物抗氧化机制的一个模型[16],麦胚蛋白水解物具有抗氧化能力与其自身的蛋白结构也有很大关系,尤其是麦胚蛋白含有谷胱甘肽(GSH),谷胱甘肽是一种具有生物活性的天然三肽,在麦胚中的含量为98~107 mg/g[22]。未水解的麦胚蛋白由于其结构紧密而抗氧化能力比较小,通过中性酶水解后打破了麦胚蛋白的紧密结构,从而形成了一个开放的、暴露的氨基酸残基,可与氧化物反应。

图6 麦胚蛋白水解物抗氧化反应机制
通过图1和图2也可以看出,蛋白的水解度与抗氧化能力不呈正相关,而是与其在一定水解度条件下形成的特定结构有关(如肽链的长度、不同游离氨基酸的比例等等),Kong等[16]认为水解打破了蛋白本身的紧密结构,使氨基酸残基充分暴露出来,围绕在脂肪球表面以防止其被氧化。水解后的小肽可更好的吸附或松散的结合到发生氧化作用脂质的磷脂膜表面,更好的扩散到水油界面起到抗脂质氧化的作用;同理,作为保护膜,小肽的蛋白结构必须具有一定的完整性,过度的水解可能会降低肽的稳定性,同时,小肽作为阻止自由基进入脂质中脂相的物理屏障作用也会降低[16,20]。这就解释了为什么在一定水解度条件下抗氧化能力较强的原因。
过渡期的金属元素Cu2+能催化氧化反应的发生,如羟自由基(·OH)和超氧自由基(O2·-)以及不饱和脂肪的氧化[23-24]。肽具有螯合能力可能是由于随着水解时间的延长,浓度的增加,肽链的断裂增加了羧基的含量,提高了Cu2+与羧基的结合,进而消除了Liposome体系中的游离金属离子[16],而本研究结论证实了这一假设。Chen等[25]的研究显示大豆蛋白水解物的抗氧化能力与蛋白酶水解后的肽链中氨基酸的排列顺序及某些特殊氨基酸残基有关。
油脂的氧化是脂肪酸在和空气中的氧在室温下,未经任何直接光照,未加任何添加剂等条件下的完全自发的氧化反应,随着反应的进行,其中间状态及初级产物又能加快其反应速度,故又成为自动催化氧化。即RH(脂肪酸)经氧化反应形成R·,麦胚蛋白水解物的抗氧化机理在于水解后形成的麦胚蛋白残基—COOH中的H作为供体与脂肪酸氧化后的R·相互结合,形成新的RH,水解后的两个麦胚蛋白残基相互结合,从而达到阻止氧化反应的发生[26]。
3 结论
本研究通过对不同质量分数麦胚蛋白的水解产物的DH、TBARS值、Cu2+螯合能力及DPPH自由基清除能力等体外活性指标进行测定,确定了麦胚蛋白水解物具有较强的抗氧化能力,其抗氧化能力比0.02%VC强,而且对各个测定指标进行分析,对麦胚蛋白水解物的抗氧化机有了大致的了解,但对于其体内活性的测定还有待于进一步研究。从所测定的抗氧化指标综合来看,中性蛋白酶水解底物浓度为5%的麦胚蛋白,水解产物的TBARS值达到了0.27 mg/L左右,说明水解物具有较高的抗氧化活性,而且具有BHA、BHT等抗氧化剂所不具有的Cu2+螯合能力;DPPH自由基清除能力达到了60%。
[1]朱天钦.制粉工艺与设备[M].成都:四川科学技术出版社,1998
[2]杨月欣.中国食物成分表[M].北京:北京大学医学出版社,2004
[3]Pena-Ramos E A,Xiong Y L.Antioxidative activity of whey protein hydrolysates in a liposomal system[J].Journal of Dairy Science,2001,84:2577-2583
[4]Miguel M,Contreras M M,Recio I,et al.ACE-inhibitory and antihypertensive properties of a bovine casein hydrolysate[J].Food Chemistry,2009,12:211-214
[5]Wu H C,Chen H M,Shiau C Y.Free amion acids and peptides as related to antioxidant properties in protein hydrolysates of mackerel(Scomber austriasicus)[J].Food research international,2003,36:949-957
[6]Sakanaka S,Tachibana Y.Active oxygen scavenging activity of egg-yolk protein hydrolysates and their effects on lipid oxidation in beef and tuna homogenates[J].Food Chemistry,2006,85:243-249
[7]Carlsen CU,Rasmussen K T,Kjeldsen K K,et al.Pro-and antioxidative activity of protein fractions from pork(Longissimus dorsi)[J].European Food research and technology,2003,217:195-200
[8]Kim SK,Kim Y Y,Byun K S,et al.Isolation and characterization of antioxidative peptides from gelatin hydrolysate of Alaska Pollack skin[J].Journal of Agriculture and Food Chemistry,2001,49:1984-1989
[9]王进,何慧,隋玉杰,等.玉米肽、大豆肽及其复配肽的降血压活性比较[J].中国粮油学报,2007(1):45-47,72
[10]Toshiro M,Chun H L,Yutaka O.Preparation and characterization of novel bioactive peptides responsible for angiotensin I converting enzyme inhibition from wheat germ[J].Journal of Peptide science,1999(5):289-297
[11]辛志宏,马海乐,吴守一,等.从小麦胚芽蛋白中分离和鉴定血管紧张素转化酶抑制肽的研究[J].食品科学,2003,24(7):130-133
[12]程云辉,文新华,王璋.麦胚抗氧化肽水解用酶的筛选研究[J].中国粮油学报,2007(3):29-33
[13]Alder-Nissen J.Enzymic hydrolysis of Food protein[D].London:Elsevier Applied Science,1986
[14]Decker E A,Hultin H O.Factors influencing catalysis of lipid oxidation by the soluble fraction of mackerel muscle[J].Journal of Food Science,1990,55:947-950,953
[15]Sinnhuber R O,Yu T C.2-Thiobarbituric acid method for the measurement of rancidity in fishery products.Ⅱ.The quantitative determination of malonaldehyde[J].Food Technology,1958,12:9-12
[16]Kong B H,Xiong Y L.Antioxidant activity of zein hydrolysates in a liposome system and the possible mode of action[J].Journal of Agricultral and food chemistry,2006,54:6059-6068
[17]Wang L L,Xiong Y L.Inhibition of lipid oxidation in cooked beef patties by hydrolyzed potato protein is related to its reducing and radical scavenging ability[J].Journal of Agricultural and Food Chemistry,2005,53:9186-9192
[18]Zhang SB,Wang Z,Xu SY.Antioxidant and antithrombotic activities of rapeseed peptides[J].Journal of the American Oil Chemists Society,2008,85:521-527
[19]Hirose A,Miyashita K.Inhibitory effect of proteins and their hydrolysates on the oxidation of triacylglycerols containing docosahexaenoic acids in emulsion[J].Journal of Food Science Technology,1999,46:799-805
[20]刘骞,孔保华,刁静静.酶水解制备猪血浆蛋白抗氧化肽工艺参数的优化[J].食品工业科技,2009,2:166-173
[21]Kitts D D.Antioxidant properties of casein-phosphopeptides[J].Trends in Food Science&Technology,2005,16:549-554
[22]单良.麦胚凝集素的分离纯化及功能特性研究[D].无锡:江南大学,2004
[23]Stohs SJ,Bagchi D.Oxidative mechanisms in the toxicity of metal ions[J].Free Radical Biology and Medicine,1995,18:321-336
[24]Frankel E N.Lipid Oxidation[M],2nd ed.Dundee:The Oily Press,2005
[25]Chen H M,Muramoto K,Yamauchi F.Structural analysis of antioxidant peptides from soybeanβ-conglycinin[J].Journal of Agricultural and Food Chemistry,1995,43:574-578
[26]阚健全.食品化学[M].北京:中国农业大学出版社,2002.
Study on Antioxidant and Mechanism of Wheat Germ Hydrolysates
Zhang Liping1,2Mao Jingjing2Diao Jingjing1Wang Xue2
(Agri- F ood processing Development centre of Heilongjiang1,Daqing 163319)
(College of Food Science,Heilongjiang August First Land Reclamation university2,Daqing 163319)
Wheat germ protein was hydrolyzed for 0.5~6 h by neutral protease,and degree of hydrolysis(DH)increased with hydrolysis time.Wheat germ protein hydrolysates's DH,Thiobarbituric acid-reactive substance values,peroxide,Cu2+chelation ability and radical-scavenging ability were mensurated.The result demonstrated that neutral protease-hydrolyzed wheat germ protein exhibited a stronger antioxidant activity than non-hydrolyzed protein and 0.02%VC,as indicated by peroxide and TBARSvalues in a liposome-oxidizing system.And possess strong Cu2+chelation ability and radical-scavenging ability.Antioxidant mechanism of hydrolysates was analyzed,as what antioxidant index of non-hydrolyzed wheat germ protein and hydrolysates with different concentration were mensurated.The antioxidant effectiveness of the protein hydrolysates appeared to depend on specific structure,type of peptides,and ratio of different freed amino acids.
wheat germ protein,hydrolysis,antioxidant activity
TQ936.1
A
1003-0174(2012)06-0014-06
黑龙江省科技攻关计划(NB08B004)
2011-04-07
张丽萍,女,1957年出生,教授,博士生导师,食品科学
