酒依赖渴求理论及其神经环路机制的研究进展☆
2012-11-23钟程胡建
钟程 胡建
据一项调查显示,54%~72%的酒依赖患者存在对酒精强烈的渴望感,尤其是在临床治疗初期到恢复期的前12个月[1]。渴求对于酒依赖的临床治疗有着非常重要的意义,但关于其理论假说及神经环路机制方面的研究结果不一。本文总结了近几年的酒依赖渴求形成机制(mechanism of craving in alcohol⁃dependent)假说及其神经环路,归纳了酒依赖渴求形成过程中可能潜在的神经传导通路。
1 酒依赖渴求形成机制的假设
酒依赖患者停饮后渐出现戒断症状,如:焦虑、抑郁、无愉快感等。负性强化理论(negative reinforcement mechanism)推测嗜酒者为了防止发生戒断症状,产生强烈的饮酒渴求,使酗酒行为强化[2]。而正性强化理论(positive reinforcement mechanism)推测酗酒行为的维持是为了 “寻求快乐”,体验愉悦感[2]。Robinson等提出不同的精神活性物质所致成瘾可能存在着共同的神经环路(多巴胺神经环路)[2]。也就是说反复饮酒增加了环路中多巴胺递质的释放,唤起饮酒者的主观愉快感,产生饮酒渴求。无论是正性/负性强化理论,还是动机敏感化理论(an incentive⁃sensitization theory),只假设了渴求发展到特定阶段的特征,在解释酒依赖渴求形成机制时仍存在着局限性。
以往的酒依赖渴求形成机制假说,学者们通常将其视为中枢神经系统对奖赏系统的一种负性强化。而Koob等认为负性、正性强化理论不足以解释酒依赖患者戒断后的饮酒渴求,因此提出稳态应变模式理论(allostatic model),并在学说中重新修定了奖赏系统 (reward system)和反奖赏系统(antireward system)的概念,奖赏系统主要包括多巴胺系统、内啡肽、脑啡肽系统;反奖赏系统主要包括促肾上腺皮质激素释放素系统、阿片系统、去甲肾上腺素系统[3]。稳态应变模式理论假设酒依赖者中枢神经系统为了适应成瘾状态,不断对抗戒断反应,不断调节奖赏/反奖赏系统,从而达到一个新的稳定模式,但此平衡点已不是成瘾前的水平和状态[4]。早期愉悦感产生的饮酒渴求,为奖赏系统正性强化,导致习惯性饮酒行为;后期戒断症状引发的焦虑、抑郁情绪产生的饮酒渴求,为反奖赏系统负性强化,导致强迫性觅酒行为[3-5]。二者先后作用于动机系统(motivation system),导致成瘾行为形成[6]。 有研究支持这一假说,酒依赖戒断期患者在观看饮酒相关图片时,腹侧纹状体多巴胺释放减少,奖赏系统功能下调,成瘾者主观愉快感下降,复饮风险增大[6]。动物研究证实,酒依赖大鼠戒断期出现焦虑、烦躁的情绪状态,部分归因于促肾上腺皮质激素释放因子的异常调节,使反奖赏系统功能上调[7]。稳态应变模式理论将酒依赖渴求形成过程假设成两个阶段,是最近提出较为新颖的一种酒依赖渴求理论假说,它既整合了以往的动机敏感化与正性/负性强化理论,同时也阐明了相关环境刺激诱发饮酒渴求的机制。
Koob等建议用情绪和记忆的关系来解释暴露于饮酒相关环境诱发的渴求:二者在杏仁核内为动态平衡过程,酒依赖者的焦虑、抑郁情绪可巩固成瘾记忆,饮酒相关环境刺激使情绪和成瘾记忆相关联,诱发酒依赖患者强烈的饮酒渴望[8]。Sinha等对此过程持有不同的观点,他们猜测相关环境刺激可能使酒依赖患者产生了一种消极的情绪状态,导致渴求度增加,促使正性强化作用转变到负性强化作用,进而认为压力系统(the stress system)和奖赏系统的功能变化可能与酒精滥用有关[9]。然而,饮酒相关环境刺激可能使正性、负性强化作用相关联的假说,却未广泛用于动物模型的研究中。
综合以上假说我们发现,它们从不同角度出发对酒依赖渴求形成机制进行了假设,比较一致的认为奖赏系统参与了此过程,而相对于它们之间是如何相互关联、相互转化过程的推断,却存在争议。
2 酒依赖渴求相关脑区
随着医学影像技术的发展,发现与酒依赖渴求有关的大脑区域有所增加,下面主要讨论近几年备受研究者关注的几个大脑区域:前额叶皮层(the prefrontal cortex)、伏隔核(nucleus accumbens,NAc)和背侧纹状体(dorsal striatum)。
2.1 前额叶皮层 在酒精成瘾行为发展过程中,前额叶皮层发挥了至关重要的作用,它有助于执行决策控制功能,在评估奖赏阈值后,调节渴求度。有研究表明纹状体多巴胺D2受体的活性、数量与前额叶皮层区域功能的变化相关,而前额叶皮层的损坏也可能与其密切相关[10-11]。最近的研究表明,前额叶皮层调控奖赏阈值的区域可以控制腹侧纹状体多巴胺的释放,并监管异常的多巴胺受体,进而影响渴求度[10]。当前额叶皮层损伤时,奖赏阈值下降,使多巴胺受体活性降低,而纹状体减少多巴胺的释放,促使渴求度增大[10]。这些研究也说明了多巴胺的异常可以影响酒依赖的形成,并导致酒精滥用的负性强化。
2.2 伏隔核 为控制奖赏系统的主要区域,由多巴胺系统介导激活,大量的研究说明伏隔核为酒依赖渴求形成的关键部位。影像学研究发现,酒依赖者戒断后,酒精相关线索激活酗酒者腹侧纹状体,且伏隔核区域活性明显增加,酗酒者渴求度增大[12]。临床研究中,对12名酒依赖患者(既往系统戒酒治疗3~8次,停药两周后复饮)实施立体定向双侧伏隔核毁损术,1名重度酒依赖患者实施伏隔核深部脑刺激术 (Deep Brain Stimulation,DBS),术后,酒依赖患者饮酒愉悦感下降,渴求度显著降低,成瘾行为趋于正常[13-14]。
2.3 背侧纹状体 学者们推测背侧纹状体为控制习惯行为的主要区域,可以巩固“刺激-反应”模式,选择目标并付诸行动。此推论在各种环境线索诱导大鼠在十字水迷宫中寻找食物的研究中被证实,反复训练可以使目的导向性行为转变为习惯性行为,且背侧纹状体参与了习惯性行为的形成[15]。影像学研究提示,酒依赖患者在饮酒相关环境诱发饮酒渴求时,背侧纹状体区域被激活,并自动触发习惯性饮酒行为[16]。习惯性饮酒行为的强化使渴求变得异常强烈,难以抑制。利用功能磁共振成像对酒依赖严重性不同程度评分的人群进行观察时,也可得出相同的结论,并发现背侧纹状体区域活跃度与评分呈正相关,与强迫性饮酒渴求度呈正相关[17]。
3 酒依赖渴求神经传导通路假说
3.1 纹状体-多巴胺螺旋电路 不同颜色的多巴胺逆行束路追踪剂荧光金注射到纹状体不同区域,观察腹侧被盖区(the ventral tegmental area,VTA)多巴胺神经元分布的研究表明(见图 1)[18]:腹内侧纹状体(the ventromedial striatum),伏隔核内侧壳 (medial accumbens shell)接收后内侧腹侧被盖区(the pos⁃teromedial VTA)多巴胺神经元支配。而腹外侧纹状体(the ventrolateral striatum),伏隔核外侧壳(nucleus accumbens lateral shell)和伏隔核的核心(nucleus accumbens core)接收外侧腹侧被盖区(the posterolateral VTA)的多巴胺神经元支配。事实上,还有许多追踪实验结果也表明纹状体不同区域之间多巴胺神经元的投射,呈螺旋上升状,被学者们称作纹状体-多巴胺螺旋电路[19]:后内侧腹侧被盖区-伏隔核内侧壳-外侧腹侧被盖区-伏隔核外侧壳、伏隔核的核心-背内侧纹状体(dorsomedial striatum,DMS)-背外侧纹状体(dorsolateral striatum,DLS)。 这种交替传导形成螺旋结构,可以让简单的饮酒行为转变为习惯性酗酒行为[20]。临床研究中,实施双侧立体定向手术毁损伏隔核后,切断了纹状体-多巴胺螺旋电路,降低难治性酒依赖者渴求度,降低复饮风险[13]。
随着饮酒量的增加和饮酒时间的延长,成瘾者前额叶功能逐渐受损,自身行为控制能力减弱,使得刺激与反应变得异常牢固,渴求度逐渐增强,习惯性酗酒转变为强迫性觅酒,进而出现戒断反应,强烈而难以抑制的渴望让成瘾者戒酒屡屡失败[21]。这一假说,在研究纹状体不同区域在酒依赖渴求形成过程中扮演的不同角色的实验中得到证实,减少腹侧纹状体和前额叶背外侧皮质之间的神经冲动及相互间功能调控,与酒依赖戒断期渴求度有相关性[21]。
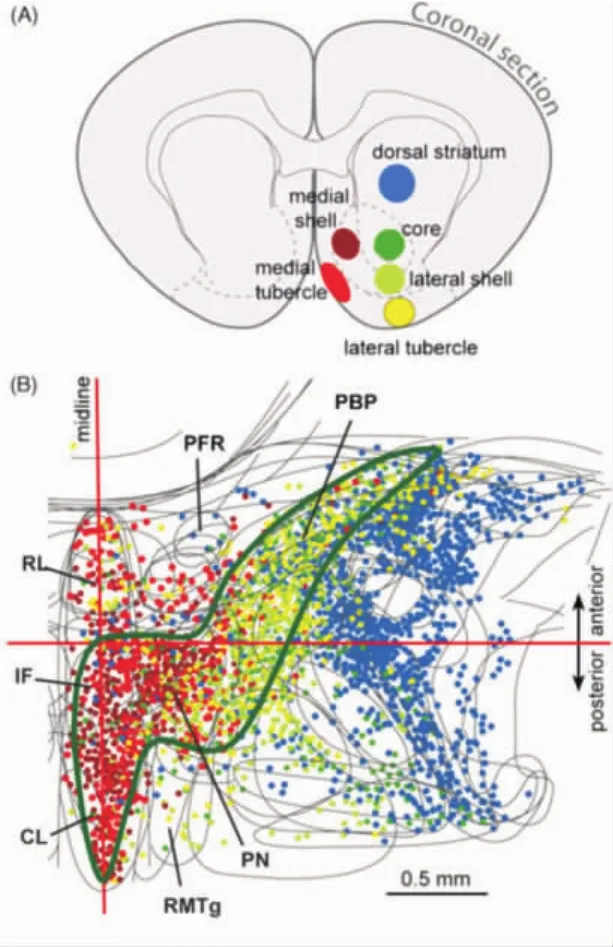
图1 腹侧纹状体多巴胺投影地形图[18]
3.2 负性情绪诱发渴求传导通路 酒依赖患者戒断期会出现焦虑、烦躁、躯体不适感等负性情绪,此时,酒依赖者为了缓解负性情绪,产生强烈的心理渴求,koob等把此过程假设为三条传导通路[22]:①中脑边缘多巴胺系统-中央杏仁核(cen⁃tral nucleus of the amygdale,CeA)、终纹核床(bed nucleus of the stria terminalis,BNST)-大脑压力系统(Brain sterm)-伏隔核的核心-背侧纹状体-下丘(Thalamus)产生焦虑样反应;②中央杏仁核、终纹核床、伏隔核-海马(Hippocampus)触发相关饮酒记忆;③负性情绪和情绪记忆在杏仁核内保持动态平衡[8]。有研究结果表明在酗酒期间,焦虑等负性情绪的增加与酒依赖者渴求度的增加呈正相关[9]。实验证明大鼠脑室内注射促肾上腺皮质激素释放因子拮抗剂可减轻酒精戒断带来的焦虑样反应,减少觅酒次数[23]。
3.3 谷氨酸神经元传导通路 饮酒相关环境刺激酒依赖者诱发渴求时,可能是谷氨酸神经元发挥了主导作用。有学者认为,前额叶谷氨酸神经元对饮酒的适应性改变,可重新编码神经元分布,通过降低自然奖赏阈值,增加饮酒渴求度来促进成瘾者强迫性觅酒,通过减弱认知控制能力来加强“刺激-反应”时谷氨酸神经元的驱动力[24]。有学者推测酒依赖者戒断后,饮酒相关环境刺激感知觉系统促使谷氨酸神经元发出神经冲动,可能涉及以下三条传导通路[22-25]:①苍白球(globus pallidus)-下丘脑-前额叶皮质-腹侧被盖区-伏隔核-背侧纹状体-下丘脑;②基底外侧杏仁核(basolateral amyg⁃dale,BLA)-中央杏仁核-伏隔核-背侧纹状体-下丘脑;③海马 (场景相关情绪记忆)-伏隔核-背侧纹状体-下丘脑。Gass等用涂有谷氨酸氧化酶(glutamate oxidase,GluOx)的生物传感器监测大鼠特定大脑区域谷氨酸浓度变化时发现,饮酒相关环境刺激可引起大鼠大脑基底外侧杏仁核及伏隔核核心区域谷氨酸递质释放增加,导致觅酒次数增多[26]。
4 小结
综上所述,关于酒依赖的不同神经生物学研究和理论假设,以及影像学研究,为人们揭开酒依赖渴求的神经传导通路,阐明神经回路适应性生理改变提供了可能。如推测酒依赖渴求神经传导通路可能为:前额叶皮层-伏隔核-背内侧纹状体-背外侧纹状体-下丘脑;推测酒依赖渴求神经传导通路中各区域可能存在一定联系(前额叶皮层抑制减弱时,多巴胺传导可能从腹侧纹状体转移到背侧纹状体,实现小量饮酒到习惯性酗酒的转变,愉悦感促使饮酒渴求逐渐增强;前额叶功能受损时,习惯性酗酒行为可能得到强化,形成强迫性觅酒,负性情绪促使饮酒渴求变得难以抑制;在酒精成瘾行为的不同阶段,饮酒相关环境刺激都可能诱发酒依赖者强烈的心理渴求)。但关于酒依赖渴求的神经传导通路形成的整个过程,酒依赖渴求形成的不同阶段哪些区域占主导作用,以及这些功能性区域及相关神经递质是如何相互协作共同整合相关信息并最终导致渴求度变化等问题仍未被阐明,需要进一步的研究证实。
[1]Chakravorty S,Kuna ST,Zaharakis N,et al.Covariates of crav⁃ing in actively drinking alcoholics[J].Am J Addict,2010,19(5):450-457.
[2]Robinson TE,Berridge KC.The neural basis of drug craving:an incentive⁃sensitization theory of addiction [J].Brain Res Brain Res Rev,1993,18(3):247-291.
[3]Koob GF,Le Moal M.Addiction and the brain antireward sys⁃tem[J].Annu Rev Psychol,2008,59:29-53.
[4]Koob GF.Neurobiological substrates for the dark side of compul⁃sivity in addiction[J].Neuropharmacology,2009,56(Suppl 1):18-31.
[5]罗涛,郝伟.反奖赏系统与成瘾行为[J].中国药物依赖性杂志,2010,19(4):315-317.
[6]Diana M.The dopamine hypothesis of drug addiction and its po⁃tential therapeutic value [J].Front Psychiatry,2011,2:64.
[7]Bruijnzeel AW,Small E,Pasek TM,et al.Corticotropin⁃releas⁃ing factor mediates the dysphoria⁃like state associated with alco⁃hol withdrawal in rats[J].Behav Brain Res,2010,210(2):288-291.
[8]Koob GF.Dynamics of Neuronal Circuits in Addiction: Reward,Antireward,and Emotional Memory [J]. Pharmacopsychiatry,2009,42(Suppl 1):S32-41.
[9]Sinha R,Fox HC,Hong KA,et al.Enhanced negative emotion and alcohol craving,and altered physiological responses follow⁃ing stress and cue exposure in alcohol dependent individuals[J].Neuropsychopharmacology,2009,34(5):1198-1208.
[10]Volkow ND,Wang GJ,Telang F,et al.Profound deceases in dopamine release in striatum in detoxified alcoholics:possible orbitofrontal involvement[J].J Neurosci,2007,27(46):12700-12706.
[11]王传升,谌红献,张瑞玲,等.海洛因成瘾易感性与腹侧被盖区多巴胺D2受体及多巴胺转运体的关系[J].中国神经精神疾病杂志,2010,36(8):463-467.
[12]Kühn S,Gallinat J.Common biology of craving across legal and illegal drugs⁃a quantitative meta⁃analysis of cue⁃reactivity brain response[J].Eur J Neurosci,2011,33(7):1318-1326.
[13]Wu HM,Wang XL,Chang CW,et al.Preliminary findings in ablating the nucleus accumbens using stereotactic surgery for al⁃leviating psychological dependence on alcohol[J].Neurosci Lett,2010,473(2):77-81.
[14]Kuhn J,Gründler TO,Bauer R,et al.Successful deep brain stimulation of the nucleus accumbens in severe alcohol depen⁃dence is associated with changed performance monitoring [J].Addict Biol,2011,16(4):620-623.
[15]Poldrack RA,Packard MG.Competition among multiple memory systems:converging evidence from animal and human brain studies[J].Neuropsychologia,2003,41(3):245-251.
[16]Seo D,Jia Z,Lacadie CM,et al.Sex differences in neural re⁃sponses to stress and alcohol context cues[J].Hum Brain Mapp,2011,32(11):1998-2013.
[17]Vollstädt⁃Klein S,Wichert S,Rabinstein J,et al.Initial,habit⁃ual and compulsive alcohol use is characterized by a shift of cue processing from ventral to dorsal striatum[J].Addiction,2010,105(10):1741-1749.
[18]Ikemoto S.Brain reward circuitry beyond the mesolimbic dopami⁃ne system: A neurobiological theory[J].Neurosci Biobehav Rev,2010,35(2):129-150.
[19]Ikemoto S.Dopamine reward circuitry:Two projection systems from the ventral midbrain to the nucleus accumbens⁃olfactory tu⁃bercle complex[J].Brain Res Rev,2007,56(1):27-28.
[20]Yin HH,Knowlton BJ.The role of the basal ganglia in habit for⁃mation[J].Nat Rev Neusci,2006,7(6):464-476.
[21]Chen G,Cuzon Carlson VC,Wang J,et al.Striatal Involve⁃ment in Human Alcoholism andAlcoholConsumption,and Winthdrawal in Animal Models[J].Alcohol Clin Exp Res,2011,35(10):1739-1748.
[22]Koob GF,Volkow ND.Neurocircuitry of addiction[J].Neuropsy⁃chopharmacology,2010,35(1):217-238.
[23]Koob GF,Zorrilla EP.Neurobiological mechanisms of addiction:focus on corticotropin⁃releasing factor[J].Curr Opin Investig Drugs,2010,11(1):63-71.
[24]Kalivas PW,Volkow ND.The neural basis of addiction:a patho⁃logy of motivation and choice[J].Am J Psychiatry,2005,162(8):1403-1413.
[25]Gardner EL.Addiction and brain reward and antireward path⁃ways[J].Adv Psychosom Med,2011,30():22-60.
[26]Gass JT,Sinclair CM,Cleva RM,et al.Alcohol⁃seeking behav⁃ior is associated with increased glutamate transmission in baso⁃lateral amygdala and nucleus accumbens as measured by gluta⁃mate⁃oxidase⁃coated biosensors[J].Addict Biol,2011,16(2):215-228.
