难治性精神分裂症和抑郁症患者透明隔腔形态结构的磁共振成像比较研究☆
2012-11-23孙锦华袁爱花郭田友郭兰婷
孙锦华 袁爱花 郭田友 郭兰婷
透明隔腔(cavum septum pellucidum,CSP)是个体在发育过程中由于脑部透明隔小叶未能逐渐融合而形成[1-2]。不少证据支持精神分裂症患者在出生前可能因神经发育受阻而出现脑发育不全,CSP的出现可能为其脑发育不全的结构特征之一[1],不少研究认为其发生率高于 正常人群[1,3,4],而另 有 研究并不支持该结论[5-6]。研究结果的不一致可能与样本异质性、影像学技术和扫描参数差异等有关[1]。如一些研究多采用CT和层厚大于5毫米的低场磁共振成像(magnetic resonance imaging,MRI)技术[7],可能低估了CSP发生情况。近年来高场薄层MRI技术的临床应用及影像学分析软件的开发,为CSP这一微小结构的准确识别和精细测量提供可能。另外,选择相对同质的样本非常重要,难治性患者对药物反应差的特点可能提示此类人群有着更独特的神经生物学基础。然而,既往对精神分裂症和抑郁症的MRI研究虽然获取了一些重要发现[3,8-9],但涉及难治性亚型并不多见。 我们曾报道难治性精神分裂症 (treatment resistant schizophrenia,TRS)和难治性抑郁症 (treatment resistant depres sion,TRD)脑中线结构胼胝体的形态学异常结果[10],而胼胝体的异常发育与 CSP、边缘系统等密切相关[2]。本研究期望运用高场MRI技术对TRS和TRD患者脑中线结构CSP进行研究,比较两类难治性疾患的CSP发生率和结构特征,为研究其脑中线结构发育异常提供证据。
1 对象与方法
1.1 研究对象 TRS组样本来源于2007年1月至2008年8月澳大利亚Monash大学Alfred精神疾病研究中心样本收集地加拿大多伦多大学精神卫生与成瘾研究中心的住院患者。入组标准:①符合美国精神疾病诊断与统计手册第四版(Diagnos⁃tic and Statistical Manual of Mental Disorders,Fourth edition,DSM⁃Ⅳ)精神分裂症的诊断标准;②至少使用两种不同类型抗精神病药物治疗,达到治疗量后经充分治疗至少6周以上,患者症状没有减轻[11];③年龄16岁以上,智力正常(韦氏智力测评IQ﹥90)。排除标准:①现患或曾患DSM⁃Ⅳ轴Ⅰ障碍中除精神分裂症以外的疾患;②重大躯体疾病和神经系统疾病者、头部外伤史者和磁共振检查的禁忌证者。共入组TRS患者42例,男25,女17,年龄 20~62岁,平均(39.62±10.82)岁;发病年龄为 8~41岁,平均(23.45±9.07)岁;病程 2~48年(10例不详),平均(15.75±12.34)年。 阳性与阴性症状量表总分41~105,平均(65.02±17.66)。药物使用情况:3例患者未服药物,39例患者服用抗精神病药物,其中11例患者接受氯氮平治疗(日平均剂量445.4±213.8 mg),24例患者接受其他非典型抗精神病药物治疗(根据药物折算方法[12],日平均剂量等同于氯丙嗪(538.6±213.8 mg),4例患者接受典型抗精神病药物治疗 (日平均剂量等同于氯丙嗪337.5±280.9 mg)。MRI检查前四周保持药物剂量恒定。
TRD患者组样本来源于2007年1月至2008年8月澳大利亚墨尔本Monash大学Alfred医院住院患者及私人精神科医生诊所就诊患者。入组标准:①符合DSM⁃Ⅳ重性抑郁的诊断标准;②符合DSM⁃Ⅳ研究用诊断标准对难治性的定义:至少使用两种以上不同类型的抗抑郁药物,达到充分治疗剂量、疗程6周以上,患者症状没有减轻;③汉密顿抑郁量表评定总分在20分以上;④年龄在16岁以上,智力正常(韦氏智力测评IQ>90)。排除标准:①现患或曾患DSM⁃Ⅳ轴Ⅰ型障碍除重性抑郁障碍以外的疾患;②有重大躯体疾病和神经系统疾病、头部外伤史和磁共振检查禁忌证者。共入组TRD患者 45例,男 22,女 23,年龄 18~63岁,平均(40.78± 11.13)岁;平均病程为(7.13± 6.52)年,药物使用情况:8例患者未服药物,37例患者服用药物,其中选择性5-羟色胺再摄取抑制剂者有11例,5-羟色胺和去甲肾上腺素双重再摄取抑制剂7例,三环类抗抑郁药3例,其他类抗抑郁药12例,合并用药4例。MRI检查前四周保持药物剂量恒定。
正常对照组(简称“对照组”)来源于2008年从澳大利亚Monash大学教职员工中募集的健康志愿者。入组标准:年龄16岁以上、智力正常(韦氏智力测评IQ﹥90)、身体健康。排除标准:现患或曾患DSM-Ⅳ轴I型障碍、一级亲属中患精神分裂症、抑郁障碍者、重大躯体疾病、有头部外伤史和磁共振检查禁忌证者。对照组共入组30例,男13,女 17,年龄 23~62岁,平均(34.60±11.85)岁。统计分析显示,三组间年龄(F=2.918,P=0.058)和性别分布(χ2=2.004,P=0.36)差异均无统计学意义,年龄、性别相匹配。
本研究经澳大利亚Monash大学Alfred医院人类受试样本研究和伦理委员会批准,所有受试者均签署知情同意书[10]。
1.2 磁共振扫描 采用美国GE公司1.5T磁共振成像系统扫描,将脑部正中矢状位图像前连合和后联合连线的平行线作为扫描定位标志,经配准等处理,采用常规自旋回波T1加权(T1WI)横断图像作为解剖定位图像。受试者扫描时清醒、安静、平卧,除定位像外,透明隔及透明隔腔的获取主从冠状面获取。扫描参数如下:TR=8.628毫秒,TE=1.924毫秒,IT=300,矩阵大小 =256×256,翻转角(FA)=1215,层厚 1 mm,无层间隔,分辨率256×256,体素大小 =0.86×0.86×1 mm3。
1.3 影像学数据处理与CSP测量 影像学资料运用美国Mayo Clinic研发的ANALYZET138.1和MRIcro软件进行数据分析。CSP检测与形态学测量采用盲法,由一名专业人员进行数据分析。①借助MRIcro软件,对每一位受试者T1像冠状面逐层观察,借助ANALYZE软件确认CSP出现有无。有一层出现定义为有,如无任何层出现,定义为无。“揭盲”后分别计算各组CSP发生率。②CSP线性测量使用ANALYZE软件线性模型模块对CSP长度、宽度进行测量。长度等于其跨越层数乘以层厚。因本研究MRI图像为层厚1毫米无间隔连续图像,因此CSP所跨层数即长度。参照既往研究方法[13],若在头部MRI冠状面连续6层及以上层面均出现了CSP(长度≥6 mm),定义为“大CSP”。小CSP定义为长度小于6 mm。使用ANALYZE软件对各层CSP宽度测量,选最大值作为CSP最大宽度测量值。③CSP体积测量:使用ANALYZE软件感兴趣区测量模块对其体积进行测量。在出现CSP的层上逐层沿其边缘人工勾画,勾画结束后,软件自动计算出体积值。
1.4 统计分析 运用SPSS 16.0进行统计分析。对三组间CSP发生率的比较,采用卡方检验方法,对于格子数内少于5的变量采用Fisher's确切概率法分析。因各组CSP长度、宽度和体积测量值分布不符合正态分布,CSP测量指标组间比较采用秩和检验方法。CSP形态学测量指标与人口学、临床变量等各因素之间的相关分析采用Spearman非参数相关分析方法。
2 结果
2.1 三组间总CSP和小CSP发生率的比较117例受试者共计64例出现CSP(包含大小CSP,简称总CSP,其中TRS组27例、TRD组22例、对照组15例,各组总CSP发生率分别为64.3%、48.9%、50.0%,卡方检验结果显示,三组间总CSP发生率差异无统计学意义(χ2=2.438,P=0.296)。
对小CSP发生率进行单独统计,结果显示,117例受试者共计58例出现小CSP,其中TRS组21例、TRD组22例、对照组15例,各组小CSP发生率分别为50.0%、48.9%、50.0%,卡方检验结果显示,三组间小CSP发生率差异无统计学意义(χ2=0.014,P=0.993)。
2.2 三组间大CSP发生率的比较 用Fisher's确切概率法对三组间大CSP发生率进行比较。结果显示,TRS组有6例出现大CSP,发生率为14.3%,TRD组和对照组均未出现大CSP,发生率为0%,三组间大CSP发生率差异存在统计学意义 (χ2=11.293,P=0.004),两两比较结果显示,TRS组中出现大CSP的发生率(14.3%)分别高于TRD组、对照组(均为0%),差异有统计学意义(P﹤0.05)。
2.3 三组间CSP形态学特征的差异 对三组中出现CSP的人群进行CSP形态学测量指标的组间比较。Kruskal-Wallis检验结果显示,三组间CSP最大宽度 (χ2= 12.477,P = 0.002)、CSP 长度(χ2=10.841,P=0.004)的差异有统计学意义,而三组间CSP 体积差异无统计学意义(χ2=2.299,P=0.317)。
两两比较结果显示,TRS组CSP最大宽度分别小于对照组(P=0.018)和TRD 组(P=0.001),而TRS组CSP长度分别大于对照组(P=0.012)和TRD患者(P=0.003),差异均具有统计学意义。而TRD组和对照组的比较结果,TRD组长度小于对照组,最大宽度大于对照组,但差异无统计学意义(P﹥0.05)。
2.4 相关分析 采用Spearman非参数检验法,对TRS患者CSP最大宽度、长度、体积与患者入组时的年龄、发病年龄、病程、PANSS总分、颅内体积(灰质、白质和脑脊液三者体积的总和)、药物治疗剂量等因素进行相关分析。结果发现,TRS患者CSP 最大宽度与年龄(r= 0.431,P = 0.025)呈正相关,即年龄越小,CSP最大宽度越小。除此之外,各因素间的相关均无统计学意义(P﹥0.05)。
3 讨论
透明隔是两片薄的纤维板层,形成侧脑室内侧壁,出生后半年透明隔发育过程中,如果其两片纤维板层没有融合,可逐渐形成透明隔腔。因透明隔与胼胝体或边缘系统有着共同的胚胎起源,透明隔的发育缺陷常暗示着更广泛的脑发育不全,包括胼胝体或边缘系统结构异常,使个体出现不同程度的神经精神症状。如CSP可出现于精神分裂症[1,3,7]、情感性精神病[13]、抑郁症[14]等多种疾病中。
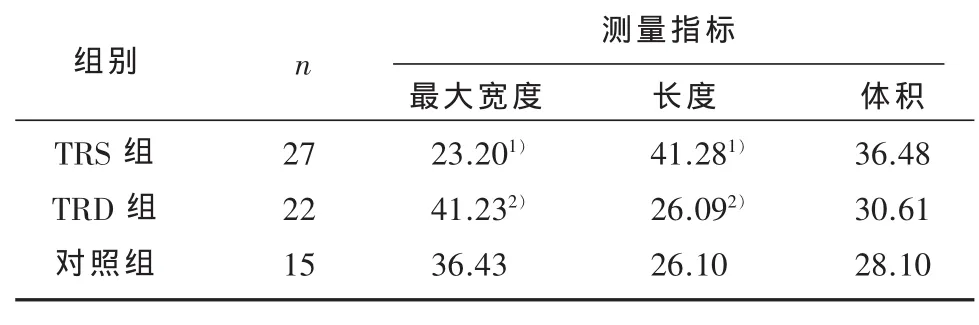
表1 三组CSP形态学测量指标均数秩的比较结果
精神分裂症患者存在CSP发生异常。但研究结果并不尽一致,如最近一篇Meta分析的研究报道发现有6项研究支持患者发生率高于正常对照,而有9项研究并未发现CSP发生率与正常人存在差异[1]。本研究选择TRS这一亚型人群,结果发现无论总CSP还是小CSP发生率,与对照组和TRD组相比均无显著性差异,支持小CSP为一种正常的结构变异,与上述Meta分析中部分研究文献结果一致。既然小CSP为一种正常的结构变异,那精神分裂症患者大CSP发生情况是否正常?在对小CSP的研究上获取不少阴性结果的基础上,许多研究者开始关注大 CSP[7,13,15]。 对慢性和首发患者大CSP的一些研究发现这两种亚型的精神分裂症患者发生率均高于正常人群[7,13],但目前尚无难治性亚型患者的特别报道,为此本研究开展了此工作。发现仅在TRS患者中检出大CSP,其发生率显著高于对照组和TRD组,进一步支持大CSP为精神分裂症特征性的结构异常。提示在将来的研究中大CSP为精神分裂症脑影像学研究之重点。
重性抑郁症存在边缘系统皮层功能紊乱,相应区域如海马、杏仁核、基底神经节等脑形态学发生改变[16],然而迄今为止,在边缘皮层纤维连接中起重要作用的中线结构CSP是否存在异常的研究甚少[14]。Shioiri等曾采用低场MRI技术在重性抑郁症患者中并未检出CSP,与正常组相比发生率也无显著差异[17]。而Takahashi等采用高场MRI技术对重性抑郁当前发作和缓解期患者大CSP发生率进行研究,结果也未发现发生率存在异常[14]。本研究对TRD患者大小CSP发生情况进行研究,也未能发现其发生率存在异常,支持上述研究结果。可见,重性抑郁患者CSP的发生与正常人相似。
虽然两患者组与对照组体积不存在差异,但两类疾患CSP形态结构可能存在差异。本研究发现,TRS患者CSP形状呈现“瘦长”形,长度和最大宽度均不同于TRD患者和正常人。而TRD患者CSP形状呈现“宽短”形倾向,长度小于对照、宽度大于对照,但尚未达到显著性差异。Takahashi等曾对重性抑郁症患者CSP长度进行研究,结果也未发现其与正常组存在显著差异[14],与本研究结论一致。将来需对两类难治性患者形态学差异进一步研究,如可借助形状(shape)学影像分析方法细化研究[18],有望获取更有意义的发现。
本研究发现,TRS患者CSP形态学各测量指标与患者发病年龄、病程、PANSS总分间的相关性无统计学意义,同Flashman等研究结果一致[4]。可见尽管分裂症样本为难治性病例,然而疾病的慢性化程度、严重程度对CSP形态学特征并没有造成显著影响,支持精神分裂症在发病前CSP可能就已存在,为一种神经发育性疾病。另外,研究发现TRS患者CSP最大宽度与年龄呈正相关,但因患者起病年龄存在差异,为此将发病年龄作为协变量加以控制,对CSP最大宽度和年龄之间相关进行偏相关分析,结果显示相关无统计学意义(r=0.2025,P = 0.366),因此尚不支持患者起病后存在CSP最大宽度随年龄增长而变大的规律。
本研究的不足在于缺乏非难治性患者CSP资料作为对比,因此不能明确本研究发现是难治性亚型还是所有患者具有的影像学特点,在将来的研究中,需要纳入非难治性患者组进行对比分析。另外,部分患者服用药物,药物可能会对CSP这一微小结构产生影响,在将来研究中,如果能纳入未服药首发患者作为对照,充分排除药物的混杂因素,则可为探索难治性精神分裂症CSP自身特征提供更有力的证据。
[1]Trzesniak C,Oliveira IR,Kempton MJ,et al.Are cavum septum pellucidum abnormalities more common in schizophrenia spectrum disorders? A systematic review and meta-analysis [J].Schizophr Res,2011,125(1):1-12.
[2]娄明武,杨涛,宿宝贵.透明隔的影像表现及其临床意义[J].中华放射学杂志,2000,34(5):356-358.
[3]Shenton ME,Dickey CC,Frumin M,et al.A review of MRI findings in schizophrenia[J].Schizophr Research,2001,49(1-2):1-52.
[4]Flashman LA,Roth RM,Pixley HS,et al.Cavum septum pellucidum in schizophrenia:Clinical and neuropsychological correlates[J].Psychiatry Res: Neuroimaging,2007,154 (2):147-155.
[5]Rajarethinam R,Sohi J,Arfken C,et al.No difference in the prevalence of cavum septum pellucidum (CSP) between firstepisode schizophrenia patients,offspring of schizophrenia patients and healthy controls[J].Schizophr Res,2008,103(1-3):22-25.
[6]Takahashi T,Yung AR,Yucel M,et al.Prevalence of large cavum septi pellucidi in ultra high-risk individuals and patients with psychotic disorders[J].Schizophr Res,2008,105(1-3):236-244.
[7]Nopoulos P,Swayze V,Flaum M,et al.Cavum septi pellucidi in normals and patients with schizophrenia as detected by magnetic resonance imaging [J].Biol Psychiatry,1997,41(11):1102-1108.
[8]苏中华,成义仁,王贵山.首发偏执型精神分裂症患者的脑白质磁共振弥散张量成像研究[J].中国神经精神疾病杂志,2010,36(4):233-236.
[9]唐勇,刘文,彭昌孝.精神分裂症患者脑结构异常的MRI研究[J].中国神经精神疾病杂志,2002,28(5):327-329。
[10]Sun J,Maller JJ,Daskalakis ZJ,et al.Morphology of the corpus callosum in treatment-resistant schizophrenia and major depression[J].Acta Psychiatr Scand,2009,120(4):265-273.
[11]Lehman AF,Lieberman JA,Dixon LB,et al.Practice guidelines for the treatment of patients with schizophrenia,second edition[J].Am J Psychiatry,2004,161(suppl.2):1-56.
[12]Woods SW.Chlorpromazine equivalent doses for the newer atypical antipsychotics[J].J Clin Psychiatry,2003,64(6): 663-667.
[13]Kasai K,McCarley RW,Salisbury DF,et al.Cavum septi pellucidi in first-episode schizophrenia and first-episode affective psychosis: an MRI study[J].Schizophr Res,2004,71(1):65-76.
[14]Takahashi T,Yücel M,Lorenzetti V,et al.Midline brain structures in patients with current and remitted major depression [J].Prog Neuropsychopharmacol Biol Psychiatry,2009,33 (6):1058-1063.
[15]Crippa JAD,Zuardi AW,Busatto GF,et al.Cavum septum pellucidum and adhesio interthalamica in schizophrenia:an MRI study[J].Eur Psychiatry,2006,21(5):291-299.
[16]Mayberg HS.Modulating dysfunctional limbic-cortical circuits in depression:towards development of brain-based algorithms for diagnosis and optimised treatment[J].Br Med Bull,2003,65(1):193-207.
[17]Shioiri T,Oshitani Y,Kato T,et al.Prevalence of cavum septum pellucidum detected by MRI in patients with bipolar disorder,major depression and schizophrenia[J].Psychol Med,1996,26(2):431-434.
[18]Woolley J,McGuire P.Neuroimaging in schizophrenia:what does it tell the clinician?[J] Advances in Psychiatric Treatment,2005,11:195-202.
