IBDV感染对SPF鸡腔上囊与外周血单核细胞TLR3/4/15 mRNA表达的影响
2012-11-23郭新风王丽琼李焕荣阮文科崔德凤刘凤华
郭新风,王丽琼,李焕荣,阮文科,崔德凤,王 宁,刘凤华
[北京农学院动物科学技术学院,北京市兽医学(中医药)重点实验室,CAU-BUA TCVM教学与科研团队,北京 昌平102206]
宿主细胞的 Toll样受体(Toll-like receptors,TLR)通过识别病原微生物保守的分子相关模式,诱导天然免疫信号而激活炎性细胞因子,上调共刺激因子而激活细胞免疫,发挥抗病毒反应[1]。TLR3能诱导干扰素Ⅰ型的释放;TLR4可介导炎症反应;TLR15在病毒感染中有报道,可能在机体先天性免疫中发挥作用[2-3]。
鸡传染性腔上囊病毒(IBDV)主要侵害腔上囊内具有IgM的B淋巴细胞,引起严重而长期的免疫抑制,导致免疫失败,影响多种病毒疫苗的免疫应答[4]。IBDV感染可启动机体先天性免疫,通过巨噬细胞释放各种细胞因子抵抗病毒感染[5];通过增强T淋巴细胞功能启动获得性免疫[6]。腔上囊单核细胞(BBMC)和外周血单核细胞(PBMC)作为机体重要的免疫细胞,其表面的模式识别受体在IBDV入侵中的识别作用及启动免疫反应的机理少有报道。本试验使用相对荧光定量PCR技术,通过分析IBDV感染对SPF鸡BBMC和PBMC在感染后不同阶段TLR3/4/15mRNA表达的影响,探讨IBDV感染对固有免疫反应的影响,为进一步研究IBDV发生过程中宿主与病原相互间的关系奠定基础。
1 材料
4周龄SPF鸡,购自北京梅里亚维通实验动物技术有限公司;鸡传染性腔上囊病毒(IBDV)BC6/86毒株,购自中国兽医药品监察所;Trizol,购自In-vitrogen(美国)公司;淋巴细胞分离液,购自TBD公司。
2 方法
2.1 动物分组及攻毒 4周龄SPF鸡30只,对照组和攻毒组各15只,再随机分为3组,每组5只。点眼途径感染IBDV BC6/85株标准强毒,50倍的囊最小感染量(BID)/只鸡,对照组给予相同剂量的生理盐水。
2.2 腔上囊和外周血单核细胞的制备 分别在感染后1、5、15d采集鸡心脏EDTA抗凝血,按照鸡淋巴细胞分离液说明书介绍的步骤进行鸡外周血单个核细胞(PBMC)分离,台盼蓝计数,配成1×106个/mL浓度的悬浮液,-80℃贮存备用;无菌取腔上囊,去除表面的脂肪组织、被膜等,2%犊牛血清的1640冲洗,刀背刮取腔上囊内淋巴细胞于2%1640培养基中,分别进行150目筛和300目筛过滤离心,同PBMC步骤分离鸡腔上囊单个核细胞,台盼蓝计数,配成1×106个/mL浓度的悬浮液,-80℃贮存备用。
2.3 引物的合成与RNA的反转录 根据Gen-Bank上各基因的序列,用Primer 5.0在保守区设计各自的特异PCR引物(表1)。引物均由上海生工生物工程技术服务有限公司完成。
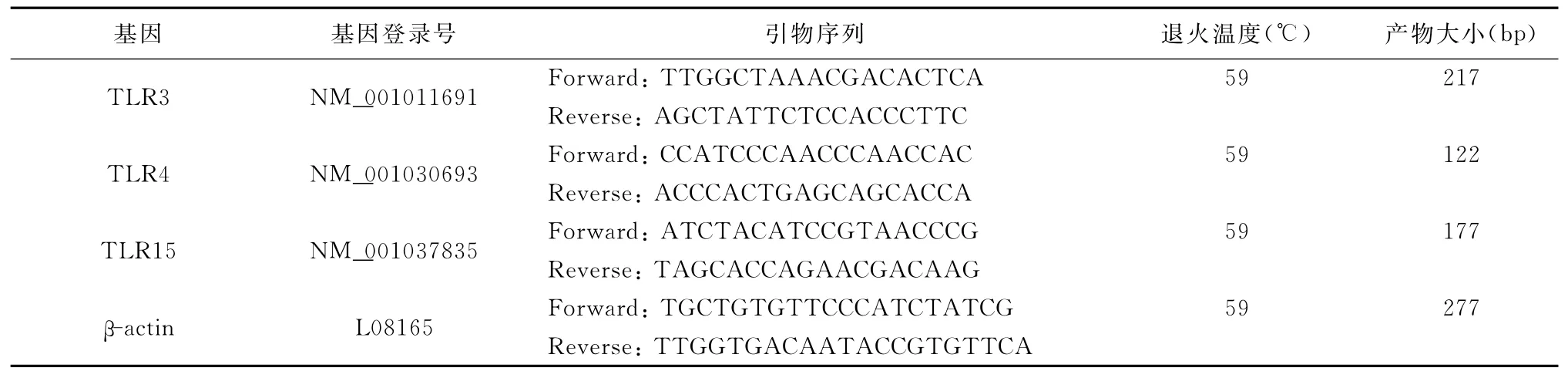
表1 β-actin、TLR3、TLR4与TLR15扩增引物的序列和反应条件
按照Trizol说明书提取细胞总RNA。反转录在20μL体系中进行,1μL总RNA,DEPC水11 μL,Oligo(dT)0.5μL,70℃5min,M-MLV RT 5×Buffer 4μL,dNTP 2μL,MgCl21μL ,Ribo-nucelase Inhibitor 0.5μL,42℃ 60min,70℃15 min。反转录产物置-80℃冰箱备用。
2.4 SYBR GreenⅠ相对荧光定量RT-PCR检测方法的建立 本试验选用β-actin作为参照基因[7]。将β-actin、TLR3、TLR4和 TLR15的阳性cDNA进行10系列稀释成6个梯度作为模板,利用各自的特异性引物进行real-time PCR建立各自的标准曲线。20μL PCR反应体系:10μL SYBR Green Real-time PCR Mix,1μL Rox Buffer,0.6μL上游引物,0.6μL下游引物,模板1μL,加水至20μL 。PCR反应程序为:95℃5min;95℃30s,59℃30s,72℃30s,共40个循环。根据荧光值的变化,系统自动生成标准曲线。扩增效率基本一致时方可采用相对荧光定量比较CT值[8]。
2.5 统计分析 应用SPSS13.0对数据进行方差分析,P≤0.05表示差异显著。使用2△△Ct法对感染后不同时间的toll样受体分子进行比对。
△△Ct=(Ct目的基因-Ct看家基因)×试验组-(Ct目的基因-Ct看家基因)×对照组
2-△△Ct表示的是试验组目的基因表达对于对照组的变化倍数。
3 结果与分析
3.1 β-actin、TLR3、TLR4 和 TLR15 荧光定量PCR标准曲线的建立 以10倍系列稀释的β-actin、TLR3、TLR4和TLR15的阳性cDNA标准品为模板进行real-time PCR,得到检测用 β-actin、TLR3、TLR4和TLR15的荧光定量PCR溶解曲线(图1)和标准曲线方程:
Y=-4.017*log(x)+0.67,R2=0.998;Y=-4.128*log(x)+6.33,R2=0.996;Y=-4.097*log(x)+14.31,R2=0.991;Y=-4.089*log(x)+9.33,R2=0.997
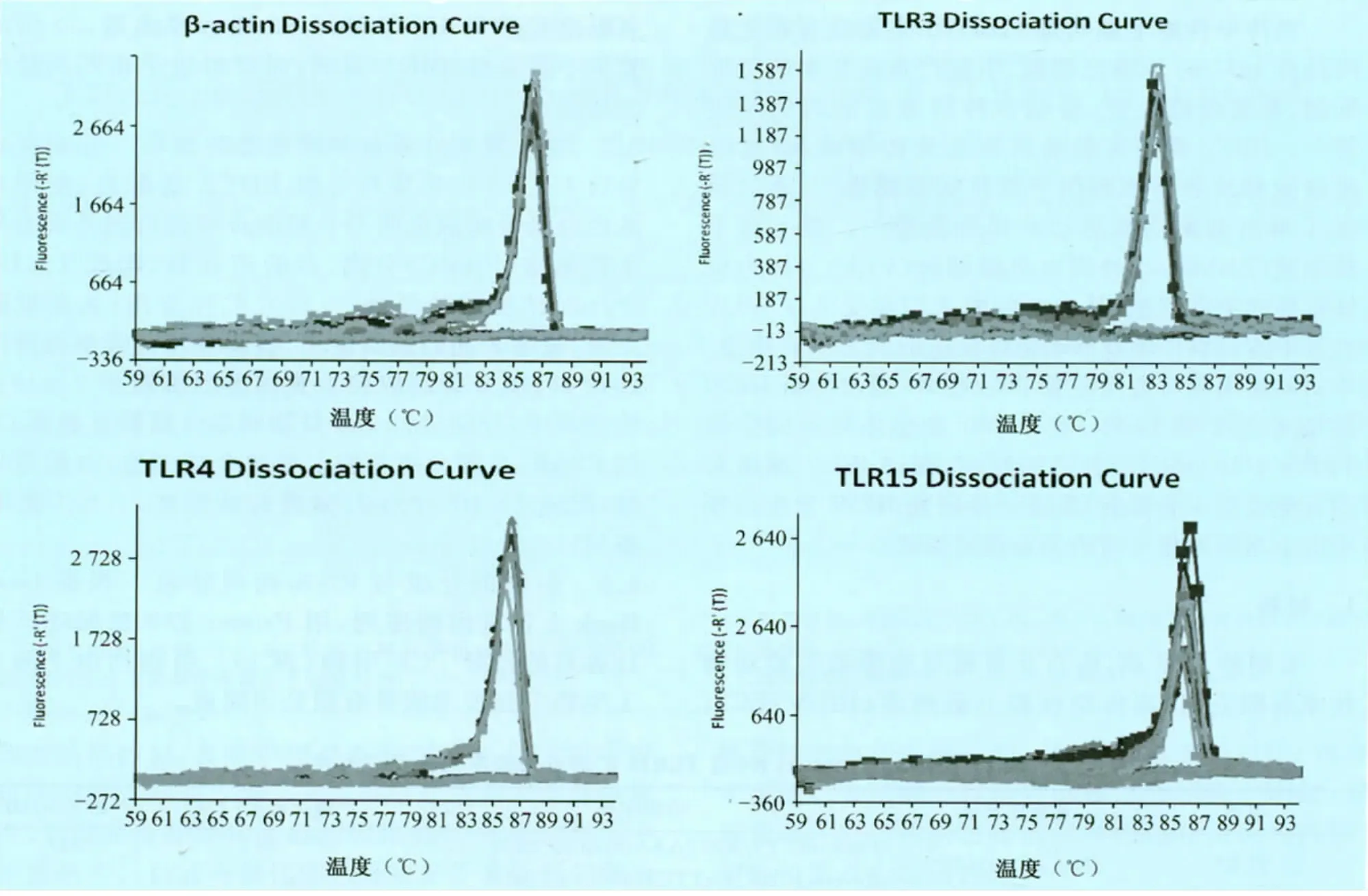
图1 TLR3、TLR4、TLR15及 β-actin基因的SYBR Green I rea-l time PCR 溶解曲线
溶解曲线表明,扩增产物形成单一的特异性溶解峰,其Tm值介于82.6℃~87.6℃之间。标准曲线方程表明,标准品起始模板浓度与Ct值呈现良好的线性关系,相关系数r2均达到0.991以上,且TLR3、TLR4和TLR15与β-actin曲线斜率值相差小于0.1,可用于β-actin、TLR3、TLR4和 TLR15的mRNA水平相对定量分析。
3.2 TLR3、TLR4和TLR15相对荧光定量结果分析 如图2所示。与对照组相比,BBMC中TLR3的mRNA表达水平在IBDV感染后1d和感染后5 d均上调,差异显著(P≤0.05),PBMC中仅在感染后1d显著上调;感染后15dBBMC中TLR3恢复到正常水平,而PBMC中TLR3表达仍极显著高于对照组(P≤0.01)。
差异显著(P≤0.05),PBMC中 TLR4的 mRNA表达水平在感染后始终高于对照组,且在感染后15d极显著高于对照组(P≤0.01)。BBMC中TLR15的mRNA表达水平在感染后1d显著高于对照组(P≤0.05),感染后5d和15d无显著差异;而PBMC中TLR15mRNA表达水平在感染后1d极显著高于对照组(P≤0.01),在感染后5d和15d未检测到。

图2 感染后不同时间BBMC和PBMC中TLR3/4/15mRNA水平
4 讨论
Toll样受体是固有免疫中重要的识别受体,在机体识别各种病原微生物方面起着重要的作用。检测Toll样受体在感染初期(1dpi)、急性感染期(5dpi)与恢复期(15dpi)的 mRNA 表达水平变化,可探讨IBDV感染对机体免疫反应的影响。本试验应用实时荧光定量PCR方法,构建了内参基因β-actin及TLR3、TLR4、TLR15的标准曲线,利用内参基因β-actin消除mRNA的提取效率和反转录效率间的差异,结果可信度高,为检测鸡TLR3、TLR4、TLR15的表达水平提供了方法。
TLR3主要识别双链RNA分子,在人类类风湿性关节炎等自身性免疫性疾病中的表达上调[9]。刘爵等应用间接免疫荧光和免疫印记技术验证在TLR3基因沉默的细胞里,病毒VP2蛋白表达量下降,细胞中病毒滴度下降[10],表明 TLR3在IBDV感染过程中起重要作用。本试验中,BBMC和PBMC中TLR3mRNA表达水平在不同的时间段均表达上调,且差异显著,推测TLR3可能在机体识别病毒中起作用。TLR4存在于多种细胞中,主要识别细菌的脂多糖,近年来有哺乳动物在病毒感染中TLR4表达量变化的报道[11],证明TLR4在病毒的免疫防御中有重要作用,推测TLR4在禽类病毒感染中可能有相似的作用。本试验中,BBMC和PBMC中,TLR4mRNA表达在急性感染期及恢复期均显著上调,提示TLR4参与了IBDV感染过程中机体免疫系统的激活,IBDV感染后引起的腔上囊急性损伤可能与TLR4介导的炎性反应有关。TLR15是禽类特有的Toll样受体,有报道鸡感染马立克等病毒后也导致TLR15表达上调[12]。本试验显示,BBMC和PBMC中TLR15的mRNA表达水平在感染后1d均显著高于对照组,表明TLR15在感染初期识别IBDV感染中起到重要作用。此后,TLR15在BBMC中恢复至正常水平,而在PBMC中未检测到,提示IBDV感染后期PBMC中TLR15mRNA表达受到抑制。最近有报道,球虫感染的鸡肠道TLRs的表达下调可能导致鸡肠道免疫功能紊乱,增加机体对其他疾病的易感性[13],推测TLR15在IBDV感染中有相似的作用。
综合分析表明,IBDV感染后鸡腔上囊单个核细胞和外周血淋巴细胞中TLR3、4、15mRNA表达均有不同程度的上调,提示IBDV感染早期激活了机体的固有免疫反应,发挥抗病毒作用,其识别病毒的机理及在免疫应答中的作用有待于进一步研究。
[1]Lin Q,Li M,Fang D,etal.The essential roles of Toll-like receptor signaling pathways in sterile inflammatory diseases[J].Int Immunopharmacol,2011,11(10):1422-1432.
[2]Brownlie R,and B.Allan.Avian toll-like receptors[J].Cell and Tissue Research,2010,343:121-130.
[3]Karpala A J,Lowenthal J W,Bean A G.Activation of the TLR3pathway regulates IFNβproduction in chickens[J].Dev Comp Immunol,2008,32(4):435-444.
[4]Hermann Müller,Md.Rafiqul Islam,Rüdiger Raue.Research on infectious bursal disease-the past,the present and the future[J].Veterinary Microbiology,2003,97:153-165.
[5]Khatri M,Palmquist J M,Cha R M,etal.Infection and activation of bursal macrophages by virulent infectious bursal disease virus[J].Virus Res,2005,113(1):44-50.
[6]Poonia B,Charan S:Infiltration by CD4+and CD8+lymphocytes in bursa of chickens infected with Infectious Bursal Disease Virus(IBDV):strain-specific differences[J].Indian J Exp Biol,2004,42(8):823-829.
[7]Li,Y.P.,D.D.Bang,K.J.Handberg,etal.Zhang.E-valuation of the suitability of six host genes as internal control in real-time RT-PCR assays in chicken embryo cell cultures infected with infectious bursal disease virus[J].Vet Microbiol,2005,110:155-165.
[8]Livak K J,Schmittgen T D.Analysis of relative gene expression data using real-time quantitative PCR and the 2(-Delta Delta C(T))Method[J].Methods.2001,25(4):402-408.
[9]Takii Y,Nakamura M,Ito M,etal.Enhanced expression of type I interferon and toll-like receptor 3in primary biliary cirrhosis[J].Lab Invest,2005,85(7):908-920.
[10]施蕾,韦莉,刘爵.TLR3在鸡传染性法氏囊病病毒感染过程中的作用[A].中国畜牧兽医学会禽病学分会第十四次学术研讨会论文集[C].北京:中国畜牧兽医学会,2008:139.
[11]Machida,K.,K.T.Cheng,etal.Hepatitis C virus induces toll-like receptor 4expression,leading to enhanced production of beta interferon and interleukin-6[J].J Virol,2006,80:866-874.
[12]Heidari,M.,A.J.Sarson,M.Huebner,etal.Marek’s disease virus-induced immuno suppression:array analysis of chicken immune response gene expression profiling[J].Viral Immunol,2010,23:309-19.
[13]Lindsay H.Sumners,Kate B.Miska,Mark C.Jenkins,et al.Expression of Toll-like receptors and antimicrobial peptides during Eimeria praecox infection in chickens[J].Experimental Parasitology,2011,127:714-718.
