沃尼妙林人工抗原的合成与鉴定
2012-11-23李伟岭岳永波李金明孔瑞岗刘海亮
李伟岭,岳永波,李金明,孔瑞岗,刘海亮
(河北远征药业有限公司 河北省兽药工程技术研究中心,河北 石家庄050041)
沃尼妙林(valnemulin,Val)是新一代截短侧耳素(pleuromutilin)类半合成的动物专用抗生素,属二萜烯类,与泰妙菌素属同一类药物,主要用于猪支原体肺炎、猪痢疾、猪结肠炎和猪回肠炎的治疗[1-3]。现已上市的沃尼妙林原料药为盐酸沃尼妙林,其化学结构式见图1,化学名为[[2-[[(2R)-2-氨基-3-甲基-1-氧代丁基]氨基]-1,1- 二甲基乙基]硫基]乙酸(3aS,4R,5S,6S,8R,9R,9aR,10R)-6-乙烯基十氢-5-羟基-4,6,9,10-四甲基-1-氧代-3a,9-丙 醇-3aH-环戊二烯并环辛烯-8-基酯盐酸盐,性状为白色或淡黄色非结晶性粉末,具有吸湿性,在水、无水乙醇中易溶,在甲基叔丁基醚中几乎不溶,熔点为174℃~177℃,比选度为15.5℃~18.0℃,pH 值为3.0~6.0[4-7]。

图1 盐酸沃尼妙林的化学结构式
沃尼妙林的抗菌机理与泰妙菌素相似,能与病原微生物核糖体上的50S亚基结合,抑制蛋白质的合成[8]。沃尼妙林具有治疗效果好、消除快、不易产生耐药性等特点,越来越受世界各国的关注。但动物试验表明,其亦可引起一些不良反应[9]。此外,沃尼妙林可与盐霉素、沙拉里菌素、马杜霉素等相互作用,导致动物出现中毒症状,甚至死亡[10]。因此,其对人体的健康具有潜在危害,目前EMEA规定沃尼妙林在猪体内的最大残留限量为肝脏:500μg/kg、肾脏:100μg/kg、肌肉:50μg/kg[11]。目前,对沃尼妙林尚未有一种公开发表的稳定、可靠的残留检测方法,可能是由于沃尼妙林的最大吸收在近紫外区,各种杂质对其检测影响较大,这无疑增大了其残留检测的难度。免疫化学分析以抗原抗体间的特异性结合为原理,可避开上述困难而独具优势。免疫化学分析的主要影响因素是抗体的特异性和亲和性,这取决于免疫抗原的分子结构。因此,沃尼妙林人工抗原的合成与鉴定是产生特异性抗体以及建立沃尼妙林兽药残留分析方法的基础和关键。
1 材料
1.1 材料与试剂 沃尼妙林为自制,HPLC经面积归一化法测其纯度为98.7%;牛血清白蛋白(BSA),购自Sigma公司;低分子量蛋白质标准,购自华美生物有限公司,其他试剂均为国产分析纯试剂。
1.2 仪器与设备 红外分光光度计(NicoletGC/IR Interface Magna-IRTMspect rometer 550),蛋白层析仪(Pharmacia AKTA FPLC),紫外分光光度计(HP8452),水平电泳仪(Bio-Rad),冻干机(DF-3-550-MP),荧光光谱仪(F-2500,日本日立公司)。
2 方法
2.1 沃尼妙林人工抗原的合成 将15mg沃尼妙林、10mL 1mol/L盐酸加至50mL三口瓶中,搅拌,冰水浴降温。于0℃~5℃滴加预冷的1%亚硝酸钠水溶液,直至碘化钾-淀粉试纸变蓝,避光、保温反应30min,制得重氮盐溶液。将300mg BSA、20mL硼砂-硼酸缓冲溶液(0.2mol/L,pH 值8.7)加至另一50mL三口瓶中,搅拌,冰水浴降温。于4℃下滴加上述重氮盐溶液,滴加过程中用5%氢氧化钠溶液调节pH值约为8,滴加完毕保温反应24h。然后,将反应液装入预处理好的透析袋中,用蒸馏水透析3d,每天换液4次,真空冷冻干燥制得褐色絮状人工抗原。此人工抗原记作Val-BSA,-20℃保存,备用。
2.2 沃尼妙林人工抗原的鉴定
2.2.1 IR鉴定 取1mg冻干的人工抗原与适量KBr混匀研细,压片后,进行IR扫描。同法对BSA和Val分别进行IR扫描,对照三者的IR图谱。
2.2.2 SDS-PAGE鉴定 取适量人工抗原、BSA及标准蛋白,分别溶于纯化水中,在5%浓缩胶、12%分离胶中进行SDS-PAGE凝胶电泳分析。
2.2.3 UV鉴定 取适量冻干的人工抗原、沃尼妙林与BSA,分别溶于10mL甲醇/水溶液(V/V=1∶1)中,分别进行UV扫描,对照三者的UV图谱。
2.2.4 荧光光谱鉴定 分别取沃尼妙林、牛血清白蛋白及人工抗原适量,加50%甲醇水溶液配制成适宜浓度的试液,将各试液分别置于1cm石英比色池中,设置空白溶剂为50%甲醇水溶液,激发波长为278nm,激发和发射单色仪的狭缝宽度均为5nm,扫描速度为240nm/min,扫描范围为320~500 nm,进行荧光发射光谱扫描。
3 结果与讨论
3.1 IR鉴定结果 如图2所示,BSA与Val-BSA的IR图谱区别很小,很难判断沃尼妙林是否与载体蛋白BSA偶联形成人工抗原。
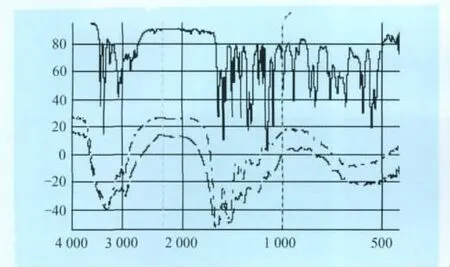
图2 红外光谱鉴定Val-BSA
理论上,利用IR鉴定人工抗原是否合成是可行的,但是一些半抗原药物分子相对于大分子量的载体蛋白因分子量较小,其结构信息被掩埋在载体蛋白的结构信息中,从而难于辨别人工抗原是否合成成功。
3.2 SDS-PAGE鉴定结果 如图3所示,偶联物Val-BSA与BSA的电泳图稍有差别,但区别并不明显。
吴定[12]利用SDS-PAGE凝胶电泳确定了磺胺甲基嘧啶-BSA人工抗原的成功合成。SDS-PAGE凝胶电泳的迁移率主要取决于蛋白质分子量,与蛋白质所带电荷和形状无关。因此,在一定条件下蛋白质的分子量与电泳的迁移率之间存在相应的关系,可以通过蛋白质迁移率的差异判定蛋白质的分子量。利用SDS-PAGE凝胶电泳鉴定人工抗原时,是否可以通过提高电泳胶的长度和适量提高胶的浓度来提高电泳的分辨率还有待进一步研究。
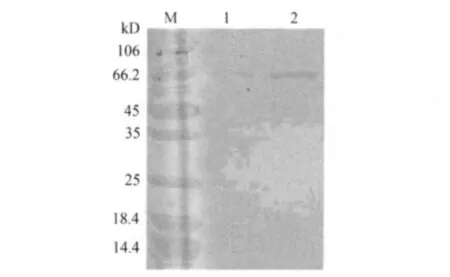
图3 SDS-PAGE鉴定 Val-BSA
3.3 UV鉴定 如图4所示,沃尼妙林在218nm处有特征吸收峰,BSA在228nm和278nm处有两个特征吸收峰,而沃尼妙林人工抗原Val-BSA也存在两个特征吸收峰,分别位于228nm和266nm处,它保留了BSA在228nm处的紫外特征吸收峰,但由于沃尼妙林的氨基与BSA发生了偶联反应,所以人工抗原Val-BSA的紫外峰形发生了改变,说明沃尼妙林半抗原与载体蛋白BSA已经偶联,沃尼妙林人工抗原合成成功。
3.4 荧光光谱鉴定 在人工抗原的制备过程中,半抗原以特定的基团(如氨基-NH2、羧基-COOH等)通过相应的反应连接到载体蛋白BSA上。BSA上色氨酸、酪氨酸、组氨酸的存在使其具有内源荧光。本文中,通过重氮化偶联法使沃尼妙林与BSA上的色氨基酸、酪氨基酸、组氨酸等残基偶联,由于BSA产生荧光主要是这些氨基酸的贡献,一旦有其他基团连接上后必然改变其荧光光谱特性。图5是沃尼妙林人工抗原的荧光光谱图,从图中可看出,沃尼妙林人工抗原的最大发射波长与牛血清白蛋白BSA相比发生了明显位移,表明沃尼妙林人工抗原已经成功合成。
综上所述,本文根据沃尼妙林的分子结构特点,采用重氮化法成功合成其人工抗原;对照4种鉴定方法,发现紫外光谱法和荧光光谱法是沃尼妙林人工抗原的有效鉴定方法,为下一步的沃尼妙林免疫化学分析方法的建立奠定了基础。
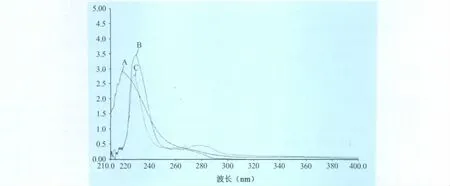
图4 沃尼妙林人工抗原的紫外图谱
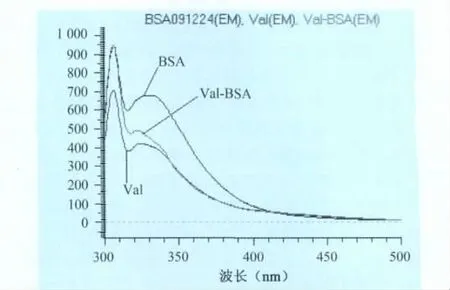
图5 沃尼妙林人工抗原的荧光光谱图
[1]Bemer H,Vypiei H.Pleuromutilin derivatives and their use[P].EP:0153277,1985.
[2]European Pharmacopoeia Commission.European Pharmacopoeia(5.4)[M].5th ed.Ottawa,Canada:Renouf Publishing Company Ltd,2007:4043-4044.
[3]Hirokama Y,Kinoshita H,Tanaka T,etal.Water-soluble pleurotilin derivative with excellet in vitro and in vivo antibacterial activity against Gram-positive pathogens[J].Med Chem,2008,51(7):1991-1994.
[4]Springer D M,Sorenson M E,Huang S,etal.Synthesis and activity of a C-8keto pleurotilin derivative[J].Bioorg Med Chem Lett,2003,13(10):1751-1753.
[5]吴汝林,王倩茹.盐酸沃尼妙林的工艺研究[J].现代化工,2009,29(12):60-61.
[6]冯德鑫,李新乐,潘强,等.盐酸沃尼妙林的合成[J].中国医药工业杂志,2010,41(4):244-246.
[7]Koller K,Schwarz F.Formulation of valnemulin[P].US:6284792,2001-09-04.
[8]Poulsen S,Karlsson M,Johansson L,etal.The Pleuromutilin Drugs Tiamulin and Valnemulin Bind to the RNA at the Peptidyl Transferase Centre on the Ribosome[J].Mol Microbiol,2004,41(5):1091-1099.
[9]EMEA.Econor,INN -Valnemulin[DB/OL].http://www.emea.europa.eu/vetdocs/PDFs/EPAR/econor/003199en6.pdf,2004.
[10]Stipkovits L,Ripley P H,Tenk M.The efficacy of valnemulin(Econor)in the control of disease caused by experimental infection of calves with Mycoplasma bovis[J].Research in veterinary Science,2005,78:207-215.
[11]EMEA.Committee for veterinary medicinal products(valnemulin)summary report[DB/OL].http://www.emea.europa.eu/pdfs/vet/mrls/033998en.pdf,1998.
[12]吴定,张羽航,姚汝华.ELISA测定乳中磺胺甲基嘧啶残留[J].中国兽医学报,1999,19(2):175-177.
