TaqMan探针结合COLD-PCR原理定量检测JAK2V617F突变率研究
2012-11-23梁国威邵冬华曹清芸王树琴王新华徐雪松
梁国威,邵冬华,曹清芸,王树琴,王新华,徐雪松
(1.航天中心医院 检验科,北京100049;2.吉林大学中日联谊医院,吉林 长春130033)
2005年多个研究组同时发现JAK2V617F(JAK2蛋白酪氨酸激酶基因)第1849位点突变(G>T)与骨髓增殖性疾病(MPDs)有关,该突变可明显导致真性红细胞增多症(PV)、特发性血小板增多症(ET)和骨髓纤维化(IMF)的发生和发展[1-5]。2008年世界卫生组织(WHO)将JAK2V617F突变纳入到上述疾病的诊断标准中[6]。由于JAK2 V617F是获得性造血干细胞突变,骨髓和外周血中JAK2V617F呈不同细胞系的突变。Xu X[7]等报道在37例非MDPs诊断的JAK2V617F患者中,有25例JAK2V617F突变率小于5%,因此,对于JAK2V617F检测方法的敏感性,特别是少量突变克隆株的检测,显得尤为重要。
2008年,LI等[8]报道较低变性温度下复合扩增聚合酶链反应(COLD-PCR)可显著提高少量突变的检出率。其中快速COLD-PCR适用于变性温度(Tc)值降低的突变,其原理是(1)任何一段DNA序列都有其严格、特定的Tc值,Tc值不同可致扩增效率产生巨大差异;(2)当PCR反应的Tc值设定在突变(如G:C>A:T;G:C>T:A等)DNA序列时,由于该Tc值低于野生型DNA片段,导致PCR扩增中野生型DNA片段的双链大部分不能完全打开,而该Tc值可使得突变型DNA片段大部分双链打开,由此即可实现对突变型DNA片段进行富集,然后进行分析。
由于JAK2V617F突变是G>T点突变,适合快速COLD-PCR方法,因此,本研究采用TaqMan/MGB突变探针作为突变碱基的指示信号,结合快速COLD-PCR原理,建立高敏感性的在外周血基因组DNA中定量检测JAK2V617F的突变率的Taq-Man-COLD-PCR方法。
1 材料与方法
1.1 纯合野生、纯合突变和外周血基因组DNA提取 采用天根生化科技(北京)有限公司的血液、细胞、组织基因组DNA提取试剂盒(目录号:DP304-02),按试剂盒说明操作。提取的基因组DNA在-80℃冻存备用。其中纯合JAK2V617F突变细胞株(HEL,人红白细胞白血病细胞,购自中国科学院细胞库)经细胞培养至指数增长期后,提取基因组DNA;纯合野生(健康志愿者)和患者EDTA抗凝外周全血200μl用于基因组DNA提取。
1.2 质粒标准品的制备和基因组DNA浓度校准采用特异引物分别扩增纯合突变和纯合野生JAK2基因中第13外显子至第14-15间内含子共计1 818 bp,按常规方法构建JAK2V617F野生和突变质粒标准品,构建的质粒标准品经测序确认,并根据重组质粒分子量将质粒标准品换算并稀释成1×109~1×105拷贝数/ml。以质粒标准品作为实时荧光定量PCR检测标准曲线,将提取的HEL细胞株、健康志愿者和患者外周血基因组DNA的浓度校准为5.0×107拷贝数/ml。
1.3 JAK2V617F突变率标准品配制 将浓度为5.0×107拷贝数/ml的健康志愿者基因组DNA作为稀释基质,加入同等浓度的HEL细胞基因组DNA,进行浓度梯度稀释,配制成100%-0.1%的JAK2V617F突变标准品。
1.4 TaqMan-COLD-PCR引物和探针 上游引物:5′-TTG AAG CAG CAA GTA TGA TGA GC-3′;下游引物:5′-AGA AAG GCA TTA GAA AGC CTG TAG T-3′(由北京赛百盛基因技术有限公司合成)。TaqMan/MGB突变探针:与突变碱基匹配(其中下划线碱基是突变碱基),5′-FAM-TCC ACA GAA ACA TAC-MGBNFQ-3′;TaqMan/MGB通用探针:避开突变碱基,其与突变和野生皆可完全匹配,5′-VIC-ACA TAC TCC ATA ATT TA-MGBNFQ-3′,TaqMan/MGB探针由美国ABI公司合成。
1.5 检测仪器和反应体系构成 20μl反应体系,包括Taqman GT Master Mix 2×(购自美国ABI公司,目录号:4371355)10μl,探针1μl(终浓度0.25μM),上、下游引物各2μl(终浓度分别是0.2 μM),模板2μl(浓度5.0×107拷贝数/ml),水2 μl。其中,浓度校准和选择TaqMan-COLD-PCR 的Tc值时,采用TaqMan/MGB通用探针;检测JAK2 V617F突变率的标准曲线和标本检测采用Taq-Man/MGB突变探针。浓度校准仪器采用7500Real-Time PCR系统(美国ABI公司 );TaqMan-COLD-PCR Tc值的选择和检测方法建立采用Rotor-Gene Q real-time PCR分析系统 (美国QIAGEN公司)。
1.6 扩增条件 TaqMan-COLD-PCR Tc值的选择:(1)95℃,10min;(2)95℃-76℃,15s,62℃,40 s(读荧光值),50个循环,以确定最佳Tc值。JAK2 V617F突变率检测:(1)95℃,10min,(2)95℃,15 s;62℃,40s;8个循环,(3)79.0℃,15s;62℃,60s(读荧光值);50个循环。
1.7 临床标本检测 共计9例患者,其中真性红细胞增多症患者(PV)8例,骨髓纤维化患者(IMF)1例,采用建立的 TaqMan-COLD-PCR方法检测JAK2V617F突变率,测序确认。
1.8 统计学方法 JAK2V617突变率与循环阈值(Ct值)间的相互关系和定标曲线的建立采用直线回归分析,采用SPSS10.0统计软件进行统计分析,以P<0.05作为差别有显著性的标准。
2 结果
2.1 选择 TaqMan-COLD-PCR 的Tc值 分别以5.0×107拷贝数/ml浓度的人HEL细胞株和健康志愿者外周血基因组DNA作为模板,以TaqMan/MGB通用探针作为检测信号,逐渐降低变性温度,由95.0℃降至78.7℃。根据以下原则确定Taq-Man-COLD-PCR的Tc值:(1)突变和野生反应体系扩增曲线的Ct值差别最大;(2)突变反应体系的扩增效率最佳;最终确定TaqMan-COLD-PCR的Tc值是79.0℃,见图1。
2.2 TaqMan-COLD-PCR检测JAK2V617F突变率标准曲线的建立 将Tc值设定为79.0℃,将浓度5.0×107拷贝数/ml的含有100%、10%、1%和0.1%的JAK2V617突变的标准品同时重复测定2次。结果显示,检测突变率的下限是0.1%,JAK2突变率的对数值与Ct值间呈线性关系,线性回归分析显示:r=0.993,P<0.001,线性回归方程是:y=-0.196x+4.186。因此,根据测定的患者标本Ct值,通过回归方程计算即可获得该患者JAK2 V617F突变率,计算公式是:JAK2V617F突变率=10(4.186-0.196×Ct值)。见图2。

图1 TaqMan-COLD-PCR选择Tc值的扩增曲线图
2.3 TaqMan-COLD-PCR方法检测患者标本结果
测定体系包括100%-0.1%突变率标准品和100%野生纯合标准品作为阴性对照,采用建立的TaqMan-COLD-PCR方法对9例患者标本进行检测,扩增曲线见图3。测定的9例患者中,真红8例,骨髓纤维化1例,8例真红中的6例患者JAK2 V617F突变率为18.5%-50.9%,2例真红和1例骨髓纤维化患者JAK2突变率为阴性。

图2 TaqMan-COLD-PCR检测JAK2V617F突变率PCR扩增曲线图和定标曲线图
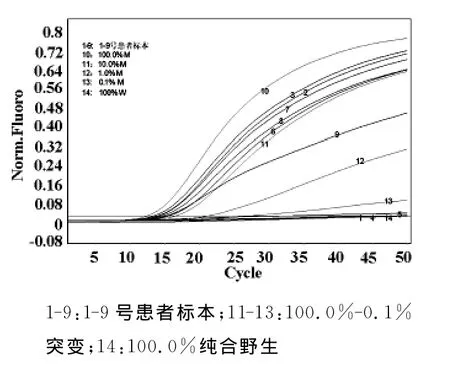
图3 TaqMan-COLD-PCR测定9例患者标本扩增曲线图
2.4 患者标本测序结果
将9例患者标本通过常规PCR扩增后测序(扩增条件和引物同质粒标准品的制备),结果显示,TaqMan-COLD-PCR与测序结果全部符合。见图4。
3 讨论
本研究采用TaqMan/MGB探针作为检测信号,结合COLD-PCR扩增原理,成功建立了在外周血中定量检测JAK2V617F突变率的TaqMan-COLD-PCR方法,该方法通过测定患者外周血基因组DNA的Ct值,再根据突变率与Ct值的标准曲线回归方程,计算该测定标本中JAK2V617F的突变率。所建立 TaqMan-COLD-PCR 检测方法 可 对JAK2V617F突变率进行定量检测,并具有高突变检测敏感性、高通量检测、快速和无污染等特点,由于采用外周血标本进行检测,还具有操作简单的特点。
本研究建立的JAK2V617F突变率检测方法的检测下限是0.1%,明显优于其它JAK2V617F的检测方法。文献报道,DNA直接测序方法检测突变率的下限为20%[3];等位基因特异PCR方法 敏感性为1%-3%[9];荧光定量PCR-ARMS原理和溶解曲线方法的敏感性为1%[10,11],限制性片段长度多态性 (RFLP)的敏感性为20% 左右[4]。由 于JAK2V617F已作为骨髓增殖性疾病重要的分子诊断标志物,提高该突变检测下限的敏感度将有助于临床对该类疾病的早期诊断。
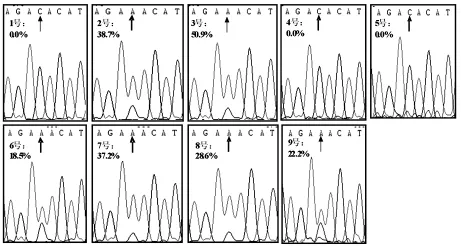
图4 9例患者外周血基因组DNA中JAK2 V617F突变测序结果
COLD-PCR检测微量突变的原理是基于相同的DNA序列中野生和突变的变性温度不同所导致的扩增效率差异,对于G:C与T:A的突变导致Tc值仅存在1℃的差异[12],本研究在 TaqMan-COLDPCR Tc值的选择中也观察到突变和野生间的扩增效率差异仅相差1℃(79.6℃-78.7℃),在既保证扩增效率又保证扩增效率差异的条件下,每0.1℃的变性温度改变都对实验有明显影响,因此,选择高精度温控的PCR扩增仪非常重要,PCR分析仪升温达到Tc值的温度过冲和孔间温差是影响本实验精确度和重复性的关键因素。
由于JAK2V617F是获得性造血干细胞突变,因此骨髓和外周血中JAK2V617F呈不同细胞系的突变。在外周血中,除粒系外,其它细胞系的基因组DNA 中皆不携带JAK2V617F突变[1,2,4],因此,采用外周血基因组DNA检测JAK2V617F突变率不能达到100%。本研究通过建立的TaqMan-COLD-PCR方法测定了9例患者外周血中JAK2V617F突变情况,其中6例阳性患者的JAK2V617F突变率为18.5%-50.9%,除外淋巴细胞基因组后,6例患者外周血中JAK2V617F突变率是26.2%-62.3%。
采用紫外分光光度计进行基因组DNA浓度校准,通过Real-time PCR定量检测时,其拷贝数/ml并不相同,因此本研究首先对所有的基因组DNA中JAK2基因拷贝数/ml的浓度进行校准,然后再进行JAK2V617F突变率标准曲线的建立和患者标本检测。通过对基因组DNA进行拷贝数/ml的浓度校准,使得本研究中JAK2V617F突变率的检测更为准确。
综上所述,本研究建立的TaqMan-COLD-PCR方法,以外周血基因组DNA作为检测标本,可对JAK2V617F突变率进行定量检测,突变率检测下限为0.1%,该方法在一个反应体系内即可完成检测,具有操作简单、高通量检测标本、重复性好、检测报告时间短等特点。由于JAK2V617F突变已作为骨髓增殖性疾病的分子诊断标志物,该方法将明显提高骨髓增殖性疾病的诊断灵敏度,并有助于上述疾病治疗过程中治疗效果的监测。
[1]James C,Ugo V,Le Couedic JP,et al.A unique clonal JAK2mutation leading to constitutive signalling causes polycythaemia vera[J].Nature,2005,434(7037):1144.
[2]Kralovics R,Passamonti F,Buser AS,et al.A gain-of-function mutation of JAK2in myeloproliferative disorders[J].N Engl J Med,2005,352(17):1779.
[3]Levine RL,Wadleigh M,Cools J,et al.Activating mutation in the tyrosine kinase JAK2in polycythemia vera,essential thrombocythemia,and myeloid metaplasia with myelofibrosis[J].Cancer Cell,2005,7(4):387.
[4]Baxter EJ,Scott LM,Campbell PJ,et al.Acquired mutation of the tyrosine kinase JAK2in human myeloproliferative disorders[J].Lancet,2005,365(9464):1054.
[5]Zhao R,Xing S,Li Z,et al.Identification of an acquired JAK2mutation in polycythemia vera[J].J Biol Chem,2005,280(24):22788.
[6]Tefferi A,Vardiman JW.Classification and diagnosis of myeloproliferative neoplasms:the 2008World Health Organization criteria and point-of-care diagnostic algorithms[J].Leukemia,2008,22:14.
[7]Xu X,Zhang Q,Luo J,et al.JAK2(V617F):Prevalence in a large Chinese hospital population[J].Blood,2007,109(1):339.
[8]Li J,Wang L,Mamon H,et al.Replacing PCR with COLD-PCR enriches variant DNA sequences and redefines the sensitivity of genetic testing[J].Nat Med,2008,14(5):579.
[9]Jones AV,Kreil S,Zoi K,et al.Widespread occurrence of the JAK2V617Fmutation in chronic myeloproliferative disorders[J].Blood,2005,106(6):2162.
[10]James C,Delhommeau F,Marzac C,et al.Detection of JAK2 V617Fas a first intention diagnostic test for erythrocytosis[J].Leukemia,2006,20(2):350.
[11]McClure R,Mai M,Lasho T.Validation of two clinically useful assays for evaluation of JAK2V617Fmutation in chronic myeloproliferative disorders[J].Leukemia,2006,20(1):168.
[12]Liew M,Pryor R,Palais R,et al.Genotyping of single-nucleotide polymorphisms by high-resolution melting of small amplicons[J].Clin Chem,2004,50(7):1156.
