儿童过敏性紫癜急性期Th17细胞功能和CD4+CD25+调节性T细胞水平变化
2012-11-21刘萍张秋业
刘萍,张秋业
(1 青岛市李沧区中心医院儿科,山东 青岛 266041; 2 青岛大学医学院附属医院儿科)
过敏性紫癜(HSP)是儿童时期最常见的一种自身免疫性血管炎性疾病,临床症状表现为紫癜样皮肤损害以及胃肠道、肾脏、关节等多个系统的损害。HSP急性期有明显免疫功能失调,表现为外周血T淋巴细胞亚群功能紊乱,B淋巴细胞呈多克隆活化,抗体分泌增多及相关细胞因子的改变。HSP病因及发病机制十分复杂,其免疫失衡机制尚未阐明。Th17细胞是最近发现的一种以分泌白细胞介素17(IL-17)为主的效应性T细胞,在自身免疫和促炎症反应方面具有重要作用。CD4+CD25+调节性T细胞(CD4+CD25+Treg)是一群重要的具有免疫调节和免疫抑制双重作用的CD4+T细胞,它对效应性T细胞有抑制作用,是机体维持自身免疫耐受的重要组成部分。业已证实,Th17细胞增加和(或)CD4+CD25+Treg降低与炎症和各种自身免疫性疾病发病密切相关。本文观察了54例HSP病儿急性期外周血IL-17和CD4+CD25+Treg细胞水平变化,以及其与淋巴细胞亚群之间的相关性,以期探讨Th17和CD4+CD25+Treg水平变化在儿童 HSP发病机制中的作用。
1 资料和方法
1.1 对象及分组
1.1.1 HSP组 2009年10月—2010年12月,选取青岛大学医学院附属医院儿科诊治的HSP急性发作期病儿54例,男34例,女20例;年龄3~13岁,平均7.5岁。均符合1990年美国风湿病协会制定的诊断标准[1]。根据是否有血尿或(和)蛋白尿分为肾炎组(HSPN组)23例和非肾炎组(NHSPN组)31例。近期未使用免疫抑制性药物。
1.1.2 对照组 为同期青岛大学医学院附属医院儿童保健门诊健康查体儿童30例,男18例,女12例;年龄2~13岁,平均7.2岁。其中20例应用流式细胞术检测CD4+CD25+Treg亚群,男18例,女2例;年龄2~11岁,平均年龄5.1岁。既往均无过敏性疾病史,采血前4周内无感染及用药史。
1.2 检测指标及方法
1.2.1 标本采集 清晨6:00-7:00时取空腹肘静脉血2 mL,即刻加入无菌肝素管(肝素20 k U/L)充分抗凝,分装入两支试管,一支试管即刻送检;另一试管以1 200 r/min离心10 min,收集血浆,-30℃冰箱保存。
1.2.2 血浆IL-17水平测定 采用双抗体夹心酶联免疫吸附试验(ELISA)法,按试剂盒说明书操作。试剂盒购自上海迪奥生物制品公司(R&D分装)。
1.2.3 CD4+CD25+Treg和淋巴细胞亚群的检测采用流式细胞术,试剂购自美国Beck man-Coulter公司。
1.3 统计学处理
应用SPSS 17.0及PPMS 1.5[2]统计学软件进行数据处理,结果以±s表示,数据间比较采用t检验,两变量间相关性采用直线相关分析法。
2 结 果
2.1 HSP病儿血浆IL-17水平变化
HSP组血浆IL-17水平为(86.65±13.90)ng/L,对照组为(29.75±21.65)ng/L,两组比较差异有极显著意义(t=14.66,P<0.01)。HSPN 组与NHSPN组血浆IL-17水平比较差异无统计学意义(P>0.05)。见表1。
表1 各组血浆IL-17和CD4+CD25+Treg水平比较(±s)

表1 各组血浆IL-17和CD4+CD25+Treg水平比较(±s)
组 别 n IL-17(ρ/ng·L-1)CD4+CD25+Treg(χ/%)对 照 组 30 29.75±21.65 3.93±0.42 NHSPN组 31 89.48±11.22 2.22±1.09 HSPN组23 82.45±16.28 2.29±0.95
2.2 HSP病儿外周血CD4+CD25+Treg水平变化
HSP组病儿外周血CD4+CD25+Treg水平为(2.25±1.02)%,较对照组(3.93±0.42)%明显降低(t=7.28,P<0.01)。HSPN组与NHSPN组外周血CD4+CD25+Treg水平相比较,差异无显著意义(P>0.05)。见表1。
2.3 HSP病儿淋巴细胞亚群水平变化
与对照组比较,HSP组外周血CD4+细胞比例明显降低,CD19+细胞比例升高,差异有统计学意义(t=4.363、7.370,P<0.05);CD3+、CD8+、CD3-CD56+和CD3+HLADR+比例均无明显改变(t=-1.30~1.98,P均>0.05)。HSP组CD4+CD25+Treg的水平与CD4+细胞呈正相关(r=0.554,P<0.01),而与CD19+细胞呈负相关(r=-0.305,P<0.05)。而CD4+CD25+Treg水平与CD8+细胞、CD3+细胞、CD3-CD56+细胞和CD3+HLADR+细胞则无相关性(r=-0.109~0.287,P>0.05)。见表2。
表2 HSP病儿外周血T细胞亚群检测(χ/%,±s)
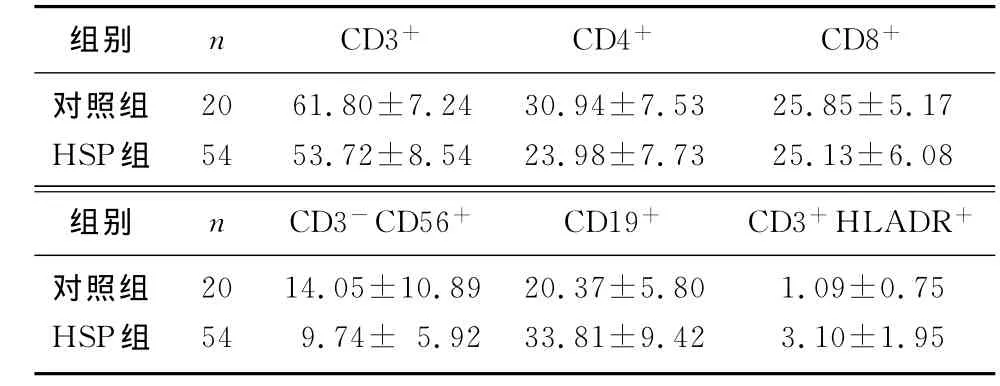
表2 HSP病儿外周血T细胞亚群检测(χ/%,±s)
组别 n CD3+ CD4+ CD8+对照组 20 61.80±7.24 30.94±7.53 25.85±5.17 HSP组 54 53.72±8.54 23.98±7.73 25.13±6.08组别 n CD3-CD56+ CD19+ CD3+HLADR+对照组 20 14.05±10.89 20.37±5.80 1.09±0.75 HSP组54 9.74± 5.92 33.81±9.42 3.10±1.95
2.4 HSP病儿血浆IL-17水平与CD4+CD25+Treg水平相关性
HSP病儿血浆IL-17水平与CD4+CD25+Treg细胞水平呈明显负相关(r=-0.295,P<0.05)。
3 讨 论
HSP是以小血管炎为主要病变的系统性血管炎,是儿童期最常见的免疫性血管炎,可出现紫癜样皮肤损害以及胃肠道、肾脏、关节等多个系统的损害。迄今为止,该病的病因及发病机制仍未完全阐明。前期大量研究结果表明,HSP病儿存在Th1/Th2亚群功能失调,尤其是Th2亚群功能亢进,表明HSP急性期存在免疫功能紊乱[3]。
Th17细胞是一种不同于Th1、Th2的CD4+T细胞亚群,其分泌的最重要的效应因子是IL-17。IL-17与受体结合后,通过活化丝裂原活化的蛋白激酶和NF-k B发挥其生物学效应,并上调IL-1β、TNF-α、IFN-γ等炎症细胞因子的基因表达,促进机体炎症进展。Th17细胞还可分泌IL-6及TNF-α等以动员、募集和分化中性粒细胞,介导促炎症反应,在感染性疾病和自身免疫性疾病的病理过程中发挥重要作用。近期大量文献报道,冠心病、过敏性疾病和自身免疫性疾病如类风湿性关节炎病人IL-17表达增加[4-6]。本实验结果显示,HSP病儿血浆IL-17水平明显增高,与对照组比较差异有显著性,与文献[5]结果相符,说明异常增高的IL-17参与了HSP的发病,在HSP的病理过程中起到重要作用。本文结果还显示,HSPN组与NHSPN组血浆IL-17水平差异无显著性,提示急性期有无肾脏损害的HSP病儿外周血IL-17水平变化并无差异。
研究认为,HSP存在的T细胞功能紊乱不仅仅局限于Th2优势明显,调节性T细胞数量减少导致免疫抑制效应不足也可能是导致HSP免疫失衡的重要原因。Treg细胞是一群重要的同时具有免疫调节和免疫抑制双重作用的CD4+T细胞,其参与了维持外周耐受及抑制自身免疫。Treg细胞既可通过细胞间直接接触、分泌抑制性细胞因子如IL-10、TGF-β等发挥抑制效应,还可下调抗原呈递细胞(APC)上CD80和CD86的表达来影响其抗原呈递能力,并诱导APC分解色氨酸,降低效应性T细胞活性,从而发挥抑制作用。由此可见,Treg细胞对机体免疫应答起着调节与抑制双重作用,使机体免疫系统既清除异物抗原,又不致损伤机体。本研究结果显示,HSP病儿CD4+CD25+Treg细胞水平较对照组显著降低,与文献[7]结果一致。HSP病儿CD4+CD25+Treg细胞与CD4+细胞呈正相关,而与CD19+细胞呈负相关,提示CD4+CD25+Treg细胞异常与HSP发病机制中免疫功能紊乱有密切的关系,表明HSP急性期存在Treg细胞免疫调节及对机体的免疫抑制功能不足,从而引发免疫紊乱。
近年来,Th17/Treg的平衡在维持免疫系统稳态中的作用越来越受到重视。Th17细胞和Treg细胞分别对自体免疫和炎症反应起正向和负向调控作用,同时两种细胞的分化也是互为逆反的过程。RORγt及Foxp3分别是Th17及Treg的特异性转录因子。当机体处于稳定状态下或无炎症损伤时,免疫系统产生的TGF-β浓度较高,可上调Foxp3的表达,诱导Treg的产生,从而维持机体的免疫耐受;而当机体发生感染时,炎症递质IL-6则大量产生,协同低浓度的TGF-β诱导RORγt的产生,从而促进Th17细胞的分化,介导前炎症反应[8]。由此可见,Th17/Treg平衡维持机体免疫平衡,一旦受感染、遗传体质影响,两者的平衡打破,便可引起机体全身或局部的免疫异常反应。既往研究已经证实,Th17增加和(或)Treg降低在大量的炎症和自身免疫性疾病如动脉粥样硬化、肾脏移植排斥等反应中发挥重要的作用[9-10]。本文的研究结果显示,儿童HSP急性期血浆IL-17水平显著增高,同时伴有CD4+CD25+Treg细胞明显降低,且两者呈明显负相关,表明在HSP急性期Th17细胞功能增强而CD4+CD25+Treg细胞免疫抑制效应不足,呈现Th17/Treg失衡状态。Th17/Treg失衡是导致HSP免疫紊乱的重要原因,在HSP发病机制中具有重要作用。如何调整这种平衡或许会为HSP的免疫治疗提供新思路,为临床治疗开辟新的途径。
[1]MILLS J A,MICHEL B A,BLOCH D A,et al.The American College of Rheu matology 1990 criteria for the classification of Henoch-Schonlein pur pura[J].Art hritis Rheu m,1990,33(8):1114-1121.
[2]周晓彬.医用统计学软件PPMS 1.5在医学科学研究中的应用价值[J].青岛大学医学院学报,2011,47(6):504-506.
[3]董胜英,陈彤,张秋业,等.过敏性紫癜病儿急性期外周血辅助性T淋巴细胞亚群功能的变化[J].齐鲁医学杂志,2004,19(2):134-136.
[4]CHENG X,YU X,DING Y J,et al.The Th17/Treg imbalance in patients with acute coronary syndr o me[J].Clin Immunol,2008,127(1):89-97.
[5]杨军,李成荣,王国兵,等.Th17细胞与CD4+CD25+TREG在儿童过敏性紫癜发病机制中的作用[J].临床儿科杂志,2009,27(7):645-648.
[6]YUAN R,MAEDA Y,LI W,et al.Erythr opoietin:a potent inducer of peripheral immuno-infla mmatory modulation in autoimmune EAE[J].PLoS One,2008,3(4):1924-1928.
[7]柏翠,宗金宝,张秋业.过敏性紫癜病儿急性期免疫细胞功能变化[J].齐鲁医学杂志,2010,25(2):137-139.
[8]PARK H,LI Z X,YANG X O,et al.A distinct lieage of CD4 Tcells regulates tissue inflammation by pr oducing interleukin 17[J].Nat Immunol,2005,6(11):1133-1141.
[9]AFZALI B,LOMBARDI G,LECHLER R I,et al.The role of Thelper 17(Th17)and regulatoryTcells(Treg)in human organ transplantation and autoimmune disease[J].Clin ExpImmunol,2007,148(1):32-46.
[10]CEDERBOM L,HALL H,IVARS F.CD4+CD25+regulatory Tcells down-regulate co-stimulatory molecules on antigenpresenting cells[J].Eur J Immunol,2000,30(6):1538-1543.
