单取代苯乙醛及其二氢吡啶衍生物的合成
2012-11-21刘俊杰付清泉
刘俊杰, 高 峻, 付清泉, 唐 卓
(1.四川大学 化学工程学院,四川 成都 610065; 2. 中国科学院 成都生物研究所,四川 成都 610041)
自1881年Hantzsch[1]发现通过醛、β-酮酸酯和氨可以制备3,5-二羧酸酯-1,4-二氢吡啶类化合物以来,此类化合物得到了极大关注。由于二氢吡啶类化合物具有较好的生物活性,可用于治疗疾病,如心血管扩张,高血压,抗肿瘤等[2~5],因此合成此类化合物具有重要的意义。但以苯乙醛类化合物为底物,通过Hantzsch反应来制备相应的二氢吡啶及其生物活性的研究却鲜见报道。
苯乙醛类化合物性质活泼,易于发生氧化、聚合等化学反应,难以购买。对于苯乙醛类化合物的合成方法,虽然有不少报道,如以醇为原料的催化氧化法[6~8],以苯乙烯或环氧苯乙烷为原料的催化异构法[9~11],以格利雅试剂为原料的甲酰化法[12~14],此外还有达让法、电解法等其他方法[15],但普遍存在催化剂使用效率低、成本较高、反应条件较为苛刻、后处理繁琐等不足之处,难以高产率,高纯度制备,从而很大程度上限制了其相应的二氢吡啶类化合物的合成。
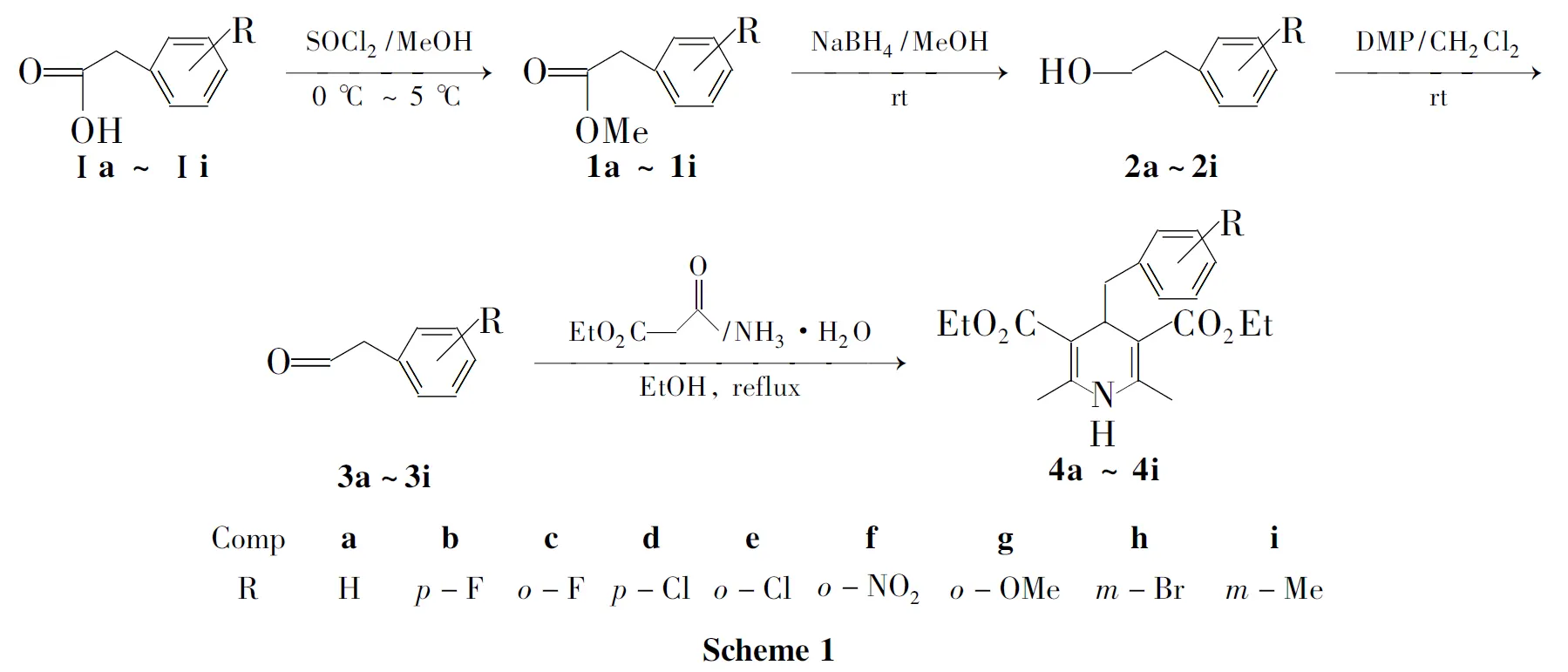
本文以单取代苯乙酸(Ⅰa~Ⅰi)为原料,在SOCl2/MeOH中制得甲酯(1a~1i);用NaBH4/MeOH还原1制得取代苯乙醇(2a~2i);2经戴斯-马丁氧化剂氧化制得单取代苯乙醛(3a~3i);3通过Hantzsch反应合成了相应的1,4-二氢吡啶衍生物——2,6-二甲基-3,5-二乙氧羰基-4-取代苄基-1,4-二氢吡啶(4a~4i, Scheme 1),其结构经1H NMR,13C NMR和MS表征,其中4b~4i为新化合物。
以单取代苯乙酸为底物,通过酯化[16],还原[17],氧化[18]制备3的新方法,反应条件温和、操作简单、收率较高。
1 实验部分
1.1 仪器与试剂
X-6精密熔点仪(温度未校正);Brucker-300型核磁共振仪(CDCl3为溶剂,TMS为内标);Bruker micrOTOF-Q Ⅱ10203型高分辨质谱仪。所用试剂均为分析纯。
1.2 合成
(1)1a~1i的合成(以1a为例)[16]
在圆底烧瓶中加入苯乙酸(Ⅰa) 1.36 g(10 mmol)和无水甲醇20 mL,冰浴冷却,搅拌下缓慢滴加SOCl23 mL,滴毕,反应约1 h(TLC跟踪)。加水淬灭,减压浓缩,残余液用水(50 mL)洗涤至中性,乙酸乙酯(2×30 mL)萃取,合并有机相,用饱和氯化钠溶液(2×50 mL)洗涤,无水NaSO4干燥,减压蒸馏得香槟色液体苯乙酸甲酯(1a) 1.49 g,产率99%。
用类似方法合成无色或浅黄色液体1b~1i,产率均高于95%。
(2)2a~2i的合成(以2a为例)
在圆底烧瓶中加入1a1.35 g(9 mmol)和无水甲醇20 mL,搅拌下于室温加入等摩尔当量的NaBH4至反应终点(TLC跟踪,随着NaBH4的加入,反应体系变得黏稠,可适当添加少量甲醇,有利于反应液顺利搅拌)。加水淬灭,减压浓缩,残余液用水(50 mL)洗涤,乙酸乙酯(2×30 mL)萃取,合并有机相,用饱和氯化钠溶液(2×50 mL)洗涤,无水NaSO4干燥,减压浓缩后经硅胶柱层析[洗脱剂: A=V(石油醚) ∶V(乙酸乙酯)=5 ∶1]纯化得苯乙醇(2a) 0.86 g。
用类似方法合成2b~2i。
2a: 无色液体,产率78%;1H NMRδ: 1.44(brs, 1H, OH), 2.88(t,J=6.6 Hz, 2H, CH2), 3.87(t,J=6.5 Hz, 2H, CH2), 7.22~7.25(m, 3H, PhH), 7.30~7.35(m, 2H, PhH)。
2b: 淡黄色液体,产率87%;1H NMRδ: 1.45(brs, 1H, OH), 2.84(t,J=6.5 Hz, 2H, CH2), 3.84(t,J=6.5 Hz, 2H, CH2), 6.97~7.04(m, 2H, ArH), 7.16~7.21(m, 2H, ArH)。
2c: 无色液体,产率67%;1H NMRδ: 1.47(brs, 1H, OH), 2.93(t,J=6.6 Hz, 2H, CH2), 3.87(t,J=6.6 Hz, 2H, CH2), 7.04~7.11(m, 2H, ArH), 7.20~7.27(m, 2H, ArH)。
2d: 无色液体,产率76%;1H NMRδ: 1.51(brs, 1H, OH), 2.84(t,J=6.5 Hz, 2H, CH2), 3.84(t,J=6.5 Hz, 2H, CH2), 7.15(d,J=8.2 Hz, 2H, ArH), 7.29(d,J=8.3 Hz, 2H, ArH)。
2e: 淡黄色液体,产率74%;1H NMRδ: 1.42(t,J=5.4 Hz, 1H, OH), 3.03(t,J=6.7 Hz, 2H, CH2), 3.89(q,J=6.2 Hz, 2H, CH2),7.17~7.29(m, 3H, ArH), 7.29~7.39(m, 1H, ArH)。
2f: 棕色液体,产率83%;1H NMRδ: 1.63(brs, 1H, OH), 3.17(t,J=6.4 Hz, 2H, CH2), 3.95(t,J=6.3 Hz, 2H, CH2), 7.36~7.44(m, 2H, ArH), 7.55(t,J=7.5 Hz, 1H, ArH), 7.92(d,J=8.0 Hz, 1H, ArH)。
2g: 无色液体,产率77%;1H NMRδ: 1.68(t,J=5.7 Hz, 1H, OH), 2.91(t,J=6.4 Hz, 2H, CH2), 3.81~3.87(m, 5H, CH2, OCH3), 6.86~6.94(m, 2H, ArH), 7.18~7.25(m, 2H, ArH)。
2h: 无色液体,产率83%;1H NMRδ: 1.53(brs, 1H, OH), 2.84(t,J=6.5 Hz, 2H, CH2), 3.85(t,J=6.5 Hz, 2H, CH2), 7.15~7.21(m, 2H, ArH), 7.35~7.39(m, 2H, ArH)。
2i: 淡黄色液体,产率70%;1H NMRδ: 1.59(brs, 1H, OH), 2.34(s, 3H, CH3), 2.90(t,J=6.8 Hz, 2H, CH2), 3.84(t,J=6.8 Hz, 2H, CH2), 7.13~7.20(m, 4H, ArH)。
(3)3a~3i的合成(以3a为例)
在反应瓶中加入DMP(戴斯-马丁氧化剂)3.18 g(7.5mmol)的CH2Cl2(50 mL)溶液,搅拌下于室温缓慢滴加2a0.85 g(7 mmol)的CH2Cl2(少量)溶液,滴毕,反应30 min(TLC跟踪)。过滤(在减压漏斗中从下往上分别填充2 cm的硅藻土和无水硫酸钠),用少量二氯甲烷淋洗两至三遍,滤液用水(50 mL)洗涤,二氯甲烷(2×30 mL)萃取,合并有机相,用饱和氯化钠溶液(2×50 mL)洗涤,无水NaSO4干燥,减压浓缩后经硅胶柱柱层析(洗脱剂: A=10 ∶1)纯化得苯乙醛(3a) 0.51 g。
用类似方法合成3b~3i。
3a: 浅黄色液体,产率60%;1H NMRδ: 3.69(d,J=2.2 Hz, 2H, CH2), 7.21~7.28(m, 2H, PhH), 7.29~7.41(m, 3H, PhH), 9.75(t,J=2.3 Hz, 1H, CHO)。
3b: 浅黄绿色液体,产率55%;1H NMRδ: 3.68(d,J=1.9 Hz, 2H, CH2), 7.03~7.09(m, 2H, ArH), 7.16~7.20(m, 2H, ArH), 9.75(t,J=2.1 Hz, 1H, CHO)。
3c: 浅黄绿色液体,产率58%;1H NMRδ: 3.74(d,J=2.1 Hz, 2H, CH2), 7.08~7.20(m, 3H, ArH), 7.27~7.34(m, 1H, ArH), 9.76(d,J=1.6 Hz, 1H, CHO)。
3d: 浅黄色液体,产率64%;1H NMRδ: 3.68(d,J=1.9 Hz, 2H, CH2), 7.14(d,J=8.3 Hz, 2H, ArH), 7.33(d,J=8.3 Hz, 2H, ArH), 9.74(t,J=2.1 Hz, 1H, CHO)。
3e: 浅黄色液体,产率68%;1H NMRδ: 3.85(d,J=1.5 Hz, 2H, CH2), 7.25~7.29(m, 3H, ArH), 7.42~7.45(m, 1H, ArH), 9.75(t,J=1.6 Hz, 1H, CHO)。
3f: 棕黄色液体,产率78%;1H NMRδ: 4.12(s, 2H, CH2), 7.32(d,J=17.4 Hz, 1H, ArH),7.47~7.53(m, 1H, ArH), 7.60~7.65(m, 1H, ArH), 8.13(d,J=8.2 Hz, 1H, ArH), 9.85(s, 1H, CHO)。
3g: 浅黄色液体,产率70%;1H NMRδ: 3.64(d,J=2.0 Hz, 2H, CH2), 3.83(s, 3H, CH3), 6.90~6.98(m, 2H, ArH), 7.14(d,J=6.0 Hz, 1H, ArH), 7.27~7.33(m, 1H, ArH), 9.68(t,J=2.1 Hz, 1H, CHO)。
3h: 黄色液体,产率68%;1H NMRδ: 3.68(d,J=1.8 Hz, 2H, CH2), 7.14(d,J=7.6 Hz, 1H, ArH), 7.22~7.27(m, 1H, ArH), 7.39(s, 1H, ArH), 7.43(d,J=8.0 Hz, 1H, ArH), 9.75(t,J=1.7 Hz, 1H, CHO)。
3i: 浅黄色液体,产率66%;1H NMRδ: 2.28(s, 3H, CH3), 3.69(d,J=4.3 Hz, 2H, CH2), 7.16~7.23(m, 4H, ArH), 9.70(t,J=2.3 Hz, 1H, CHO)。
精密称取同一批已知含量的六棱菊药材粉末(含量为 0.782 3 mg/g),共 9 份,分成 3 组,即低、中、高加样组(0.5 g药材含量的80%、100%和120%加样,加样量分别为 0.312 0、0.391 5、0.469 5 mg),六棱菊低、中、高加样组的橙皮苷的平均回收率分别为99.60%、99.97%、99.01%,RSD 分别为 2.78%、2.08%、1.36%(n=3),表明该方法准确性良好(表 2)。
(4)4a~4i的合成(以4a为例)
在反应瓶中加入3a0.42 g(3.5 mmol)的乙醇(15 mL)溶液,乙酰乙酸乙酯0.88 mL(7 mmol)和25%氨水0.93 mL(12 mmol),氮气保护,搅拌下回流反应过夜(TLC跟踪)。减压浓缩,残余液用水(50 mL)洗涤,乙酸乙酯(2×30 mL)萃取,合并有机相,用饱和氯化钠溶液(2×40 mL)洗涤,无水NaSO4干燥,减压浓缩后经硅胶柱柱层析(洗脱剂: A=5 ∶1)纯化得2,6-二甲基-4-苄基-3,5-二乙氧羰基-1,4-二氢吡啶(4a) 0.55 g。
用类似方法合成4b~4i。
4a: 白色固体,产率46%, m.p.115 ℃~116 ℃;1H NMRδ: 1.23(t,J=7.1 Hz, 6H, CH3), 2.17(s, 6H, CH3), 2.57(d,J=5.5 Hz, 2H, CH2), 3.99~4.14(m, 4H, CH2), 4.20(t,J=5.5 Hz, 1H, CH), 5.27(brs, 1H, NH), 7.00(d,J=5.8 Hz, 2H, PhH), 7.11~7.20(m, 3H, PhH);13C NMRδ: 14.3, 19.1, 35.4, 42.3, 59.5, 101.7, 125.5, 127.2, 130.0, 139.2, 145.4, 167.8; ESI-MSm/z: Calcd for C20H25NO4Na{[M+Na]+} 366.168 1, found 366.168 7。
4b: 白色固体,产率40%, m.p.128 ℃~130 ℃;1H NMRδ: 1.24(t,J=7.1 Hz, 6H, CH3), 2.15(s, 6H, CH3), 2.53(d,J=5.3 Hz, 2H, CH2), 4.02~4.14(m, 4H, CH2), 4.16(t,J=4.1 Hz, 1H, CH), 5.45(brs, 1H, NH), 6.85(t,J=8.8 Hz, 2H, ArH), 6.92~6.97(m, 2H, ArH);13C NMRδ: 14.3, 19.1, 35.4, 41.2, 59.6, 101.5, 113.7, 114.0, 131.2, 131.3, 134.9(d,J=3.2 Hz), 145.5, 159.9, 163.1, 167.7; ESI-MSm/z: Calcd for C20H24NO4FNa{[M+Na]+} 384.158 7, found 384.159 8。
4c: 白色固体,产率56%, m.p.114 ℃~116 ℃;1H NMRδ: 1.21(t,J=7.1 Hz, 6H, CH3), 2.19(s, 6H, CH3), 2.63(d,J=5.6 Hz, 2H, CH2), 3.98~4.09(m, 4H, CH2), 4.27(t,J=5.7 Hz, 1H, CH), 5.65(brs, 1H, NH), 6.90~7.00(m, 3H, ArH), 7.06~7.11(m, 2H, ArH);13C NMRδ: 14.2, 19.2, 34.5, 35.0, 59.5, 101.7, 114.2, 114.5, 122.9(d,J=3.4 Hz), 126.1, 126.4, 127.4, 127.5, 132.5, 132.6, 145.5, 160.2, 163.4, 167.7; ESI-MSm/z: Calcd for C20H24NO4FNa{[M+Na]+} 384.158 7, found 384.157 7。
4e: 白色固体,产率63%, m.p.134 ℃~136 ℃;1H NMRδ: 1.21(t,J=7.1 Hz, 6H, CH3), 2.24(s, 6H, CH3), 2.72(d,J=6.4 Hz, 2H, CH2), 3.90~4.06(m, 4H, CH2), 4.35(t,J=6.4 Hz, 1H, CH), 5.80(brs, 1H, NH), 6.98~7.23(m, 3H, ArH), 7.06(d,J=5.5 Hz, 1H, ArH);13C NMRδ: 14.2, 19.2, 33.8, 38.9, 59.5, 101.9, 125.6, 127.1, 128.8, 132.4, 135.0, 136.8, 145.7, 167.6; ESI-MSm/z: Calcd for C20H24NO4ClNa{[M+Na]+} 400.129 2, found 400.129 0。
4f: 黄色固体,产率32%, m.p.150 ℃~151 ℃;1H NMRδ: 1.23(t,J=7.1 Hz, 6H, CH3), 2.21(s, 6H, CH3), 3.01(d,J=6.2 Hz, 2H, CH2), 3.97~4.11(m, 4H, CH2), 4.31(t,J=6.1 Hz, 1H, CH), 5.46(brs, 1H, NH), 7.16(d,J=7.7 Hz, 1H, ArH), 7.38(m, 2H, ArH), 7.75(d,J=8.1 Hz, 1H, ArH);13C NMRδ: 14.2, 19.3, 35.0, 37.2, 59.7, 101.4, 123.9, 126.7, 131.4, 133.7, 133.9, 146.1, 150.6, 167.2; ESI-MSm/z: Calcd for C20H24N2O6Na{[M+Na]+} 411.153 2, found 411.150 7。
4g: 白色固体,产率34%, m.p.111 ℃~113 ℃;1H NMRδ: 1.24(t,J=7.1 Hz, 6H, CH3), 2.16(s, 6H, CH3), 2.63(d,J=5.5 Hz, 2H, CH2), 3.72(s, 3H, CH3), 4.00~4.11(m, 4H, CH2), 4.25(t,J=5.4 Hz, 1H, CH), 5.45(brs, 1H, NH), 6.71~6.77(m, 2H, ArH), 6.91(dd,J=1.3 Hz, 1.2 Hz, 1H, ArH), 7.07~7.13(m, 1H, ArH);13C NMRδ: 14.3, 19.1, 34.5, 35.4, 55.1, 59.3, 102.0, 109.4, 119.4, 126.9, 127.8, 131.8, 145.0, 158.1, 167.9; ESI-MSm/z: Calcd for C21H27NO5Na{[M+Na]+} 396.178 7, found 396.177 3。
4h: 白色固体,产率35%, m.p.92 ℃~94 ℃;1H NMRδ: 1.24(t,J=7.1 Hz, 6H, CH3), 2.16(s, 6H, CH3), 2.52(d,J=4.8 Hz, 2H, CH2), 4.02~4.11(m, 4H, CH2), 4.15(d,J=4.0 Hz, 1H, CH), 5.69(brs, 1H, NH), 6.88(d,J=7.3 Hz, 1H, ArH), 6.98(t,J=7.6 Hz, 1H, ArH), 7.18~7.37(m, 2H, ArH);13C NMRδ: 14.3, 19.1, 35.4, 41.8, 59.7, 101.4, 121.3, 128.6, 128.7, 128.8, 133.0, 141.7, 145.7, 167.6; ESI-MSm/z: Calcd for C20H24NO4BrNa{[M+Na]+} 444.078 6, found 444.077 7。
4i: 白色固体,产率41%, m.p.96 ℃~97 ℃;1H NMRδ: 1.17(t,J=7.1 Hz, 6H, CH3), 2.30(s, 6H, CH3), 2.38(s, 3H, CH3), 2.57(d,J=6.9 Hz, 2H, CH2), 3.81~3.87(m, 2H, CH2), 3.93~4.14(m, 2H, CH2), 4.24(t,J=7.0 Hz, 1H, CH), 5.58(brs, 1H, NH), 6.88(d,J=6.6 Hz, 1H, ArH), 6.98~7.23(m, 3H, ArH);13C NMRδ: 39.5, 59.5, 102.6, 124.9, 125.9, 129.6, 131.0, 137.1, 145.2, 167.7; ESI-MSm/z: Calcd for C21H27NO4Na{[M+Na]+} 380.183 8, found 380.183 4。
2 结果与讨论
将苯乙酸衍生物直接还原为相应的醇(1→2)较难实现。虽然文献[19]方法提到可以用NaBH4/I2体系作还原剂,但是存在反应时间过长、反应温度较高等缺点。本文采用的方法可以克服这些不足,即首先将苯乙酸的甲醇溶液在二氯亚砜作用下,高产率地制得苯乙酸甲酯;再使用NaBH4/MeOH体系还原制得相应的醇。反应条件温和、操作简单、收率较高。这是到目前为止,以苯乙酸为底物制备苯乙醇的一种全新方法。值得注意的是,在还原酯的过程中,NaBH4用量要过量(>3 eq)才会较高产率地制得醇。
在对邻硝基苯乙醇进行氧化(2f→3f)时,用一些常用的氧化剂进行了试验,如(COCl)2/DMSO[20], PCC[21], NaNO2-Ac2O[22], MnO2/Ionic Liquids[23], IBX/DMSO[24]等,均未取得较好效果(表1)。最后以DMP为氧化剂,室温下就可完成反应,且反应时间较短、后处理简单、收率较高。
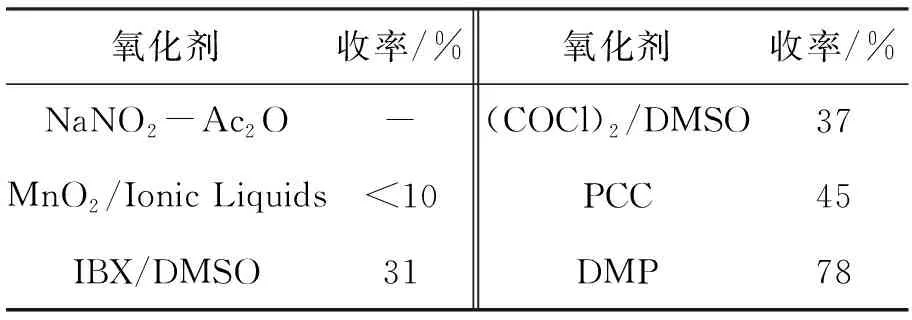
表 1 合成3f的氧化剂筛选Table 1 Oxidant screening of synthesizing 3f
虽然合成4的方法有诸多介绍,但本文采用的方法是最为简便的,而且原料价廉易得、操作简单、收率较高。反应过程需用氮气保护,氨水用量过量(>4 eq)可以有效地提高收率。
[1] Hantzsch A. Condensationsprodukte aus aldehydammoniak und ketonartigen verbindungen[J].Ber Dtsch Chem Ges,1881,14(2):1637-1638.
[2] Godfraind T, Miller R, Wibo M. Calcium antagonism and calcium entry blockade[J].Pharmacol Rev,1986,38(4):321-416.
[3] Nogae I, Kohno K, Kikuchi J,etal. Analysis of structural features of dihydropyridine analogs needed to reverse multidrug resistance and to inhibit photoaffinity labeling of P-glycoprotein[J].Biochem Pharmacol,1989,38(3):519-527.
[4] Gaudio A C, Korolkovas A, Takahata Y. Quantitative structure-activity relationships for 1,4-dihydropyridine calcium channel antagonists(nifedipine analogues):A quantum chemical/classical approach[J].J Pharm Sci,1994,83(8):1110-1115.
[5] Flaim S F, Zelis R. Clinical use of calcium entry blockers[J].Fed Proc,1981,40(14):2877-2881.
[6] 庞登甲,张树林,刁锡华. 芳醇氧化制取芳醛的研究[J].河北轻化工学院学报,1991,12(1):55-60.
[7] Hajipour A R, Rafiee F, Ruoho A E. Oxidation of benzylic alcohols to their corresponding carbonyl compounds using KIO4in ionic liquid by microwave irradiation[J].Synth Commun,2006,36(17):2563-2568.
[8] Feizi N, Hassani H, Hakimi M. Heterogeneous method for the oxidation of alcohols under mild conditions with zinc dichromate adsorbed on alumina[J].Bull Korean Chem Soc,2005,26(12):2084-2086.
[9] Feringa B L. Catalytic oxidation of alk-1-enes to aldehydes[J].J Chem Soc,Chem Commun,1986:909-910.
[10] Suga H, Miyake H. Synthesis of aldehydes by rearrangement of cyclic epoxides with lithium bromide on alumina[J].Synthesis,1988:394-395.
[11] 徐成华,骆豫蜀,吕绍洁,等. 后处理温度对TS-ZSM-5载钛量和催化苯乙烯氧化反应的影响[J].合成化学,2001,9(5):424-428.
[12] Sato F, Oguro K, Watanabe H,etal. Reinvestigation of the Grignard reactions with formic acid.A convenient method for preparation of aldehydes[J].Tetrahedron Lett,1980,21(30):2869-2872.
[13] Olah G A, Ohannesian L. A new and effective formylating agent for the preparation of aldehydes and dialkyl(1-formylalky1) phosphonates from Grignard or organolithiumreagents[J].J Org Chem,1984,49(20):3856-3857.
[14] 王陆瑶,郭媛,高勇,等. 苯乙醛的新合成方法[J].西北大学学报(自然科学版),2005,35(5):562-564.
[15] 校大伟,成春雷,张金,等. 苯乙醛合成研究进展[J].化学试剂,2008,30(12):899-902.
[16] Tapasi C, Subhagata C. A simple,convenient and expeditious route to methyl esters of carboxylic acids by thionyl chloride-methanol[J].Orient J Chem,2002,18(2):187-190.
[17] Brown M S, Rapoport H. The reduction of esters with sodium borohydride[J].J Org Chem,1963,28(11):3261-3263.
[18] Dess D B, Martin J C. Readily accessible 12-I-5 oxidant for the conversion of primary and secondary alcohols to aldehydes and ketones[J].J Org Chem,1983,48(22):4155-4156.
[19] Shahane S, Louafi F, Moreau J,etal. Synthesis of alkaloids of galipea officinalis by alkylation of anα-amino nitrile[J].Eur J Org Chem,2008:4622-4631.
[20] Marshall J A, Andersen M W. Synthesis of 12-,14-,and 16-membered propargylic alcohols through Lewis acid-promoted ene cyclization[J].J Org Chem,1993,58(15):3912-3918.
[21] Adams L L, Luzzio F A. Ultrasound in oxochromium (Ⅵ)-amine-mediated oxidations-modifications of the Corey-Suggs oxidation for the facile conversion of alcohols to carbonyl compounds[J].J Org Chem,1989,54(22):5387-5390.
[22] Babasaheb P B, Vaibhav S S, Lavkumar S U. Selective and rapid oxidation of primary,allylic and benzylic alcohols to the corresponding carbonyl compounds with NaNO2-acetic anhydride under mild and solvent-free conditions[J].J Chem Soc,Perkin Trans 1,2000:3559-3560.
[23] Bao W L, Wang Q, Zheng Y F. A facile and efficient oxidation ofα,β-unsaturated alcohols with manganese dioxide in ionic liquids under mild conditions[J].Chinese Chem Lett,2004,15(9):1029-1032.
[24] Frigerio M, Santagostino M. A mild oxidizing reagent for alcohols and 1,2-diols:o-iodoxybenzoic acid(IBX) in DMSO[J].Tetrahedron Lett,1994,35(43):8019-8022.
