Al2O3掺杂的80TiO2·20SiO2介孔光催化剂的合成与表征
2012-11-21王建玲吕全建王国庆
王建玲, 吕全建, 王国庆
(1. 郑州牧业工程高等专科学校 质量检测与管理系,河南 郑州 450008; 2. 郑州轻工业学院 应用化学系,河南 郑州 450002)
H2S气体是造成空气污染的罪魁祸首之一、也是形成酸雨的主要因素之一。传统处理方法[1]是将H2S气体转化为水与单质硫,减少了其对大气的污染,但由于这一方法需要大量投入资金而不经济。此外,被广泛研究用于去除H2S的方法有碱吸收、铁络合法、以过渡金属硫化物和氧化物作催化剂使H2S分解的热化学法、光催化法、以及生化法等[1~4]。在诸多研究中,一个被认为相当经济、且最有希望的方法是H2S的光催化分解。该方法最终目标是利用取之不尽用之不竭的可见光(或太阳光)通过光催化剂将H2S转变为清洁的燃料——氢气和单质硫。
Fujishima[5]发现TiO2电极在光诱导下可分解水制得氢气,此后半导体基光催化剂因其高活性、低成本、易处理等优点一直倍受广泛关注与研究。迄今,人们已作出极大努力用各种半导体光催化剂分解H2S,如负载Pt和RuO2的VxSy, VxSy悬浮体、掺杂VxSy的金属半导体氧化物。众所周知的CdS, CdSe, ZnS, CuS, ZnO, TiO2和SrTiO3也表现出良好的光催化活性[6]。
光催化剂的活性主要取决于其固有的电子性质,但其物理化学特性也起着重要作用,如比表面积大小、对污染物和氧的吸附速率、表面羟基浓度或密度、光生电子-空穴对再结合速率、晶形、结晶度、掺杂情况等[7,8]。比表面积大将赋予材料更加优异、独特的性能,介孔材料的合成是大幅提高比表面积的一种很重要方法。掺杂可显著提高光催化效率[9,10]。目前,文献报道用于光催化反应的半导体介孔金属氧化物有TiO2, Nb2O5[11], Ta2O5[12], Ta2O5-MgO[13]等,它们分别用于异丙醇脱氢制丙酮和水分解制H2与O2等。
本文以Ti(OCHMe2)4(2), Si(OEt)4(3), 无水AlCl3为无机物前驱体,无水乙醇为溶剂,非离子型三嵌段聚氧烯烃共聚物表面活性剂P123为模板剂, 采用溶胶-凝胶法[14]合成Al2O3掺杂的80TiO2·20SiO2有序介孔材料{1-r,r=n(Al2O3)/[n(Al2O3)+n(80TiO2·20SiO2)]×100%},其结构经UV, XRD表征。
1 实验部分
1.1 仪器与试剂
SHIMADZU UV-2450型紫外与可见光漫反射光谱;Bruker D8 Discover型X-射线衍射仪(XRD); Shimadzu GC-14B型气相色谱仪(GC); ASAP 2010型孔径分布自动测试仪。
2, Fluka;无水AlCl3, P123(EO20PO70EO20, Mw=5800), Sigma-Aldrich;3,无水乙醇和浓盐酸,上海化工公司;H2S气体,99.999%。
1.2 1的合成[15]
在反应瓶中依次加入1 mol·L-1盐酸0.6 mL, P123 0.8 g~1.2 g的无水乙醇(8.0 mL~10.0 mL)溶液,21.50 g~2.50 g,搅拌10 min;加入30.25 g~0.50 g和无水AlCl30.10 g~0.25 g,密闭反应10 h。转移到表面皿或培养皿内,敞口置于室内,于空气中室温放置4 d~5 d得无色透明或白色凝胶,置烘箱内于80 ℃干燥5 d得1′-r。
不加无水AlCl3,用类似方法合成80TiO2·20SiO2(1′-0)。
1′-r和1′-0置程序控温马福炉内,空气气氛,升温速率1 ℃·min-1。 于400 ℃焙烧5 h(除去模板剂);再于550 ℃焙烧3 h制得1-r和1-0。
1′-r和1-r的组成与编号见表1

表 1 样品的组成与编号Table 1 Composition and number of sample

1.3 1的光催化活性评价
以H2S气体为目标污染物,在紫外光照射下,考察1催化分解H2S的能力,以H2产量评价1的光催化活性。
在特制柱状石英光化学反应器(内有恒温冷却水石英套管,温度(25±1) ℃, 450 W高压汞灯作光源,使用波长为325 nm以上的光)中加入蒸馏水500 mL和11.00 g,剧烈搅拌下制成悬浮液;通氩气净化悬浮液1 h;通H2S气体,流速10 mL·min-1。多余的H2S气体用浓NaOH溶液吸收,产生的H2经过硅胶、沸石分子筛柱干燥后通入GC定量检测。
2 结果与讨论
2.1 1的XRD分析
1′和1的小角XRD谱图分别见图1和图2。由图1可见,1′-0有3个清晰可辨的峰,0.70°附近的一个强峰,1.0°~1.5°的两个弱峰;其峰面积为1 ∶3 ∶2的d值比,分别归属为(100), (110)和(200)衍射面,属于典型的两维六方结构,这表明1′-0的介观结构高度有序。掺入少量铝前驱体的1′-5虽然在1.0°~1.5°的两个弱峰产生迭加,但0.70°附近的峰依然很强,说明1′-5的介观结构仍有很好的有序度。随着铝前驱体含量的增加,1′-10和1′-15的介观结构有序度虽逐渐降低,但仍保持良好状态。
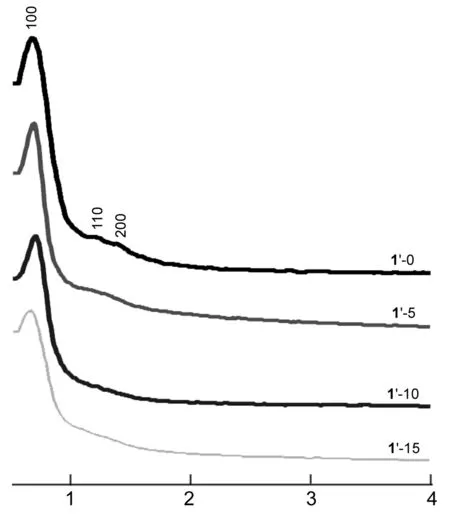
2θ/(°)图 1 1′的小角XRD谱图Figure 1 Small-angle XRD spectra of 1′
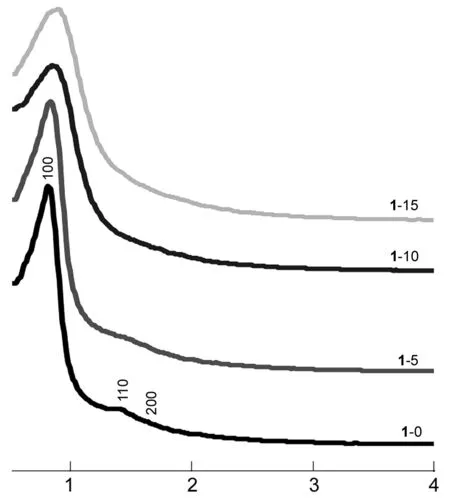
2θ/(°)图 2 1的小角XRD谱图Figure 2 Small-angle XRD spectra of 1
从图2可以看出,于550 ℃晶化3 h后,1-r的各衍射峰的位置明显向高角度位移,说明介孔结构有收缩现象。1-0除了(200)衍射峰稍变弱外,其它两个衍射峰强度明显增强,表明晶化过程中1-0的介孔骨架结构未遭受破坏、仍保持高度有序。1-5的(110)和(200)衍射峰仍相互叠加,但(110)衍射峰依然很强,说明在晶化过程中1-5的介孔骨架结构仍保持很好的有序度。随着骨架内Al2O3含量增加,1-10和1-15的介孔结构仍保持良好的有序度。
1的宽角XRD谱图见图3。1-0有锐钛矿相的特征衍射峰,表明有锐钛矿晶体产生且为纳米晶粒。当掺杂Al2O3后,1-5,1-10和1-15的锐钛矿相特征衍射峰的强度略有减弱,但峰位置未发生明显变化,也没有新的峰出现。这表明Al原子没有进入锐钛矿晶格内,Al2O3在骨架内为无定形状态。这与文献[10]报道的结果基本一致。随着Al2O3含量增加,锐钛矿特征衍射峰(如101)的强度逐渐减弱,这是由于骨架内无定形相比例增加、锐钛矿相比例减少造成的。
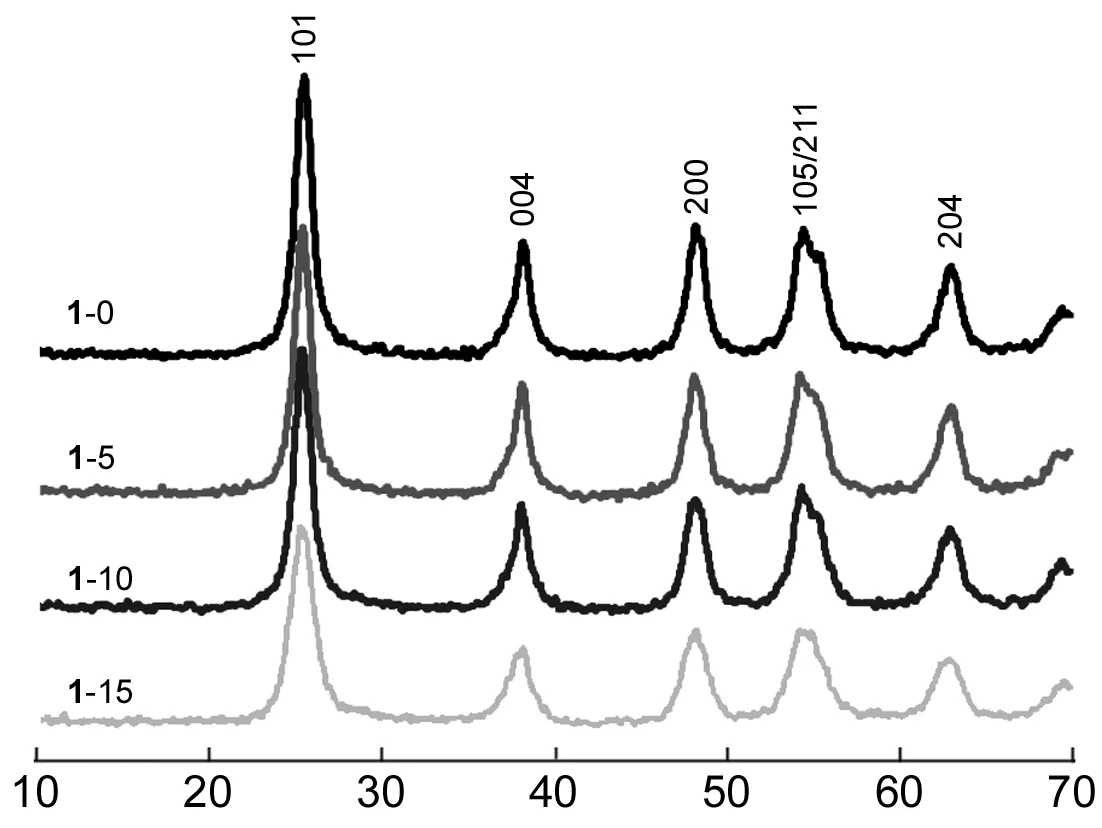
2θ/(°)图 3 1的宽角XRD谱图Figure 3 Wide-angle XRD spectra of 1

λ/nm图 4 1的UV谱图Figure 4 UV spectra of 1
2.2 1的UV分析
1的UV谱图见图4。从图4可以看出,1-0对光的吸收发生在紫外区,根据吸收边界计算的带隙能为3.22 eV。当掺杂Al2O3后,1-5,1-10和1-15的吸收边界移向长波方向,但移幅不大,其主要吸收仍在紫外区。计算的带隙能在2.95 eV~ 2.97 eV,低于其基体1-0的带隙能。随着Al2O3含量增加,带隙能略有降低。
2.3 1的光催化性能
以H2S气体为分解对象,在紫外光照射下,以H2产量评价1的光催化活性,实验结果见表2。由表2可见,与1-0相比,1-5,1-10和1-15的光催化活性均有显著提高,其最高H2产出量(574 mL·h-1)是1-0(186 mL·h-1)的3倍以上。随着掺入Al2O3量的增加,H2产出量先是增加,然后降低。这表明掺杂的Al2O3不是愈多愈好,而是有一个最佳量。比表面积与XRD结果表明,随着Al2O3的掺入,比表面积与锐钛矿TiO2的结晶度均降低,但光催化分解H2S的活性却显著提高,这表明该情况下比表面积与结晶度的变化对活性的贡献均可忽略。带隙能变化规律与活性变化趋势也没有完全相关性。文献[9]报道,Al2O3掺入TiO2后,无定形Al2O3覆盖在TiO2纳米晶粒表面,在光催化过程中,表层的Al2O3能够阻止光生电子与空穴再结合,因而大大提高了光催化效率。这可以很好地解释我们的部分结果,即Al2O3掺杂的样品的活性均显著高于未掺杂的样品的活性。但随着Al2O3含量的增加,活性先增加,1-10的活性达到最高;1-15的活性明显降低。这很可能是由于TiO2导带上的部分光生电子无法穿越较厚层的Al2O3而还原H2S所致。目前,更详细深入的研究正在进行中。

表 2 1的物化参数及其光催化活性*Table 2 Physical and chemical dataof 1 and their photocatalytic activity
*1的晶相均为锐钛矿;1的光催化活性用H2产量评价
3 结论
本文成功合成了Al2O3掺杂的80TiO2·20SiO2有序介孔光催化剂。550 ℃晶化3 h后,介孔骨架虽有收缩,但仍保持良好的有序度。在晶化过程中,骨架内的Al2O3没有晶化,仍为无定形,Al原子也未进入锐钛矿晶格内。Al2O3掺杂的80TiO2·20SiO2介孔光催化剂对光的吸收均主要在紫外区,其带隙能在2.95 eV~ 2.97 eV,且低于其基体80TiO2·20SiO2的带隙能(3.22 eV)。在紫外光照射下,Al2O3掺杂的80TiO2·20SiO2介孔光催化剂分解H2S气体的活性均得到了显著提高,且最高活性是基体80TiO2·20SiO2的3倍以上。
目前,将Al2O3掺杂的80TiO2·20SiO2用于光催化分解H2S在国内外还未见文献报道。本研究在减少和控制H2S气体排放、节能等方面将具有重要意义。
[1] Tambwekar S V, Subrahmanyam M. Photocatalytic generation of hydrogen from hydrogen sulfide:An energy bargain[J].Int J Hydrogen Energy,1997,22(10/11):959-965.
[2] Reshetenko T V, Khairulin S R, Ismagilov Z R,etal. Study of the reaction of high-temperature H2S decomposition on metal oxides(gamma-Al2O3,alpha-Fe2O3,V2O5)[J].Int J Hydrogen Energy,2002,27(4):387-394.
[3] Naman S A. Comparison between thermal-decomposition and photosplitting of H2S over VxSysupported on oxides at 450-degrees-C-550-degrees-C in a static system[J].Int J Hydrogen Energy,1992,17(7):499-504.
[4] Naman S A. Photoproduction of hydrogen from hydrogen sulfide in vanadium sulfide colloidal suspension——Effect of temperature and pH[J].Int J Hydrogen Energy,1997,22(8):783-789.
[5] Fujishima A, Honda K. Electrochemical photolysis of water at a semiconductor electrode[J].Nature,1972,238(5358):37-38.
[6] De G C, Roy A M, Bhattacharya S S. Photocatalytic production of hydrogen and concomitant cleavage of industrial-waste hydrogen-sulfide[J].Int J Hydrogen Energy, 1995,20(2):127-131.
[7] Lettmann C, Hinrichs H, Maier W F. Combinatorial discovery of new photocatalysts for water purification with visible light[J].Angew Chem,Int Ed,2001,40(17):3160-3161.
[8] Kawahara T, Konishi Y, Tada H,etal. A patterned TiO2(anatase)/TiO2(rutile) bilayer-type photocatalyst:Effect of the anatase/rutile junction on the photocatalytic activity[J].Angew Chem,Int Ed,2002,41(15):2811-2812.
[9] Zhao D, Chen C C, Wang Y F,etal. Enhanced photocatalytic degradation of dye pollutants under visible irradiation on Al(Ⅲ)-modified TiO2:Sstructure,interaction,and interfacial electron transfer[J].Environ Sci Technol,2008,42(1):308-314.
[10] Wang J Y, Liu Z H, Cai R X. A new role for Fe3+in TiO2hydrosol:Accelerated photodegradation of dyes under visible light[J].Environ. Sci. Technol,2008,42(15):5759-5764.
[11] Stone V F Jr, Davis R J. Synthesis,characterization,and photocatalytic activity of titania and niobia mesoporous molecular sieves[J].Chem Mater,1998,10:1468-1474.
[12] Takahara Y, Kondo J N, Takata T,etal. Mesoporous tantalum oxide.1.Characterization and photocatalytic activity for the overall water decomposition[J].Chem Mater,2001,13(4):1194-1199.
[13] Uchida M, Kondo J N, Lu D,etal. Preparation and photocatalysis of ordered mesoporous Mg-Ta mixed oxide[J].Chem Lett,2002,5:498-499.
[14] Li D, Zhou H, Honma I. Design and synthesis of self-ordered mesoporous nanocomposite through controlled in-situ crystallization[J].Nature Materials,2004,3(1):65-72.
