二乙酰氧基碘苯催化合成α-烷氧基羰基化合物
2012-11-21田宗勇阮晓娇缪春宝孙小强杨海涛
田宗勇, 阮晓娇, 缪春宝, 孙小强, 杨海涛
(常州大学 精细化工重点实验室,江苏 常州 213164)
α-烷氧基酮是一类重要的有机合成中间体[1],其合成方法主要有:(1)α-重氮酮和醇在各类催化剂催化下通过O-H插入反应制备[2~4]; (2)格氏试剂或Wittig试剂与腈类化合物反应制备[5]; (3)在路易斯酸条件下烯醇硅醚或烯醇醚与亚碘酰苯或四价醋酸铅在醇中反应制备[6]; (4)α-羟基酮的亲核取代反应制备[7,8]; (5)甲氧基甲磺酰苯与酮在强碱条件下通过“加成-重排”历程,实现羰基与α-碳之间C-C键插入甲氧基次甲基从而得到增长一个碳的α-甲氧基酮[9]。除此之外还可以通过在F2/MeOH体系中产生的甲氧基正离子与烯醇酯或烯醇醚的亲电反应制备α-甲氧基酮[10]。然而,上述方法的不足之处有:有些原料不易得到,有些原料需要从酮制备,有些需要用到有毒的重金属试剂,或者操作条件非常苛刻。
Scheme1
Scheme2
我们希望通过一种简便的方法,用羰基化合物与醇在氧化剂作用下直接实现羰基α-的烷氧基取代。但在这种条件下通常会发生氧化重排反应得到重排产物。Justik课题组[11]曾研究了HMBI(1H-1-羟基-5-甲基-1,2,3-苯并碘杂噁噻唑-3,3-二氧化物)作用下不同芳香酮与原甲酸三甲酯在硫酸条件下的反应,得到的链状酮基本都是重排产物[12]。
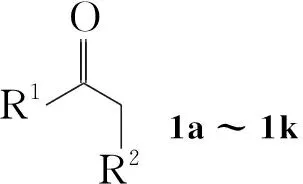
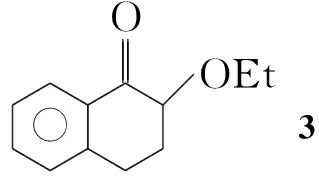
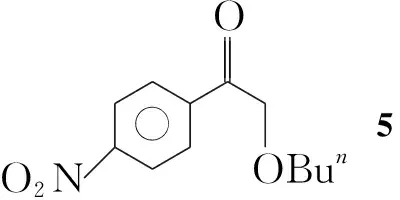
本文在多聚磷酸(PPA)和二乙酰氧基碘苯(IBD)的存在下,羰基化合物(1a~1k)和乙醇发生羰基-α-位的烷氧基取代反应,合成了15个α-乙氧基羰基化合物(2a~2k, Scheme 1),其结构经1H NMR,13C NMR, IR和LC-MS表征。对反应条件进行了优化。在最佳反应条件(1 1.0 mmol,乙醇10 mL, IBD 1.1 mmol, PPA 3.0 mmol,于室温反应至终点)下,扩大了反应底物,合成了不同类型的α-烷氧基羰基化合物(3~6, Scheme 2)。并提出了可能的反应机理。
2i,2j,2k,3和5为新化合物。
1 实验部分
1.1 仪器与试剂
XT4-100X型显微熔点仪(温度未校正);AVANCEⅢ 500 MHz型核磁共振仪(CDCl3为溶剂,TMS为内标);Nicolet FT-IR型红外光谱仪(KBr压片);GCMS-QP2010型气相色谱质谱仪;LCMS-2010EV型液相色谱质谱仪。
所用试剂均为分析纯。
1.2 α-烷氧基羰基化合物的合成(以2a[13]为例)
在单口烧瓶中依次加入PPA 1.01 g(3 mmol),无水醇10 mL,苯乙酮(1a)120 mg(1 mmol)及IBD 355 mg(1.1 mmol),搅拌下于室温反应12 h(TLC跟踪)。倒入20 mL冰水中,用30%Na2CO3溶液调至pH 7~8,用二氯甲烷(3×15 mL)萃取,合并有机层,用无水硫酸镁干燥,浓缩后经硅胶柱层析[洗脱剂:V(石油醚) ∶V(乙酸乙酯)=20 ∶1]纯化得2-乙氧基苯乙酮(2a)。用类似的方法合成2b~2k和3~6。
2i:1H NMRδ: 8.19(d,J=8.75 Hz, 2H,ArH), 7.93(d,J=8.2 Hz, 2H, ArH), 7.67(d,J=8.6 Hz, 2H, ArH), 7.21(d,J=8.1 Hz, 2H, ArH), 5.56(s, 1H, OCH), 3.60~3.71(m, 2H, OCH2), 2.38(s, 3H, CH3), 1.30(t,J=7.0 Hz, 3H, CH3);13C NMRδ: 196.6, 147.7 144.8, 144.3, 131.9, 129.5, 129.4, 127.7, 123.8, 85.0, 66.2, 21.7, 15.3; IRν: 2 978, 2 874, 1 690, 1 606, 1 522, 1 347, 1 182, 1 107, 846, 733, 709 cm-1; EI-MSm/z: 299。
2j:1H NMRδ: 8.20(d,J=8.6 Hz, 2H, ArH), 8.02(d,J=7.7 Hz, 2H, ArH), 7.68(d,J=8.7 Hz, 2H, ArH), 7.42(t,J=7.3 Hz, 1H, ArH), 7.42(t,J=7.7 Hz, 2H, ArH), 5.58(s, 1H, OCH), 3.61~3.72(m, 2H, OCH2), 1.30(t,J=7.0 Hz, 3H, CH3);13C NMRδ: 197.1, 147.9, 144.2, 134.6, 133.8, 129.4, 128.7, 127.8, 123.9, 85.1, 66.3, 15.3; IRν: 3 108, 2 978, 2 874, 1 694, 1 597, 1 522, 1 347, 1 107, 839, 692 cm-1; EI-MSm/z: 144。
2k:1H NMRδ: 8.23~8.31(m, 4H, ArH), 8.19(d,J=8.9 Hz, 2H, ArH), 7.67(d,J=8.6 Hz, 2H, ArH), 5.51(s, 1H, OCH), 3.66~3.72(m, 2H, OCH2), 1.31(t,J=7.0 Hz, 3H, CH3);13C NMRδ: 196.1, 150.5, 148.1, 143.1, 138.9, 130.6, 127.5, 124.1, 123.8, 85.8, 66.8, 15.3; IRν: 3 111, 2 979, 2 873, 1 701, 1 603, 1 525, 1 348, 1 108, 859, 717 cm-1; EI-MSm/z: 330。
3:1H NMRδ: 8.01(d,J=8.4 Hz, 1H, ArH), 7.47(t,J=8.0 Hz, 1H, ArH), 7.30(t,J=7.7 Hz, 1H, ArH), 7.23(t,J=7.6 Hz, 1H, ArH), 4.04(dd,J=10.8 Hz, 4.3 Hz, 1H, OCH), 3.88(dq,J=9.1 Hz, 7.0 Hz, 1H, OCH2), 3.65(dq,J=9.1 Hz, 7.0 Hz, 1H, OCH2), 3.14(dt,J=17.0 Hz, 4.9 Hz, 1H, CH2), 3.02(ddd,J=17.0 Hz, 10.0 Hz, 4.7 Hz, 1H, CH2), 2.33~2.39(m, 1H, CH2), 2.17~2.25(m, 1H, CH2), 1.27(t,J=7.0 Hz, 3H, CH3);13C NMRδ: 196.9, 143.4, 133.4, 131.9, 128.5, 127.5, 126.6, 80.0, 65.9, 30.0, 27.3, 15.4; IRν: 2 975, 2 931, 1 694, 1 602, 1 456, 1 297, 1 270, 1 224, 1 160, 1 101, 1 051, 936, 748 cm-1; EI-MSm/z: 190。
5:1H NMRδ: 8.32(d,J=8.9 Hz, 2H, ArH), 8.14(d,J=8.9 Hz, 2H, ArH), 4.70(s, 2H, ArH), 3.57(t,J=6.6 Hz, 2H, OCH2), 1.60~1.66(m, 2H, CH2), 1.39(sextet,J=7.4 Hz, 2H, CH2), 0.91(t,J=7.4 Hz, 3H, CH3);13C NMRδ: 195.9, 150.5, 139.6, 129.4, 123.9, 74.5, 72.0, 31.7, 19.3, 13.9; IRν: 3 061, 2 977, 2 895, 1 681, 1 598, 1 450, 1 230, 1 102, 975, 754, 697 cm-1; EI-MSm/z: 237。
化合物的实验结果见表1,2a~2h,4和6的表征数据[16]与Scheme 1预期吻合。
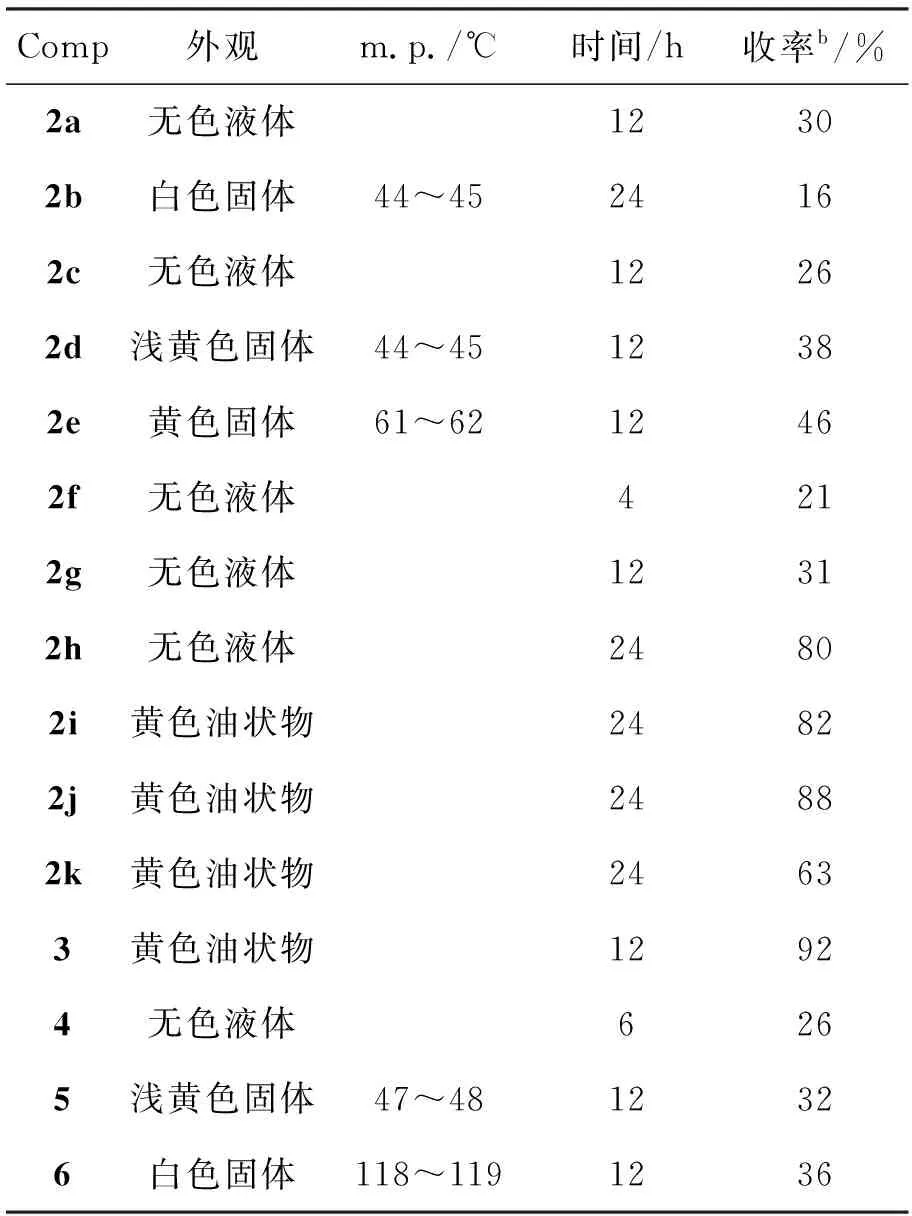
表1 化合物的实验结果aTable 1 Experimental results of compounds
areaction condition:11.0 mmol, IBD 1.1 mmol, PPA 3.0 mmol(5 mmol), EtOH 10 mL, rt;bisolated yield
2 结果与讨论
2.1 酸性介质的筛选
以1a为底物,考察了酸性介质对反应的影响,结果见表2。由表2可以见,该反应存在取代和重排这一对相互竞争的反应。相同反应条件下,不加酸没有产物生成。使用硫酸时,取代产物2a与重排产物3a在GC-MS上的积分面积比是33/67。用PPA为酸介质时,2a收率最高达45%, GC-MS的积分面积比为45/55。由此可见PPA对该烷氧基取代反应的选择性相对较好。文献[14,15]方法用硫酸作酸性介质芳香酮分别在原甲酸三甲酯和甲醇两种体系中与高价碘试剂作用的反应。结果在原甲酸三乙酯/乙醇中反应得到完全得到重排产物[15];而在甲醇中反应虽然也有烷氧基取代产物,但所占比例很小,以苯乙酮为例得到的烷氧基取代产物和重排产物的比例是22/78[14]。本文用PPA作酸性介质时虽然无法避免3a的生成,但2a所占比例可达到45%。与文献[11,14]方法用高价碘试剂做氧化剂仍是一个不小的改进。其它酸如HBF4, CF3CO2H, KAl(SO4)2, NaH2PO4可能由于酸性偏低,反应24 h只有少量原料转化成产物;固体超强酸中反应不能发生。因此,最佳的酸性介质为PPA。
+
areaction condition:1a1.0 mmol, IBD 1.1 mmol, PPA 3.0 mmol, EtOH 10 mL, rt;bGC-MS yield;cdetermined by GC-MS(1H NMR)
2.2 扩展实验
以PPA为酸性介质,扩展羰基化合物与醇的烷氧基取代反应(表1)。从表1可以看出,对于芳基乙酮(1a~1e),当苯环上有给电子基时,烷氧基取代产物收率降低,这是因为苯环连有给电子基后电子密度会增大,更容易发生迁移,所以重排产物所占比例会更大。1f在同样条件下也能够得到直接取代产物。1g和1a的反应结果相差不大。当R1和R2同为芳基时(1h~1k),有利于烷氧基取代产物的生成,但是原料很难完全转化。实验发现,提高PPA的量有利于反应的进行;当PPA的量从3倍提高至5倍后,原料完全转化,可得到80%以上的收率。R1和R2同为芳基时重排产物很少,可能是因为R2基团变为芳基后体积较大,由于位阻的原因不利于R1的迁移。
为了扩大反应的应用范围,我们还尝试了一些其它类型的羰基化合物。利用1-四氢萘酮在相同的条件下进行反应(Scheme 2),得到了92%的乙氧基取代产物3。可能是由于1-四氢萘酮具有六元环的结构稳定性抑制了迁移,从而得到单一的取代产物。
同时该反应适用于β-二羰基化合物的烷氧基取代。利用丙二酸二乙酯在相同的反应条件下在羰基的α-位引入了乙氧基,得到乙氧基丙二酸二乙酯(4, Scheme 1),产率26%。
我们尝试了不同的醇(MeOH,n-BuOH,i-PrOH,t-BuOH)与1e的反应(Scheme 2)。实验结果表明,当醇为一级醇(甲醇,乙醇,正丁醇)都能得到中等收率的羰基α-烷氧基取代产物;当采用较大空间位阻的二级或者三级醇(异丙醇和叔丁醇)时,室温反应48 h,原料基本未反应。
2.3 可能的反应机理
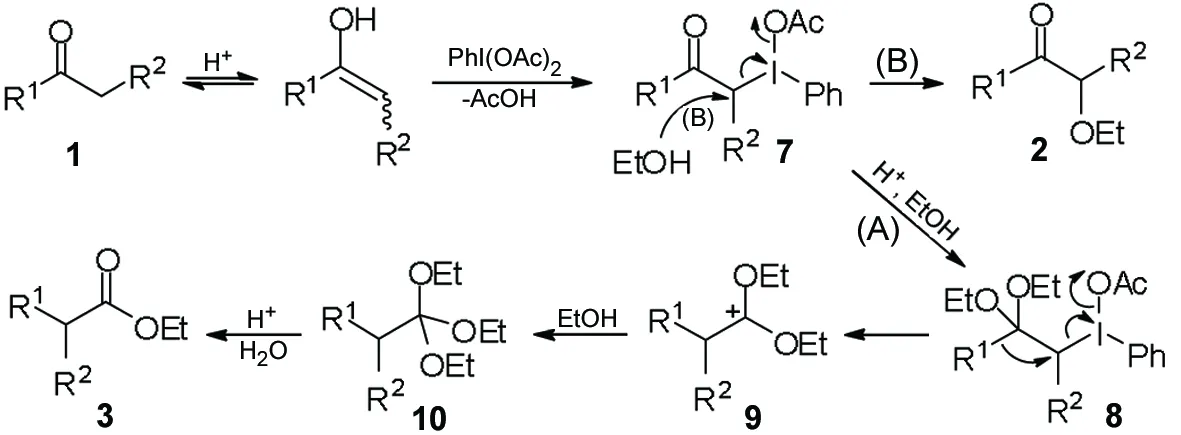
根据实验结果,我们推测该反应的机理为:1在酸性条件下先发生烯醇互变后与DIB作用生成中间体7; 7经过A和B两种历程分别得到重排产物3和取代产物2。 A历程:在酸性条件下生成缩酮中间体8,然后R1基团发生迁移重排同时脱去一分子醋酸和碘苯,得到中间体9; 9再与乙醇作用得到10;10在酸性条件下水解得到重排产物3。B历程:乙醇作为亲核试剂直接对中间体7进攻,发生亲核取代反应,同时脱去一分子醋酸和一分子碘苯,得到最终产物2(Scheme 3)。
3 结论
报道了一种在PhI(OAc)2/PPA催化体系下,由羰基化合物与一级醇一步反应直接得到一系列α-烷氧基酮类化合物的新方法。对反应所需酸性介质进行了考察,发现以PPA为酸性介质对烷氧基取代反应具有相对较高的选择性。尽管α-烷氧基酮的整体收率不高,但是对1,4-四氢萘酮和安息香醚类化合物可以得到较满意的收率,这也为合成多种取代基的安息香醚类化合物提供了一种新方法。
Scheme 3
本文对该反应提出了可能的反应机理。该新方法扩大了二乙酰氧基碘苯在有机合成中的应用范围。
[1] Miller D J, Moody C J. Synthetic applications of the O-H insertion reactions of carbenes and carbenoids derived from diazocarbonyl and related diazo compounds[J].Tetrahedron,1995,51(40):10811-10843.
[2] Sosa J R, Tudjarian A A, Minehan T G. Synthesis of alkynyl ethers and low-temperature sigmatropic rearrangement of allyl and benzyl alkynyl ethers[J].Org Lett,2008,10(21):5091-5094.
[3] Yadav J S, Reddy B V S, Vishnumurthy P. LiBF4:A mild and novel reagent for the OH insertion reactions ofα-diazoketones[J].Tetrahedron Lett,2003,44:5691-5694.
[4] 黄丹,鄢明,沈琪. 重氮化合物与醇的插入反应合成α-烷氧基-β-二羰基化合物[J].有机化学,2007,27(6):739-743.
[5] Dedenis B C, Provot O, Moskowitz H. Reaction of phosphonium ylides and aromatic nitriles under lewis acid conditions:An easy access to aryl-substituteα-methoxyacetophenones[J].Synthesis,1999,9:1558-1560.
[6] Moriarty R M, Prakash O, Duncan M P,etal. Hypervalent iodine oxidation of silyl enol ethers under lewis acid conditions in methanol.A general route toα-methoxy ketones[J].J Org Chem,1987,52:150-153.
[7] Li F, Tartakoff S S, Castle S L. Enantioselective total synthesis of (-)-acutumine[J].J Org Chem,2009,74:9082-9093.
[8] Wang S F, Jin J Y, Zeng Z H,etal. Optical 2-benzyl-5-hydroxy-4-oxopentanoic acids against carboxypeptidase A:Synthesis,kinetic evaluation and X-ray crystallographic study[J].Chinese Chem Lett,2010,21:159-162.
[9] Phillipson N, Anson M S, Montana J G,etal. Ketone homologation to produceα-methoxyketones:Application to conduritol synthesis[J].J Chem Soc Perkin Trans 1,1997,19:2821-2829.
[10] Rozen S, Mishani E, Kol M. A novel electrophilic methoxylation(with a little help from F2)[J].J Am Chem Soc,1992,114:7643-7645.
[11] Justik M W. Oxidative rearrangements of arylalkanones with 1H-1-hydroxy-5-methyl-1,2,3-benziodoxathiole 3,3-dioxide, a ‘green’ analog of Koser’s reagent[J].Tetrahedron Lett,2007,48:3003-3007.
[12] Yamauchi T, Hattori K, Nakao K,etal. A facile and efficient preparative method of methyl 2-arylpropanoates by treatment of propiophenones and their derivatives with iodine or iodine chlorides[J].J Org Chem,1988,53:4858-4859.
[13] Bogdan A R, Poe S L, Kubis D C,etal. The continuous-flow synthesis of lbuprofen[J].Angew Chem Int Ed,2009,48:8547-8550.
[14] Tamura Y, Yakura T, Shirouchi Y,etal. Oxidative 1,2-aryl migration of alkyl ketones by using diacetoxyphenyliodine:Syntheses of arylacetate,2-arylpropanoate,and 2-arylsuccinate[J].Chem Pharm Bull,1985,33(3):1097-1103.
[15] Tamura Y, Shirouchi Y, Haruta J. Synthsis of methyl 2-arylpropanoates by 1,2-aryl migration of aryl ethyl ketones using diacetoxyphenyliodine[J].Synthesis,1984:231-232.
[16]2a:1H NMRδ: 7.95(d,J=7.5 Hz, 2H), 7.58(t,J=7.4 Hz, 1H), 7.47(t,J=7.0 Hz, 2H), 4.75(s, 2H), 3.65(q,J=7.0 Hz, 2H), 1.29(t,J=7.0 Hz, 3H).2b:1H NMR δ: 7.95(d,J=8.9 Hz, 2H), 6.94(d,J=8.9 Hz, 2H), 4.69(s, 2H), 3.87(s, 3H), 3.64(q,J=7.0 Hz, 2H), 1.28(t,J=7.0 Hz, 3H);13C NMRδ: 195.2, 163.8, 130.4, 128.2, 113.9, 73.6, 67.3, 55.6, 15.2; IRν: 2 980, 2 918, 1 696, 1 600, 1 573, 1 514, 1 256, 1 236, 1 138, 975, 860, 810, 607, 579 cm-1; EI-MSm/z: 194.2c:1H NMRδ: 7.84(d,J=8 Hz, 2H), 7.26(d,J=8.0 Hz, 2H), 4.72(s, 2H), 3.64(q,J=7.0 Hz, 2H), 2.41(s, 3H), 1.28(t,J=7.0 Hz, 3H);13C NMRδ: 196.3, 144.4, 132.7, 129.4, 128.1, 73.6, 67.3, 21.8, 15.2; IRν: 2 976, 2 926, 1 697, 1 608, 1 411, 1 285, 1 232, 1 176, 1 125, 971, 812, 754 cm-1; EI-MSm/z: 178.2d:1H NMRδ: 7.90(d,J=8.5 Hz, 2H), 7.44(d,J=8.5 Hz, 2H), 4.69(s, 2H), 3.63(q,J=7.0 Hz, 2H), 1.28(t,J=7.0 Hz, 3H);13C NMRδ: 195.8, 140.1, 133.5, 129.7, 129.1, 73.8, 67.4, 15.2; IRν: 2 976, 2 920, 1 682, 1 592, 1 425, 1 322, 1 283, 1 092, 1 015, 853, 762 cm-1; EI-MSm/z: 198.2e:1H NMRδ: 8.32(d,J=8.8 Hz, 2H), 8.13(d,J=8.8 Hz, 2H), 4.73(s, 2H), 3.65(q,J=7.0 Hz, 2H), 1.28(t,J=7.0 Hz, 3H);13C NMRδ: 195.8, 150.6, 139.6, 129.4, 123.9, 74.2, 67.6, 15.1; IRν: 2 982, 2 915, 1 707, 1 521, 1 349, 1 219, 1 140, 978, 855, 747 cm-1; EI-MSm/z: 209.2f:1H NMRδ: 4.33(s, 2H), 3.54(q,J=7.1 Hz, 2H), 1.27(t,J=7.1 Hz, 3H), 1.17(s, 9H);13C NMRδ: 211.9, 71.5, 67.0, 42.9, 26.3, 15.1; IRν: 2 973, 2 934, 2 873, 1 721, 1 480, 1 367, 1 151, 1 059, 993, 852, 779 cm-1; EI-MSm/z: 144.2g: 1H NMRδ: 8.08(t,J=7.3 Hz, 2H), 7.60(t,J=7.4 Hz, 1H), 7.47(t,J=7.7 Hz, 2H), 4.68(q,J=6.9 Hz, 1H), 3.55(dq,J=8.9 Hz, 6.9 Hz, 1H), 3.49(dq,J=8.9 Hz, 7.0 Hz, 1H), 1.50(d,J=7.0 Hz, 3H), 1.22(t,J=7.0 Hz, 3H);13C NMRδ: 201.2, 135.0, 133.3, 128.9, 128.6, 79.2, 65.3, 18.9, 15.4; IRν: 2 964, 2 931, 1 695, 1 597, 1 449, 1 261, 1 116, 1 084, 1 026, 798, 702 cm-1; EI-MSm/z: 178.2h:1H NMRδ: 8.01(d,J=7.4 Hz, 2H), 7.46~7.50(m, 3H), 7.38(t,J=7.7 Hz, 2H), 7.34(t,J=7.5 Hz, 2H), 7.28(t,J=7.3 Hz, 1H), 5.58(s, 1H), 3.66~3.56(m, 2H), 1.28(t,J=7.0 Hz, 3H);13C NMRδ: 197.9, 133.3 130.3, 129.3, 128.9, 128.6, 128.5, 127.5, 85.5, 65.7, 15.4; IRν: 2 971, 2 927, 1 692, 1 597, 1 449, 1 290, 1 261, 1 109, 1 026, 800, 697 cm-1; EI-MSm/z: 240. 4:1H NMRδ: 4.49(s, 1H), 4.25~4.31(m, 4H), 3.67(q,J=7.0 Hz, 2H), 1.28~1.32(m, 9H);13C NMRδ: 166.8, 79.2, 67.0, 62.1, 15.1, 14.2; IRν: 2 983, 2 938, 1 745, 1 370, 1 279, 1 226, 1 178, 1 119, 1 030, 857 cm-1; EI-MSm/z: 218.6:1H NMRδ: 8.33(d,J=8.8 Hz, 2H),8.12(d,J=8.8 Hz, 2H), 4.71(s, 2H), 3.52(s, 3H)(表征数据与文献[6]一致).
