黑豆边缘细胞对干旱胁迫的响应和对根系生理特性的影响
2012-11-21邢承华吴韶辉罗小会
邢承华,吴韶辉,梅 忠,陈 雪,罗小会
(1金华职业技术学院农业与生物工程学院,浙江金华321007;2浙江省柑橘研究所,浙江台州318020)
干旱是制约农业发展的主要因素之一,我国干旱、半干旱地区面积约占全国耕地总面积的一半。植物对干旱的响应,主要通过根系进行。根系既是植物吸收水分和养分的主要器官,也是最早感受土壤干旱的器官。在干旱胁迫条件下,根系的生理代谢对于农作物抗旱性有重要意义[1]。
根边缘细胞(root border cells,RBCs),也称脱落的根冠细胞(sloughed root cap cells),是从根冠表皮分离并聚集在根尖周围的特殊细胞群。原位以及从根冠脱落后的RBCs,均会向周围分泌一系列化学物质,主要成分有多糖、小分子蛋白和其它高分子有机物,包裹在RBCs的外侧,这些胞外分泌物与RBCs一起覆盖在根分生组织和根冠表面,或是土壤颗粒表面,形成一层套膜结构,对形成根际土壤团聚体[2]、提高土壤水分和养分的有效性[3]、影响毒害离子的迁移和生物有效性等有重要作用[4]。以往对边缘细胞功能的研究,主要侧重于对铝毒害[5-8]、病原真菌[9]、病原细菌[10-11]和线虫[12]的防御作用。根系也可通过增加RBCs的脱落和根冠黏液分泌以减少与土壤的摩擦[4]。在干旱胁迫条件下,水稻根外皮层边缘厚壁细胞明显加厚,有效防止水分丧失,保护根组织免受干旱的伤害[13]。然而对于干旱胁迫下,RBCs的脱落和其黏液分泌的变化如何调节根际微生态环境,以及如何影响根系生理特性,均需要深入探讨。
黑豆属豆科作物,为一年生草本植物,其富含矿物质和粗蛋白,作为一种主要的农作物被广泛种植。黑豆根系产生的RBCs有着特殊的生理活性,对根际微环境的影响有着重要的生物学意义。本研究通过分析RBCs数量和黏液分泌对干旱胁迫的响应、根尖有RBCs附着和移除条件下的根相对伸长率以及根系生理特性的变化,探讨干旱胁迫下RBCs发育和黏液分泌对根际微生态的作用,为RBCs抗旱机理提供理论依据。
1 材料与方法
1.1 材料及其培养
黑豆[Glycine max(L.)Merrill]种子先用双蒸水浸泡4 h,后转移至铺有湿润滤纸的搪磁盘上,置于黑暗25℃、湿度90%的人工智能气候培养箱中,萌发12 h。挑选刚露白的种子分两种方式培养。第一组为静置培养,以保留根尖RBCs及黏液,即将露白种子播在底部垫有滤纸的培养皿中,定量喷洒不同浓度的聚乙二醇(PEG)处理液,再盖一张喷有同浓度PEG溶液的滤纸。干旱胁迫设3个水平:11%和22%PEG溶液,以蒸馏水(H2O)作对照。水势分别为 -0.4 MPa、- 1.3 MPa,PEG 以 PE-6000[14]形式供应。每隔2 h喷一次PEG处理液,1 d共喷12次。不同处理每次所喷的PEG处理液量均相同。第二组为振荡培养,目的是移除根尖的RBCs及其黏液[15]。露白种子放在内装100 mL 11%和22%PEG处理液的培养皿中,并盖上保鲜膜,薄膜上用针尖扎若干个小孔利于空气进出,培养条件同第一组,于水浴恒温振荡器中进行振荡培养,每隔4 h更换处理液。黑豆于静置培养后的24 h和36 h收集并统计RBCs数目,测定RBCs分泌的黏液厚度。静置培养和振荡培养24 h和36 h的黑豆幼苗测定根相对伸长率、脯氨酸含量、相对电导率和丙二醛(MDA)含量。
1.2 测定指标及方法
1.2.1 RBCs的数目 静置培养的大豆经过干旱胁迫处理24 h和36 h后,每处理均取3 mm长的根尖10个,放入装有1.0 mL蒸馏水的离心管中,用吸管轻轻吹打1~2 min,使RBCs在水中充分展开。吸取20 μL含RBCs的悬浮液,滴于干净的载玻片上,并盖上盖玻片,在显微镜下统计RBCs数目。5次重复,计算1.0 mL蒸馏水中所含RBCs的数目,并换算为一个根尖的RBCs总数。
1.2.2 RBCs黏液厚度 剪取10 mm长的根尖,在墨水∶0.2%果胶酶为1∶1(V/V)的染色液中轻轻搅动15~30 s,洗脱根尖RBCs,制成临时装片,用显微镜(Motic BA400 EF-UPR)镜检并拍照。用LEICA QWIN软件分别测量每个RBCs黏液层厚度差异较大的10处,每处理测量10个 RBCs,计算 10个RBCs黏液厚度的平均值。
1.2.3 根相对伸长率 先测定处理前黑豆的初根长,干旱胁迫处理24 h和36 h,再从每个处理组各取20个根测定根长,取平均值。根相对伸长率=干旱胁迫处理组根伸长量/对照组根伸长量×100%。
1.2.4 根相对电导率 分别剪取10个根的10 mm根尖,吸干表面水分,称重后放入三角瓶中,加去离子水,抽真空后静置6 h,用电导仪测定电导值(S1)。然后封口,置沸水浴中3 min,以杀死根组织,冷却至室温,测定电导值(S2),重复3次。相对电导率=S1/S2×100%。
1.2.5 脯氨酸和丙二醛(MDA)含量 脯氨酸含量采用磺基水杨酸提取,茚三酮比色法测定[16],重复3次,用ng/g,FW表示;丙二醛含量的测定采用林值芳等[17]的方法,重复3次,用 nmol/g,FW 表示。
数据采用SPSS软件进行统计分析,其中处理平均数间的差异显著性采用Duncan新复极差法进行检验(P<0.05)。
2 结果与分析
2.1 干旱胁迫下黑豆根尖根边缘细胞(RBCs)数目的变化
干旱胁迫抑制黑豆根尖RBCs的产生,且胁迫程度越高RBCs数目越少。图1看出,24 h时11%和22%PEG处理的RBCs数目分别比对照组降低了21.6%和30.4%,随着培养时间延长至36 h时,11%和22%PEG处理的RBCs数目分别比对照组降低了18.1%和28.8%。各处理下RBCs的数目随着时间的延长有不同程度的增加(增加率为35.3% ~38.1%)。其中,与24 h时相比,蒸馏水中培养36 h后RBCs数量平均增加了1497个,RBCs数量达4236个,此时RBCs数目达各处理最高。
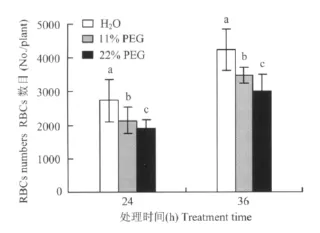
图1 干旱胁迫对黑豆根尖根边缘细胞数目的影响Fig.1 Effect of the drought stress on root border cells(RBCs)number in root tips of black soybean
2.2 干旱胁迫对RBCs黏液厚度的影响
露白的黑豆种子经过悬空培养后,收集RBCs并用墨水染色,由于黏液层不能被墨水染色,强光照射下在细胞壁外围可以观察到很亮的黏液层(图2)。干旱处理引起黏液层厚度增加,尤其是22%PEG处理时,厚达细胞直径的黏液层包裹了整个细胞,长时间(36 h)PEG处理下尤为明显。
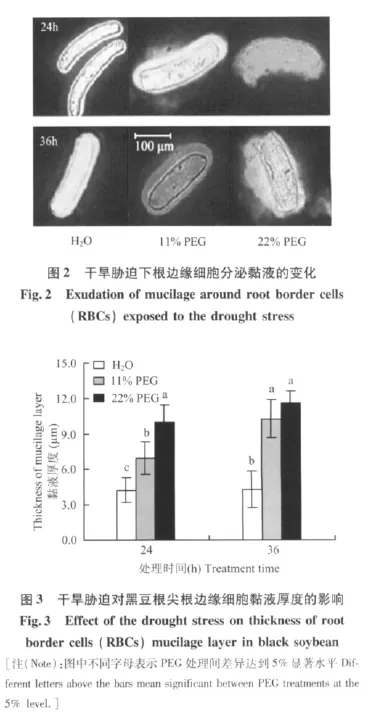
干旱胁迫24 h,11%和22%PEG处理的RBCs黏液厚度分别比对照增加了62.8%和133.8%(图3)。随着处理时间延长,蒸馏水处理组黏液变化不明显,而干旱处理组的黏液进一步增厚,11%和22%PEG处理时黏液层厚度分别比对照增加了140.7%和172.7%。表明干旱胁迫刺激边缘细胞黏液的产生,胁迫程度越重,胁迫时间越长,黏液产生量越多。
2.3 干旱胁迫下RBCs对黑豆根相对伸长率的影响
干旱胁迫显著抑制根伸长,胁迫程度越高、培养时间越长,对根伸长的抑制越明显,差异达显著水平(图4)。静置和振荡培养24 h,前者的根相对伸长率有高于后者的趋势。时间延长至36 h,11%PEG处理下两种培养方式对根相对伸长率无影响,而22%PEG处理时,振荡培养下的根相对伸长率比静置培养降低了42.5%。表明PEG处理引起的干旱胁迫对黑豆的根生伸长造成抑制,而长时间缺乏RBCs保护则会增强干旱胁迫的抑制作用。
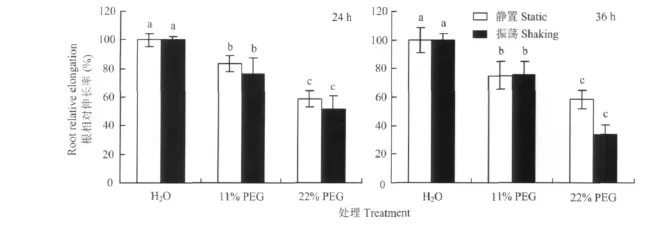
图4 干旱胁迫对黑豆根相对伸长率的影响Fig.4 Effect of the drought stress on relative root elongation in black soybean
2.4 干旱胁迫下RBCs对根系生理特性的影响
2.4.1 根系脯氨酸含量 脯氨酸是植物体内重要的渗透调节物质,其含量在一定范围内与植物抗逆能力存在相关性。振荡和静置培养下黑豆根系脯氨酸含量表现出极显著差异(P<0.01),振荡培养24 h后根系脯氨酸含量达同处理下静置培养组的27.2% ~81.8%(表1)。36 h后振荡培养的各处理根系脯氨酸含量达同处理下静置培养组的2.8%~92.9%。随着PEG浓度的升高,脯氨酸含量受抑制程度也增加,尤其是36 h后振荡培养下PEG处理的根系脯氨酸含量大大下降,这可能与根系结构被破坏、细胞受到损伤有关。
2.4.2 根相对电导率 干旱胁迫下黑豆根相对电导率显著高于对照组,处理24 h和36 h后分别增加了43.7% ~85.1%和32.1% ~97.9%,PEG处理引起相对电导率的极显著增加(P<0.01)(表2)。24 h和36 h时振荡培养下的根相对电导率高于静置培养。上述结果说明,干旱培养条件下细胞质膜外渗率增加,除去根尖RBCs和黏液后黑豆根尖受到的损伤更加严重。
2.4.3 根系MDA含量 MDA是膜脂过氧化的产物,其含量的增加可作为细胞膜受破坏的标志之一。无论是振荡还是静置培养,干旱胁迫显著提高根尖MDA含量(表2),增幅达89.9% ~207.0%。两种培养方式相比,除11%PEG处理24 h外,振荡培养组的MDA含量均显著高于相同处理的静置培养组,该结果与相同处理的根相对电导率变化一致。上述结果表明,干旱胁迫引起黑豆根尖MDA含量的增加,移除根尖RBCs和黏液会导致根尖细胞受损更加严重。
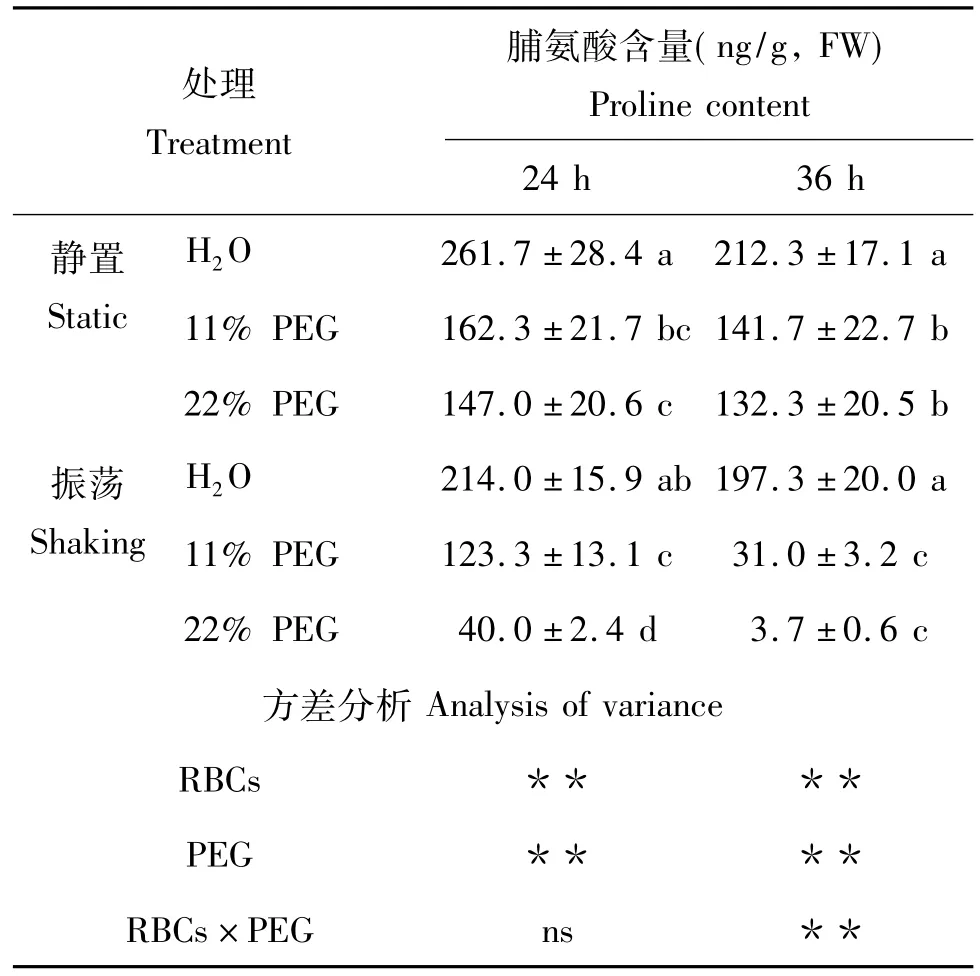
表1 干旱胁迫对黑豆根系脯氨酸含量的影响Table 1 Effect of the drought stress on proline content in black soybean
3 讨论与结论
大部分植物都有RBCs及其分泌的黏液包裹于根尖,形成套膜结构,在维持干燥土壤的根-土联系中起重要作用[18]。黏液的成分主要由两大类水溶性不同的物质组成[19]:一种是能与Ca2+结合的具有凝胶性质的果胶类物质,由于有半乳糖、鼠李糖、岩藻糖和糖醛酸等的存在,黏液具有亲水性和阳离子交换特性[20];而另一种则为不具凝胶性质的物质。在干燥土壤中,黏液脱水使得RBCs紧紧包裹于根尖周围[18],当遇到水时,RBCs又容易从根尖释放[21];例如根际土壤干燥时,黏液中的RBCs和其它的高分子量多糖的存在,起到了表面活性剂作用,降低根系周围的表面张力。同时,黏液中悬浮的根RBCs使黏液具有粘弹性质,吸引土壤颗粒向根表移动,以维持土壤的水连续性,有利于养分如磷的迁移和吸收[22];并且土壤干燥和黏液脱水时,黏液粘性增加,均有助于根圈(Rhizosheath)形成[23],增加根际土壤结构的稳定性。
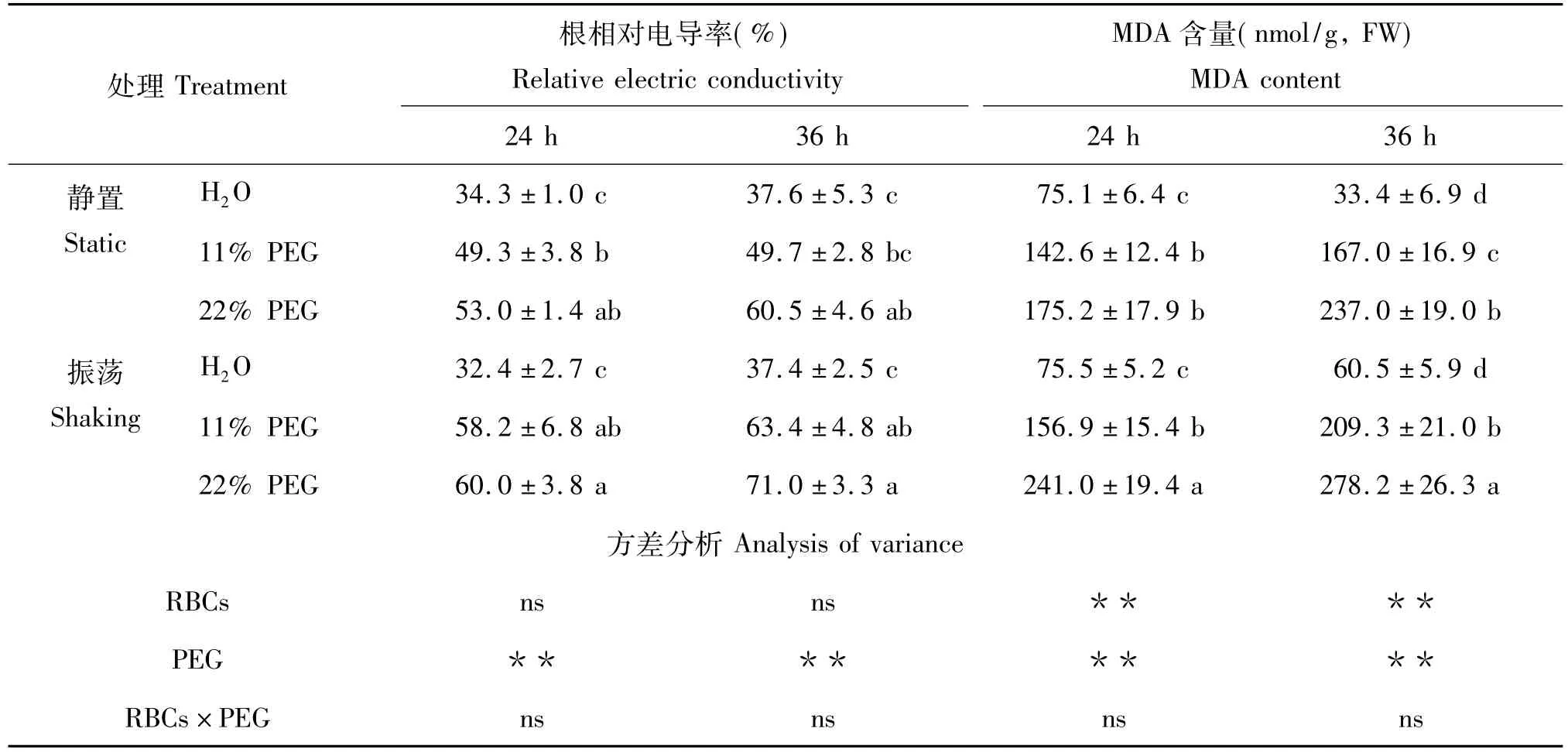
表2 干旱胁迫对黑豆根相对电导率和MDA含量的影响Table 2 Effect of the drought stress on relative electric conductivity and MDA content in black soybean
McCully等人[24]的研究表明,自然干燥后玉米根部黏液具有-11 MPa的水势。然而,这种干燥的黏液能够在120 s内迅速吸取水分使其水势达到0。本文采用PEG模拟干旱胁迫环境,PEG造成的干旱作用事实上是限制了水分进入根部的速度而引起植物的生理性干旱。有研究证明[25],黏液中所含相当多的未酯化半乳糖醛酸对水分具有很大的吸附能力,吸水膨胀,能使根部在短时间内吸收大量水分,并且黏液使根尖具有较强的保水能力,使植物根系失水较慢。有早期研究[26]表明,玉米黏液具有集中水分的能力,而水分积聚表现为黏液单位体积的增大。本实验结果也显示,干旱胁迫引起黑豆根尖RBCs黏液释放量增加,保留RBCs及黏液根尖相对电导率和 MDA,均低于移除 RBCs的根尖,说明RBCs和黏液的存在有利于根系抵抗干旱缺水造成的不利影响。RBCs对干旱的响应尤为显著,干旱胁迫导致RBCs黏液的大量释放,推测在干旱条件下根尖RBCs通过分泌更多的黏液,增强保水作用,为根部生长保证充足的水分。Read等人[26]的研究发现,随着黏液浓度增加,黏液的粘性也逐渐升高。而Watt等人的研究表明,在干旱土壤条件下,禾本科植物根部形成体积大、有粘结性的根套,且根套的形成主要就是通过黏液的粘性作用,这与本文干旱处理导致黏液分泌量增加的结果一致。沙生植物如白沙蒿的果皮外层也具有粘稠的黏液层,该层在遇水后迅速吸水膨胀,同样有助于干旱和盐害胁迫下种子的萌发[27]。
干旱诱导的膜脂过氧化是造成植物细胞膜受到损伤的关键因素,而膜伤害是导致植物组织伤害和衰老的重要诱导因素。MDA是反应膜脂过氧化程度的指标,与质膜透性参数结合可综合反映植物膜系统的受损程度。本实验中干旱胁迫导致黑豆根尖的MDA含量和根系电导率大幅度增加(24 h),尤其是22%PEG处理组,除去RBCs后MDA和根相对电导率增加量高于保留RBCs组,证实除去RBCs后黑豆根尖细胞质膜受到的破坏程度更高。脯氨酸是水溶性最大的氨基酸,植物受到水分胁迫时它的增加有助于细胞或组织的储水,防止脱水,这有助于提高其抗旱性。而脯氨酸作为重要的渗透调节物质,能够保持原生质和环境渗透平衡,影响蛋白质稳定性,保持膜结构的完整。本文中振荡培养移除RBCs及黏液后根系的脯氨酸含量远低于同处理的静止培养根系,说明根尖保留RBCs有利于根系维持较高的脯氨酸含量,提高保水、减少失水的能力,增强黑豆的抗旱性。
综上所述,干旱胁迫能减少根尖RBCs的数目,促进了RBCs的黏液分泌。黑豆根尖RBCs的存在,显著提高了干旱胁迫下根系的脯氨酸含量,减少了细胞损伤,有利于根系生长,从而提高黑豆的抗旱能力。
[1]汪洪,汪立刚,周卫,金继运.干旱条件下土壤中锌的有效性及与植物水分利用的关系[J].植物营养与肥料学报,2007,13(6):1178-1184.Wang H,Wang L G,Zhou W,Jin J Y.Soil zinc availability under water stress condition and its relationship with plant water utilization:A review[J].Plant Nutr.Fert.Sci.,2007,13(6):1178-1184.
[2]Morel J L,Habib L,Plantureux S et al.Influence of maize root mucilage on soil aggregate stability[J].Plant Soil,1991,136:111-119.
[3]Liebersbach H,Steingrobe B,Claassen N.Roots regulate ion transport in the rhizosphere to counteract reduced mobility in dry soil[J].Plant Soil,2004,260:79 -88.
[4]Bengough A G,Bransby M F,Hans J et al.Root response to soil physical conditions;growth dynamics from field to cell[J].J.Exp.Bot.,2006,57:437 -447.
[5]Hawes M C,Gunawardena U,Miyasaka S,Zhao X W.The role of root border cells in plant defense[J].Trends Plant Sci.,2000,5:128-133.
[6]Yu M,Shen R F,Liu J Y et al.The role of root border cells in aluminum resistance of pea(Pisum sativum)grown in mist culture[J].J Plant Nutr.Soil Sci.,2009,172:528 -534.
[7]Cai M Z,Zhang S N,Xing C H et al.Developmental characteristics and aluminum resistance of root border cells in rice seedlings[J].Plant Sci.,2011,180:702 -708.
[8]Cai M Z,Wang F M,Li R F et al.Response and tolerance of root border cells to aluminum toxicity in soybean seedlings[J].J.Inorg.Biochem.,2011,105:966-971.
[9]Gunawardena U,Rodriguez M,Straney D et al.Tissue-specific localization of root infection by Nectria haematococca mechanisms and consequences[J].Plant Physiol.,2005,137:1363 -1374.
[10]Gunawardena U,Hawes M C.Tissue specific localization of root infection by fungal pathogens:role of root border cells[J].Mol.Plant Microb.Interact.,2002,15:1128 -1136.
[11]Hawes M C,Curlango-Rivera G,Wen F S et al.Extracellular DNA:The tip of root defenses? [J].Plant Sci.,2011,180:741-745.
[12]Hubbard J E,Flores-Lara Y,Schmitt M et al.Increased penetration of host roots by nematodes after recovery from quiescence induced by root cap exudates[J].Nematology,2005,7:321 -331.
[13]孔妤,王忠,熊飞,等.PEG胁迫下水稻根外皮层厚壁细胞的解剖学研究[J].扬州大学学报(农业与生命科学版),2008,29(1):61-65.Kong Y,Wang Z,Xiong F et al.Anatomical studies on the sclerenchyma on the edge of exodermis in rice roots under PEG-induced drought stress[J].J.Yangzhou Univ.(Agric.Life Sci.Ed.),2008,29(1):61-65.
[14]Michel B E,Kaufmann M R.The osmotic potential of polyethylene glycol 6000[J].Plant Physiol.,1973,51:914 -916.
[15]Zhu M Y,Ahn S J,Matsumoto H.Inhibition of growth and development of root border cells in wheat by Al[J].Physiol.Plantarum,2003,117:359-367.
[16]Bates L S,Waldren R P,Teare I D.Rapid determination of free proline for water-stress studies[J].Plant Soil,1973,39:205 -207.
[17]林植芳,李双顺,林桂珠,等.水稻叶片的衰老与超氧物歧化酶活性及脂质过氧化作用的关系[J].植物学报,1984,26(6):605-615.Lin Z F,Li S S,Lin G Z et al.Superoxide dismutase activity and lipid peroxidation in relation to senescence of rice leaves[J].Acta Bot.Sin.,1984,26(6):605 -615.
[18]Read D B,Gregory P J,Bell A E.Physical properties of axenic maize root mucilage[J].Plant Soil,1999,211:87 -91.
[19]Goycoolea F M,Cárdenas A.Pectins from Opuntia spp:a short review[J].J.PACD,2004,5:17 -29.
[20]Jung C,Maeder V,Funk F et al.Release of phenols from Lupinus albus L.roots exposed to Cu and their possible role in Cu detoxification[J].Plant Soil,2003,252:301 -312.
[21]Hawes M C,Brigham L A.Impact of root borer cells on microbial populations in the rhizosphere[J].Adv.Plant Pathol.,1992,8:509-514.
[22]Bhadoria P S,Dessougi H E,Liebersbach H,Claassen N.Phosphorus uptake kinetics,size of root system and growth of maize and groundnut in solution culture[J].Plant Soil,2004,262:327-336.
[23]Gregory P J.Physical changes in the rhizosphere and their significance for plant-soil interactions[J].Acta Agron.Hung.,2000,48:107-112.
[24]McCully M E,Boyer J S.The expansion of maize root-cap mucilage during hydration.3:Changes in water potential and water content[J].Physiol.Plant,1997,99:169 -177.
[25]黄振英,Gutterman Y.油蒿与中国和以色列沙漠中的两种蒿属植物种子萌发策略的比较[J].植物学报,2000,42(1):71-80.Huang Z Y,Gutterman Y.Comparison of germination strategies of Artemisia ordosica with its two congeners from deserts of China and Israel[J].Acta Bot.Sin.,2000,42(1):71 -80.
[26]Read D B,Gregory P J.Surface tension and viscosity of axenic maize and lupin root mucilage[J].New Phytol.,1997,137:623-628.
[27]Yang X J,Dong M,Huang Z Y.Role of mucilage in the germination of Artemisia sphaerocephala(Asteraceae)achenes exposed to osmotic stress and salinity[J].Plant Physiol.Biochem.,2010,48:131-135.
