三维超声成像在乳腺癌诊断中的现状与发展
2012-11-19姜娓娓郑永平
姜娓娓,郑永平
香港理工大学 医疗科技及资讯学系,香港

图片由香港理工大学 纺织及制衣学系 研究生姚运茵 提供
0 前言
乳腺癌是女性最常见的恶性肿瘤之一。 2010年,美国有超过20万的女性诊断患有乳腺癌,约4万女性死于该疾病[1]。在我国部分城市,乳腺癌发病率已经成为女性恶性肿瘤的首位[2]。目前,医学上还没有有效的手段预防乳腺癌。据报道[3],早期乳腺癌的5年生存率可达98%,而晚期乳腺癌只有大约23% 。因此,早期诊断、早期治疗是提高乳腺癌患者生存率最重要的手段。乳腺影像检测方法以其无损、方便等特点成为临床常用的乳腺癌检测手段,其中,超声检测又以其实时性、无辐射和对良恶性肿瘤的高区分性成为诊断乳腺癌患者的首选手段[4]。
临床上常用的乳腺超声多为二维B型超声,这种传统的超声成像模式仅能提供乳腺某一断面的图像,具有一定的局限性。临床上需要根据多幅二维图像在脑海中拼出乳房组织的三维结构,这需要医生具有非常丰富的临床经验和长时间的训练,而这对于肿瘤的位置、形状和大小很容易产生不准确的估测结果,并且在后续的超声检查中,根据之前的二维超声图像,医生很难定位之前检查得到的图像,也很难重复得到同样位置的超声图像,这对于病灶的长期跟踪观察是不利的[5-6]。
乳腺三维超声能够解决上述二维超声所存在的问题,提供乳腺结构的三维超声图像。基于三维图像,医生可以得到肿块精确的位置、大小和边界等信息[7]。此外,其他界面的图像,如乳腺冠状面图像,也可以通过三维超声图像得到,这些角度的图像可以为医生提供更多、更准确的诊断信息,提高该病诊断的准确性。
由于乳腺三维超声所存在的独特的优势,其引起了越来越多科研工作者和临床医生的兴趣。近10年来,乳腺三维超声成像技术取得了迅猛的发展。本文将对乳腺三维超声的成像系统和临床应用2个方面进行综述,并对其发展前景进行展望。
1 乳腺三维超声成像系统
最常见的乳腺三维超声成像系统是基于传统的二维超声发展而来,现在可见的其采集方式主要有3种:机械式采集方式、手持式采集方式和二维超声换能器,见图1。前2种方式是基于一维超声换能器,利用超声探头的物理运动来得到第三维方向上的信息。机械式采集方式用1个机械装置驱动一维超声换能器沿预先定义好的方向运动,从而得到若干切面的图像,见图1(a)。手持式采集方式通常用1个位置传感器附着于超声探头上,医生手握超声探头沿任意方向扫描得到若干二维超声图像,二维超声图像的位置信息由位置传感器检测得到,见图1(b)。不同于前2种借助于物理运动来得到第三维信息的方法,二维超声换能器是利用大量超声阵元进行电子扫描得到第三维方向上的信息,见图1(c)。
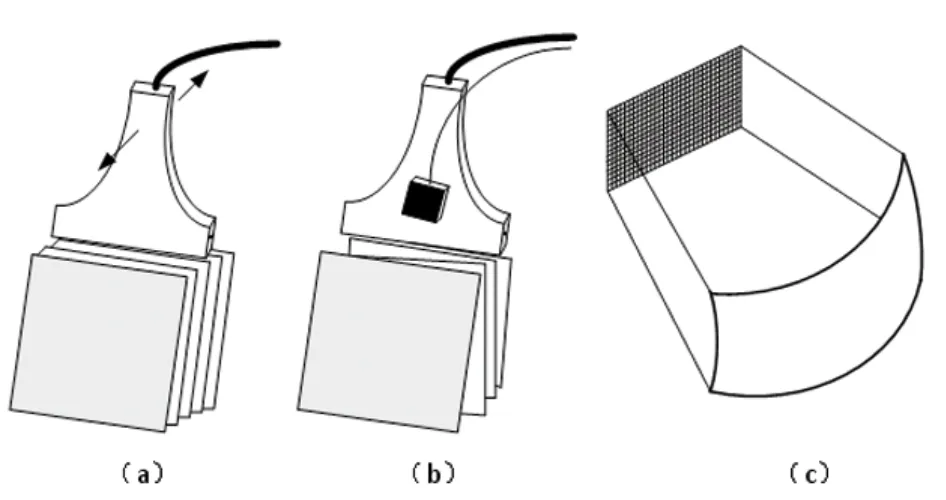
图1 3种乳腺三维超声采集方法
机械式扫描方式的超声探头运动被精确控制和记录,因此,这种方式得到的二维图像位置信息较为准确,并且由于扫描方式预先定义好,所以图像与图像之间一般不会存在大的未扫描区域,这对于得到高质量的三维图像是有利的[8-9]。1种常见的机械式扫描装置是一维超声探头用1个外套固定,在步进电机的驱动下沿单方向或者x、y2个方向运动。Hernandez等于2006年和Kotsianos-Hermle等[10-11]于2009年提出的机械式三维乳腺扫描装置即是这种模式。在这2套装置中,患者采用类似于钼靶扫描的姿势,坐于扫描装置前,乳房被2块平板压紧固定,超声探头即在上面平板上运动扫描。Sinha等[12]也提出类似的超声装置并将其与X光钼靶相结合组成1套多模式乳腺三维成像系统。除上述探头沿直线运动的扫描方式,Shipley等[13]提出1种环形扫描的三维超声成像装置,在这套装置中,患者采用俯卧的扫查体位,乳房垂下放置于1个倒圆锥形的容器中,容器侧边开口放置超声探头,容器与探头被步进电机驱动绕患者乳房环形运动。虽然上述装置还处于实验室阶段,但是商用的采用机械扫描方式的乳腺三维超声装置现在已被各公司陆续推向市场。一款为西门子公司推出的名为ACUSON S2000 ABVS自动全容积成像系统(Automated Breast Volume Scanner,ABVS)装置通过了临床测试,已经开始推向市场[14-16],该款设备每次扫描最多可达320张,间距0.5mm,容积达15.4cm×16.8cm×6.0 cm的二维超声图像,患者采用仰卧的扫查体位,每侧乳房各扫描3次以覆盖整个乳房。扫描结束后,图像被送至装置工作站中重建并提供乳腺多个切面的图像。另一款是由U Systems公司推出的自动乳腺超声波系统(Automated Breast Ultrasound System,ABUS),其装置采用与ABVS相似的扫描方式扫查患者乳房,可得到容积达15cm×17cm×5cm的一系列二维图像,重建得到三维超声图像[17]。TechniScan Medical Systems公司推出的名为Warm Bath Ultrasound的乳腺三维机械式扫描装置[18]与上述2款有较大不同,该款装置采用患者俯卧的扫查体位,患者乳房浸在装满温水的容器中,环形超声探头围绕乳房放置,探头从下向上移动扫描得到一系列的乳腺冠状面二维超声图像。
机械式采集方式的仪器大多比较笨重,装置较大,故限制了其在临床的实用性。手持式采集方式可以克服上述缺点,使用较为灵活,操作者可根据自己需要扫描任意位置[8-9]。为了得到二维超声图像的位置,1个位置传感器通常被附着于探头上,现在常用的位置传感器主要是电磁和光学位置传感器。1998年,Sato等[19]提出了1套用于乳腺手术引导的三维手持式超声装置,这套装置包括一维超声探头,光学传感器和1个摄像机。光学传感器用来得到超声图像的位置信息;二维超声图像分割重建后可以得到乳房肿块的三维超声图像;与此同时,整个乳房的图像信息由摄像机得到。最后,乳房肿块的三维超声图像被叠加于摄像机得到的乳房图像上。据报道,这套系统需要15~20min便可得到合成的叠加图像,利用叠加图像显示的肿瘤位置可实现手术引导[20]。利用手持式超声扫查乳腺,操作者通常利用超声探头按压乳房成像,这个按压的力会使乳房发生形变,在图像位置登记过程中,乳房的形变会使图像位置信息误登记 (mis-registration),从而导致在不同图像中的同一组织登记不同的位置。为了解决此问题,Xiao等[21-22]提出1种用于乳腺三维成像的非线性图像位置登记方法,并通过乳房仿体实验证实了该方法能有效提高位置登记的准确度。基于所提出的位置登记方法,Xiao[22]搭建了1套手持式乳腺三维超声扫描装置,该装置利用光学传感器来测量图像位置信息,实现了图像的采集、重建和显示并进行了临床实验证实了其有效性。
不同于前2种采集方式,基于二维超声换能器的乳腺三维超声成像装置不需要依靠物理运动来得到第三维信息,因此,这种采集方式的成像速度非常快[8-9,23]。但是,二维阵列换能器的空间分辨率受到已有制造工艺和技术的限制,很难达到与一维阵列换能器接近的水平。如设计128阵元的线阵,二维阵列换能器需要有16384个阵元,以目前的制造工艺和电路连接水平,这几乎是不可能实现的[7,24]。实际制造二维阵列换能器时,通常采用设计稀疏阵列的方法,这直接导致了空间分辨率的降低[24]。此外,二维超声换能器硬件成本高,电路设计复杂也是限制其广泛应用的重要因素。尽管二维超声换能器还存在诸多问题,但是其依旧被认为是最具发展前景的三维超声成像技术[24]。目前,国外知名厂商的高端超声诊断设备大多配备二维超声换能器,如飞利浦Sonos7500配备的X4 x-Matrix换能器及西门子的4Z1c容积探头。
三维乳腺超声层析成像技术(ultrasound tomography)是用若干超声换能器围绕乳房放置,换能器依次发射信号,其他换能器接收超声信号,从而重建得到乳腺组织的断层超声图像,超声层析成像技术的发展可追溯至20世纪70年代[25-26]。早期超声层析成像假设超声在物体内部以直线传播,利用时间延迟或振幅衰减来重建物体内部声速或吸收特性参数图像[27]。然而,超声在不均匀介质中传播会产生散射,因此,这种成像方法没有考虑到散射问题,所以成像质量较差。20世纪90年代以来,随着电子技术的发展和重建算法的改进,三维超声层析成像技术越来越展现出其巨大的发展潜力[28-34]。Li等[29]利用1个金属平板放于乳房下作为反射平面,线性超声换能器按压乳房组织并发射接收超声信号,重建得到乳房组织的图像信息。Ruiter等[30]提出的乳腺超声层析成像装置包括了384个发射换能器和1536个接收换能器,对乳房仿体成像并与MRI成像结果进行了对比。2007年,Duric等[31-32]报道了其研发的名为Computed Ultrasound Risk Evaluation (CURE)的乳腺层析成像装置,通过仿体实验和活体实验发现,该装置能够提供乳腺肿块的反射,声速和衰减图像,并能够检测到>15mm的乳腺肿块。因为乳腺三维层析成像会产生巨大的数据量(多达20GB)、图像处理及重建,所以需要花费大量的时间。为了解决此问题,Birk等[33]提出了1套基于现场可编程门阵列(Field-Programmable Gate Array,FPGA)的层析成像数据采集系统。通过对比发现,利用软件处理每张图像需要花费350μs,而利用FPGA仅需120 μs(频域算法)或50.5 μs(时域算法),从而可以大大节省成像时间。Huthwaite等[34]也于2011年提出了1种名为HARBUT(hybrid algorithm for robust breast ultrasound tomography)的重建算法,以加快重建速度。
2 乳腺三维超声成像系统的临床应用
利用超声评估乳腺肿块的大小、范围、形状和良恶性等是临床超声的1个重要应用范围。Tamaki等[35-36]利用其自行研发的三维成像系统对手术前乳腺肿块的一般特性进行评测,并将评测结果与CT、MRI对比。钱超文等[37]对48例乳腺癌患者进行二维及三维超声成像研究认为,三维超声对乳腺癌肿块内部微钙化、肿块与周围组织的关系有更清晰的显示,并且其诊断准确率(95.8%)明显高于二维超声(89.6%)。刘志聪等[38]的报道结果也表明了三维超声能够提供更为准确的病变部位,尤其是乳腺导管扩张腔内的微小颗粒状病变的信息。2010年,Tozaki等[39]利用西门子的自动全容积成像系统ABVS评估患者乳腺肿块的范围。这项评估包括了40例患者,在手术前一日,患者的肿块范围用ABVS扫描计算得到并与随后的手术结果对照。对照发现,由ABVS测量得到的98%的乳腺肿块范围与实际肿块相差<2cm。基于这套装置,研究者进一步报道了1种标准的四象限扫描法,并且与手持式二维超声对比发现,该方法可以扫查到所有乳腺肿块,不会发生遗漏[40]。Lin等[41]也以ABVS为研究对象,以81例乳腺患者为研究样本,在乳腺肿块数目、肿块最大直径、平均扫描时间、诊断的准确度、敏感性和特异性几方面进行了评测分析。2011年,Shin等[42]利用ABVS来测试不同操作者采用三维全自动超声对乳腺肿块检测和肿块特性分析的一致性,通过不同操作者对145个乳房肿块的分析报告看出,不同操作者依赖ABVS对乳房肿块的尺寸和位置报告有较好的一致性。钼靶一直被认为是乳腺癌检测的“金标准”,但是对于致密性乳房(dense breast),其准确性大幅降低。然而,超声在致密性乳房成像上有其无可比拟的优势,因此,临床上经常将二者结合起来以达到更好的检测效果。Kelly等[43-44]用三维自动超声辅助钼靶检测乳腺癌,发现二者的结合大大提高了检测的准确性,尤其是对于致密性乳腺疾病患者,对肿瘤良恶性的判断是超声乳腺癌检测的1个重点亦是1个难点。乳腺肿块的边缘特点、“汇聚征”(在冠状面上观察到呈放射状向肿块聚集的中强回声,也有研究者称为“太阳征”)和界面回声完整性是3个观察乳腺癌三维重建图像的重要指标[45]。白志勇等[46]研究发现,在冠状面重建图像上,利用完整界面回声诊断乳腺良性肿块的敏感性为64.2%,特异性可达94.4%;利用汇聚征诊断恶性肿块的敏感性为52.8%,特异性达93.4% 。顾继红等[47]研究结果发现,恶性肿块呈“汇聚征”的敏感性为66.7%,特异性为93.3%;良性肿块呈完整回声界面的敏感性为73.3%,特异性为88.9% 。周世崇等[48]利用与“汇聚征”相似的“太阳征”概念来区分肿瘤良恶性,报道其准确性达86.93%,敏感性达78.38%,特异性为94.94% 。上述3篇报道结果相一致,这表明,结合三维超声图像、“汇聚征”及界面回声指标区分肿瘤良恶性的可行性。2011年,Chang等[49]研究了利用U Systems公司的自动乳腺超声波系统ABUS检测良恶性乳腺肿瘤的性能。该研究包括105例研究对象,其中,乳腺恶性肿瘤23例、乳腺良性肿瘤44例及健康者38例。3名医生利用扫描得到的超声图像判断肿瘤的良恶性,然后将判断结果与活检结果相比较。结果显示,3名医生对恶性肿瘤分析的敏感性(约90%)远远高于对良性肿瘤的敏感性(约65%)。基于自动分割的乳腺癌自动诊断方法对于节省临床检测时间具有重要的作用。Moon等[50]基于ABUS得到的超声图像和自行开发的自动分割技术对乳腺肿块进行良恶性判断,通过对147例研究对象(乳腺良性肿瘤76例,乳腺恶性肿瘤71例)的测试发现,研究者提出的自动分类方法,准确性为85.0%(125/147),敏感性为84.5%(60/71),特异性为85.5%(65/76)。
相比于钼靶和MRI,超声具有实时性的优势,因此,超声成为临床实时引导不可或缺的诊断工具。齐治等[51]认为,三维超声在乳腺肿物的介入性诊疗中主要有2个优势:① 通过多平面成像的旋转和平行移动,可以在冠状面上确认针尖的位置;② 对于复杂针型,三维超声可准确显示其立体形态。2000年,Weismann等[52]研究证明了三维超声引导乳腺组织活检的有效性,该项研究包括了212例乳腺组织活检病例,所有病例均利用普通二维超声引导,然后利用三维超声扫描证实活检针的位置。实验发现,三维超声能够有效地帮助操作者正确找到活检组织的位置,定位活检针的位置。上述研究虽然证实了三维超声的有效性,但是并未将三维超声实际运用到实时引导中。Smith等[53]将实时三维超声用于引导乳腺组织活检,并且用乳房仿体进行了测试。结果发现,对于不同操作者的操作,这套系统均可以将活检针放在距离目标体1.16mm范围内。相比依赖于操作者判断的活检装置,Liang等[54-55]报道的全自动三维超声引导乳腺组织活检系统显得更有吸引力,这套系统以三维超声为引导,用1个“6+1”自由度的机械臂实现不需操作者干预的、完全自动的活检过程。经过在火鸡乳房上的测试发现,该套系统的均方根误差仅为1.15mm。2011年,Kim等[56]对比了二维超声引导和三维容积探头引导的差别,并且比较了对经验丰富和经验不足操作者的影响。对比发现,三维超声能够提高活检的可靠性和准确性,尤其对于经验不足的操作者。
随着乳腺癌手术技术的成熟,对于早期乳腺癌患者,经常采用保乳术+术后放疗治疗。在术后放疗过程中,超声通常被用于检测瘤灶床区(tumor bed)的位置。2011年,Wong等[57]报道了利用三维超声定位乳腺肿瘤灶床区位移,通过与CT结果相比较,证实了三维超声的可用性。Chadha等[58]也报道采用三维超声检测乳腺肿瘤的灶床区,实时引导放疗。病理完全反应率(pathological complete response,PCR)是评价辅助化疗患者生存率的1个重要指标;Gounaris等[59]通过对临床患者的测试证实了利用三维超声检测该指标的可行性。
多普勒超声对于评价乳腺肿瘤的良恶性有着重要的作用,很多研究者也致力于此方面的研究,如Peters-Engl等[60]报道的血流速度正比于肿块的体积;Madjar等[61]报道的血管数目和血流速度的差异可用来区分乳腺肿块的良恶性。这些研究对于评价乳腺肿块有着积极的意义,但是其都是基于二维多普勒超声研究得到的。为了评价三维多普勒超声的作用,Carson等[62]对照了二维和三维多普勒超声在乳腺肿块诊断中的作用,对照发现,在乳腺肿块良恶性的判断方面,三维多普勒超声(85%)相比于二维多普勒超声(79%)有着更高的特异性。郭燕丽等[63]评估了三维彩色血管能量成像(three-dimensional color power angiography,3D-CPA)在鉴别乳腺肿块良恶性方面的价值,研究发现,三维能量血管成像能直观地显示恶性乳腺肿块的立体结构特点,以达到“血管造影”的效果。石富文等[64]也报道了这方面的研究,发现良恶性肿块血流分布有着明显的差异。Hsiao等[65-66]进一步对比分析了三维多普勒超声组织谐波成像模式(tissue harmonic imaging)和非谐波成像模式(nonharmonic ultrasound),并认为两者在区分乳腺肿瘤良恶性上并没有明显差别。微泡造影剂能够增强三维乳腺超声图像中肿块的血管信号,从而可以加强超声的区分性[67]。LeCarpentier等[68]分析评价了6个常用的、由三维多普勒超声得到的参数,并对其对乳腺癌良恶性判断结果与活检结果进行了对比,结果发现,速度加权像素密度(speed-weighted pixel density)能够提供最为可靠的诊断结果。基于这些参数,学者们进一步发展了用于三维多普勒超声图像的自动诊断技术,其中,包括了基于支持向量机(support vector machine)及神经网络 (neural network)等自动分类器[69-71]。
除上述所提到的乳腺肿块一般特性成像、实时引导等方面的应用,乳腺三维超声成像也被研究者用于其他研究乳腺癌的应用中。Zhao等[72]利用三维超声成像,观察老鼠乳房的肿瘤生长和血管生成,记录了肿瘤生长过程中感兴趣区(region of interest,ROI)、体积及血管密度的生长变化,这对于理解肿瘤机制有很好的帮助。乳腺致密是乳腺癌高发的重要因素之一。据报道,致密性乳腺的女性患乳腺癌的风险是非致密性乳腺女性的1.8~6.0倍[73]。因此,检测乳腺的密度对于筛查乳腺癌危险人群具有重要作用。Moon等[74]利用三维超声实现了对乳房密度的测定。乳腺导管系统是乳汁输送的重要结构,同时也是恶性肿瘤多发的部位。Gooding等[75]利用三维超声观察哺乳期女性乳腺的导管系统,并根据超声图像绘制乳腺导管分布图。
3 展望
乳腺三维超声相对于传统的二维超声有着巨大的优势,其不但可以提供乳腺肿块的三维信息,还能够提供二维超声所观察不到的冠状面图像,对于肿块体积、边界及良恶性的判断有着重要的作用。近年来,随着计算机和电子技术的迅猛发展,乳腺三维超声成像取得了长足的发展,越来越多的临床实验证明,乳腺三维超声成像可以在肿瘤诊断、活检引导和术后放疗等方面提供1种安全、廉价和可靠的成像方式。但是,作为1种将用于临床日常诊断的成像模式,乳腺三维超声还有很多问题需要解决。
首先,现在商业可用的乳腺三维超声大多为机械式扫描方式,仪器装置笨重,扫描范围和扫描方式受到装置很大限制。对于靠近腋窝、胸腔等位置的组织无法完全覆盖,需要二维手持式超声协助补充扫描,这造成了临床使用的繁琐性。相对于机械式扫描方式,手持式乳腺三维超声操作灵活,具有更大的发展潜力,但是由于受到成像质量、重建速度等因素的影响,其今后的发展还有很长的路要走。其次,作为1种临床诊断工具,乳腺三维超声需要将友好的用户界面,简洁的操作流程作为发展目标。现在,乳腺三维超声所提供的三维显示通常需要操作者选择多个按钮或使用多级菜单输入一系列的参数。未来的乳腺三维超声应该能够提供更为简洁的操作方式和更为形象的显示模式,以节省诊断时间,缩短诊断流程,使得乳腺三维超声系统真正成为一款临床可用的医疗器械而不是1个计算机程序。最后,为了加强患者管理和减少等待时间,乳腺三维超声必须在不增加硬件复杂度的基础上进一步减少重建和显示时间。三维超声设计者应该能够以扫描后马上提供实时动态三维超声图像为目标。基于三维超声图像的自动分割、自动分类的计算机自动诊断技术(computer aided diagnosis)也需要进一步发展,以提供统一的诊断标准,节省诊断时间。
[1]Jemal A, Siegel R, Xu J,et al.Cancer statistics[J].CA-A Cancer Journal for Clinicians, 2010,(60): 277-300.
[2]何晓东,顾素英.乳腺超声成像现状与发展[J].中华全科医学,2010,8(2):231-233.
[3]American Cancer Society.Breast cancer facts & figures [M].Atlanta: American Cancer Society, 2011.
[4]Stavros AT.Breast Ultrasound[M].Philadelphia: Lippincott Williams & Wilkins, 2004.
[5]Boctor.E,Saad.A,Chang Der-Jen,et al.PC-Based System for Calibration, Reconstruction, Processing, and Visualization of 3D Ultrasound Data Based on Magnetic-Field Position and Orientation Sensing System[J].Lecture Notes in Computer Science, 2001, (2074) :13-22.
[6]Watermann D.O.,Földi M,Hanjalic-beck.A, et al.Threedimensional Ultrasound for the Assessment of Breast Lesions[J].Ultrasound Obstet Gynecol, 2005,25(6): 592-598.
[7]韩志会,郑驰超,彭虎.三维超声成像综述[J].中国医疗器械信息, 2011,17(7): 9-14.
[8]Fenster A, Downey DB,Cardinal HN.Three-dimensional ultrasound imaging[J].Physics in Medicine and Biology, 2001,46 (5): R67-R99.
[9]Fenster A, Downey DB.3-D ultrasound imaging: a review[J].IEEE Engineering in Medicine and Biology Magazine, 1996, 15(6): 41-51.
[10]Hernandez A, Basset O, Dautraix I,et al.Acquisition and stereoscopic visualization of three-dimensional ultrasonic breast data[J].IEEE Transactions on Ultrasonics, Ferroelectrics, and Frequency Control, 1996,43 (4) : 576-580.
[11]Kotsianos-Hermle D, Wirth S, Fischer T, et al.First clinical use of a standardized three-dimensional ultrasound for breast imaging[J].European Journal of Radiology, 2009,71 (1):102-108.
[12]Sinha SP, Roubidoux MA, Helvie MA, et al.Multi-modality 3D breast imaging with X-ray tomosynthesis and automated ultrasound[A].Proceedings of the 29th Annual international Conference of the IEEE EMBS cite internationale, August 23-26, 2007 [C].Lyon: France, 2007.
[13]Shipley JA, Duck FA, Goddard DA, et al.Automated quantitative volumetric breast ultrasound data-acquisition system[J].Ultrasound in Medicine and Biology, 2005,31 (7):905-917.
[14]Lazebnik RS.Tissue strain analytics virtual touch tissue imaging and quantification[EB/OL].(2008-10-16)[2012-03-07].http://www.medical.siemens.com/siemens/en_US/gg_us_FBAs/files/misc_downloads/Whitepaper_VirtualTouch.pdf.
[15]Porter BA,Seck H.Visualization of mammographically occult breast cancer-two cases[EB/OL].(2009-07-10)[2012-03-07].http://www.medical.siemens.com/siemens/en_GB/gg_us_FBAs/files/misc_downloads/ABVS_whitepaper_616909.pdf.
[16]Clevert DA.Use of automated breast volume scanning in breast evaluations[EB/OL].(2011-09-01)[2012-03-07].http://www.medical.siemens.com/siemens/it_IT/gg_us_FBAs/files/Case_Studies/CaseStudy_Clevert_ABVS.pdf.
[17]Introducing somo.v platinum automated breast ultrasound[EB/OL].(2011-06-07)[2012-3-7].http://u-systems.com/product/introducing-somo-v-insight-class-automatedbreast-ultrasound-system-abus.
[18]Technology: warm bath ultrasound (WBU) system image review [EB/OL].(2010-05-13) [2012-03-07]http://www.techniscanmedicalsystems.com/index.php?p=WBU%3Csup%3ETM%3C/sup%3E%20System%20 Image%20Review/.
[19]Sato Y, Nakamoto M, Tamaki Y,et al.Image guidance of breast cancer surgery using 3-D ultrasound images and augmented reality visualization[J].IEEE Transactions on Medical Imaging,1998,17 (5): 681-693.
[20]Tamaki Y, Sato Y, Nakamoto M, et al.Intraoperative navigation for breast cancer surgery using 3D ultrasound images[J].Computer Aided Surgery, 1999,4 (1): 37-44.
[21]Xiao GF, Brady M, Noble JA, et al.Nonrigid registration of 3-D free-hand ultrasound images of the breast[J].IEEE Transactions on Medical Imaging, 2002,21 (4): 405-412.
[22]Xiao GF.3-D Free-hand Ultrasound Imaging and Image Analysis of the Breast[D].Oxford:University of Oxford, 2001.
[23]Gee A, Prager R, Treece G, et al.Engineering a freehand 3D ultrasound system[J].Pattern Recognition Letters, 2003,24(4):757-777.
[24]白培瑞,白净.基于二维阵列换能器的实时三维超声成像技术综述[J].中国生物医学工程学报, 2011, 30 (6): 938-945。
[25]Norton SJ ,Linzer M.Ultrasonic reflectivity tomography:Reconstruction with circular transducer arrays[J].Ultrasonic Imaging, 1979, 1 (2): 154-184.
[26]Greenleaf JF, Bahn RC.Clinical imaging with transmissive ultrasonic computerized tomography[J].IEEE Transactions Biomedical Engineering, 1981,28 (2): 177-185.
[27]刘超,王理,昌明,等.超声计算层析成像技术[J].北京生物医学工程, 2002,21 (2): 152-155.
[28]Jago JR , Wittingham TA.Experimental studies in transmission ultrasound computed tomography[J].Physics in Medicine and Biology, 1991,36 (11): 1515-1527.
[29]Li PC , Huang SW.Ultrasound tomography of the breast using linear arrays.30th IEEE International Conference on Acoustics,Speech, and Signal Processing[R].Philadephia:PA,2005.
[30]Ruiter NV, Schwarzenbeig GF, Zapf M, et al.3D ultrasound computer tomography results with a clinical breast phantom.IEEE Ultrasonics Symposium [R].Vancouver,2006.
[31]Duric N, Littrup P, Poulo L,et al.Detection of breast cancer with ultrasound tomography: first results with the computed ultrasound risk evaluation (CURE) prototype[J].Medical Physics, 2007,34(2): 773-785.
[32]Duric N, Li C, Glide-Hurst C, et al.Breast imaging with ultrasound tomography: clinical results at the Karmanos Cancer Institute.1st International Conference on Biomedical Engineering and Informatics [R].Sanya: Karmanos Cancer Institute,2008.
[33]Birk M, Koehler S, Balzer M,et al.FPGA-based embedded signal processing for 3-D ultrasound computer tomography[J].IEEE Transactions on Nuclear Science, 2011,58 (4): 1647-1651.
[34]Huthnwaite P, Simonetti F.High-resolution imaging without iteration: a fast and robust method for breast ultrasound tomography[J].Journal of the Acoustical Society of America,2011,130 (3): 1721-1734.
[35]Tamaki Y, Akashi-Tanaka S, Ishida T,et al.3D imaging of intraductal spread of breast cancer and its clinical application for navigation surgery[J].Breast Cancer, 2002,9 (4): 289-295.
[36]Inoue T, Tamaki Y, Sato Y, et al.Three-dimensional ultrasound imaging of breast cancer by a real-time intraoperative navigation system[J].Breast Cancer, 2005,12 (2): 122-129.
[37]钱超文,徐栋,边晔萍,等.应用三维超声重建成像诊断乳腺癌[J].癌变畸变突变, 2005,17 (6): 374-376.
[38]刘志聪,滕淑琴,等.三维超声成像在乳腺疾病中临床应用研究[J].中国超声诊断杂志, 2003,4 (10): 751-753.
[39]Tozaki M, Fukuma E.Accuracy of determining preoperative cancer extent measured by automated breast ultrasonography[J].Japanese Journal of Radiology, 2010,28 (10): 771-773.
[40]Tozaki M, Isobe S, Yamaguchi M, et al.Optimal scanning technique to cover the whole breast using an automated breast volume scanner[J].Japanese Journal of Radiology, 2010, 28 (4):325-328.
[41]Lin X, Wang J, Han F, et al.Analysis of eighty-one cases with breast lesions using automated breast volume scanner and comparison with handheld ultrasound[J].European Journal of Radiology, 2011,28(12):69-72.
[42]Shin HJ, Kim HH, Cha JH,et al.Automated ultrasound of the breast for diagnosis interobserver agreement on lesion detection and characterization[J].Roentgenology, 2011,197 (3): 747-754.
[43]Kelly KM, Dean J, Comulada WS,et al.Breast cancer detection using automated whole breast ultrasound and mammography in radiographically dense breasts[J].European Radiology, 2010,20(3): 734-742.
[44]Kelly KM, Dean J, Lee SJ, et al.Breast cancer detection:radiologists,performance using mammography with and without automated whole-breast ultrasound[J].European Radiology,2010, 20 (11): 2557-2564.
[45]林馥纯,胡萍香.三维超声成像技术在乳腺癌诊断中的应用[J].中国中西医结合影像学杂志, 2011,9 (2): 163-166.
[46]白志勇,张武,苗立英,等.三维超声重建冠状断面检查诊断乳腺良恶性肿物的探讨[J].中国医学影像技术, 2002,18 (4):355-357.
[47]顾继红,苏一巾,杜联芳.三维超声成像对乳腺肿块诊断价值的初步探讨[J].中国超声医学杂志, 2007,23 (1): 67-69.
[48]周世崇,常才,陈敏,等.实时三维超声鉴别乳腺良恶性肿块的价值[J].中华超声影像学杂志, 2006,15 (12): 906-909.
[49]Chang JM, Moon WK, Cho N, et al.Radiologists' performance in the detection of benign and malignant masses with 3D automated breast ultrasound (ABUS)[J].European Journal of Radiology, 2011,78 (1): 99-103.
[50]Moon WK, Shen YW, Huang CS, et al.Computer-aided diagnosis for the classification of breast masses in automated whole breast ultrasound images[J].Ultrasound in Medicine and Biology, 2011,37(4): 539-548.
[51]齐治,张学兰.三维超声成像技术在乳腺癌诊断中的应用[J].临床超声医学杂志, 2008,10 (7): 470-472.
[52]Weismann CF, Forstner R, Prokop E, et al.Three-dimensional targeting: a new three-dimensional ultrasound technique to evaluate needle position during breast biopsy[J].Ultrasound in Obstetrics & Gynecology, 2000,16 (4): 359-364.
[53]Smith WL, Surry KJM, Mills GR, et al.Three-dimensional ultrasound-guided core needle breast biopsy[J].Ultrasound in Medicine and Biology, 2001, 27 (8): 1025-1034.
[54]Liang K, Rogers AJ, Light ED, et al.Simulation of autonomous robotic multiple-core biopsy by 3D ultrasound guidance[J].Ultrasonic Imaging, 2010,32 (2): 118-127.
[55]Liang K, Rogers AJ, Light ED, et al.Three-dimensional ultrasound guidance of autonomous robotic breast biopsy:feasibility study[J].Ultrasound in Medicine and Biology, 2010,36(1): 173-177.
[56]Kim HC, Yang DM, Nam DH, et al.Ultrasound-guided biopsy of focal lesions using three-dimensional ultrasound with a matrix array transducer comparison with 2-dimensional ultrasound in a phantom study[J].Investigative Radiology,2011,46 (4): 264-270.
[57]Wong P, Muanza T, Reynard E, et al.Use of threedimensional ultrasound in the detection of breast tumor bed displacement during radiotheraphy[J].International Journal of Radiation Oncology Biology Physics, 2011,79 (1): 39-45.
[58]Chadha M, Young A, Geraghty C, et al.Image guidance using 3D-ultrasound (3D-US) for daily positioning of lumpectomy cavity for boost irradiation[J].Radiation Oncology, 2011, (6):45.
[59]Gounaris I, Provenzano E, Vallier AL, et al.Accuracy of unidimensional and volumetric ultrasound measurements in predicting good pathological response to neoadjuvant chemotherapy in breast cancer patients[J].Breast Cancer Research and Treatment, 2011,127 (2): 459-469.
[60]Peters-Engl C, Medl M, Mirau M, et al.Color-coded and spectral Doppler flow in breast carcinomas: relationship with the tumor microvasculature[J].Breast Cancer Research and Treatment, 1998,47 (1): 83-89.
[61]Madjar H, Prompeler HJ, Sauerbrei W, et al.Color Doppler flow criteria of breast lesions[J].Ultrasound Medicine and Biology, 1994, 20 (20): 849-858.
[62]Carson PL, Moskalik AP, Govil A, et al.The 3D and 2D color flow display of breast masses[J].Ultrasound in Medicine and Biology, 1997,23 (6): 837-849.
[63]郭燕丽,李锐,华兴,等.三维血管能量成像在乳腺肿块中的应用[J].临床超声医学杂志,2001,3(增刊): 90-92。
[64]石富文,黄红梅,张超,等.三维彩色血管能量成像鉴别乳腺肿块良恶性的价值[J].中国超声诊断杂志, 2005,6 (1): 3-5.
[65]Hsiao YH, Huang YL, Liang WM, et al.Characterization of benign and malignant solid breast masses: harmonic versus nonharmonic 3D power Doppler imaging[J].Ultrasound in Medicine and Biology, 2009,35 (3): 353-359.
[66]Hsiao YH, Huang YL, Kuo SJ, et al.Characterization of benign and malignant solid breast masses in harmonic 3D power Doppler imaging[J].European Journal of Radiology, 2009,71 (1):89-95.
[67]Krestan CR,Riedl C, Memarsadeghi M,et al.3D-power Doppler ultrasound of breast lesions with a microbubble contrast agent[A].Contrast Media Research Conference [C].Capri: 2001.
[68]LeCarpentier GL, Roubidoux MA, Fowlkes JB, et al.Suspicious breast lesions: assessment of 3D Doppler US indexes for classification in a test population and fourfold cross-validation scheme[J].Radiology, 2008,249 (2): 463-470.
[69]Kuo SJ, Hsiao YH, Huang YL,et al.Classification of benign and malignant breast tumors using neural networks and threedimensional power Doppler ultrasound[J].Ultrasound in Obstetrics & Gynecology, 2008,32 (1): 97-102.
[70]Chen ST, Hsiao YH, Huang YL, et al.Comparative analysis of logistic regression, support vector machine and artificial neural network for the differential diagnosis of benign and malignant solid breast tumors by the use of three-dimensional power Doppler imaging[J].Korean Journal of Radiology, 2009,10 (5):464-471.
[71]Chen HT, Lien YP, Liu PT, et al.Characterization of benign and malignant solid breast masses using vascular morphology in 3D power Doppler ultrasound images.2010 3rd International Conference on Biomedical Engineering and Informatics (BMEI 2010) [R].Yantai :Yantai University,2010.
[72]Zhao L, Zhan Y, Rutkowski JL, et al.Correlation between 2-and 3-dimensional assessment of tumor volume and vascular density by ultrasonography in a transgenic mouse model of mammary carcinoma[J].Journal of Ultrasound in Medicine,2010,29 (4): 587-595.
[73]Boyd NF, Guo H, Martin LJ, et al.Mammographic density and the risk and detection of breast cancer[J].New England Journal of Medicine, 2007, 356 (3): 227-236.
[74]Moon WK, Shen YW, Huang CS, et al.Comparative study of density analysis using automated whole breast ultrasound and MRI[J].Medical Physics, 2011,38 (1): 382-389.
[75]Gooding MJ, Finlay J, Shipley JA, et al.Three-dimensional ultrasound imaging of mammary ducts in lactating women[J].Journal of Ultrasound in Medicine, 2010,29 (1): 95-103.
