东亚飞蝗TLR9基因cDNA克隆及蛋白质序列分析
2012-11-17刘迎春聂惠蓉福建医科大学细胞生物学与遗传学系福建福州350004
刘迎春,聂惠蓉(福建医科大学细胞生物学与遗传学系,福建 福州 350004)
李裕红(泉州师范学院生物系,福建 泉州 362000)
东亚飞蝗TLR9基因cDNA克隆及蛋白质序列分析
刘迎春,聂惠蓉(福建医科大学细胞生物学与遗传学系,福建 福州 350004)
李裕红(泉州师范学院生物系,福建 泉州 362000)
东亚飞蝗(Locustamigratoriamanilensis)依靠先天性免疫系统来防御病原微生物的入侵,TLRs是天然免疫重要的病原体识别受体。在已知的东亚飞蝗TLR9受体基因(LmTLR9) 的cDNA部分序列基础上,进一步获得其序列并对其序列进行分析;观察金龟子绿僵菌(Metarhiziumanisopliae) 的侵染对蝗虫LmTLR9 mRNA 表达的影响。结果表明获得的LmTLR9 cDNA序列含有1个2340bp的开放阅读框,推定的蛋白质序列由780个氨基酸残基组成。与黑腹果蝇、冈比亚按蚊和致倦库蚊的氨基酸序列同源性分别为19.0%、26.0%和26.0%;与对照组相比,侵染绿僵菌24h和48h后,试验组东亚飞蝗中肠TLR9 mRNA 分别升高了7.17 %和4.97 %,但无显著性差异。
东亚飞蝗(Locustamigratoriamanilensis);Toll 样受体9基因;序列分析
飞蝗是一种洲际性农业重大害虫,东亚飞蝗(Locustamigratoriamanilensis)在我国分布面积广,危害最为严重。因而加强对飞蝗等农业害虫的研究和灾害的综合防治,已成为关系我国经济发展和社会稳定的重要因素。目前,由于化学农药的种种弊端,利用生物杀虫农药控制蝗虫已得到广泛认同。然而蝗虫的免疫防御作用极大地延缓了生物杀虫剂的杀虫速率。蝗虫没有类似于T细胞和B细胞的专一获得性免疫系统,先天免疫系统是其唯一的防御系统[1]。天然免疫系统主要分为2大类:体液免疫和细胞免疫。其中由昆虫脂肪体合成分泌抗菌肽形成的昆虫体液免疫最快。抗菌肽的合成由2条不同的信号通道调节:Toll信号途径和Imd信号途径[2]。
Toll样受体(Toll-like receptors,TLRs) 是参与Toll途径的主要基因产物,是一组与天然免疫密切相关、进化保守的受体家族。TLRs通过参与对不同病原体的PAMPs (Pathogen associated molecular pattern)进行识别,并将胞外识别信号传递到胞内,这是启动先天免疫所必需的[3]。Toll蛋白最早是在研究果蝇胚胎发育中背腹极性形成时被发现的,后又发现Toll蛋白与免疫应答的关系。随后在人类和其他动物中也有发现大量的Toll及同源蛋白,被称为Toll样受体(TLR)。研究表明,Toll样受体同源分子都是Ⅰ型跨膜蛋白,它由紧密相连的3个部分组成: 胞外段是富含18~31个亮氨酸重复序列(Leucine rich repeats,LRRs),参与对入侵病菌的PAMPs( Pathogen associated molecular pattern,PAMPs)识别;跨膜区是富含半胱氨酸的结构域;胞内段与IL-1受体(Interleukin-1 receptor IL-1R)同源[3]。迄今,在果蝇中已有12种Toll受体被鉴定,在冈比亚按蚊(Anophelesgambiae)、家蚕(Bombyxmori)和蜜蜂(Apismellifera)也分别有11、11和5种Toll样受体被鉴定[4-7]。这些受体对激活宿主昆虫的先天性免疫应答起着十分重要的作用, 然而,目前对于蝗虫Toll样受体的报道,仅限于获得部分TLR9的cDNA片段[8]。金龟子绿僵菌(Metarhiziumanisopliae) 是一类应用广泛的昆虫病原真菌,在蝗虫防治中起着重要作用[9]。目前已有报道在正常东亚飞蝗的中肠中检测到了TLR9基因的明显表达,但真菌的侵染是否对东亚飞蝗TLR9的表达有影响,但影响如何目前尚未见报道。为此,本研究通过已获得的cDNA片段进一步克隆蝗虫TLR9基因,用生物信息学方法进行了分析,并利用实时定量PCR方法研究该基因在绿僵菌侵染蝗虫后的表达量的变化,为进一步研究蝗虫TLR9受体在先天性免疫的作用奠定基础。
1 材料与方法
1.1 材料
1.1.1 实验动物、菌株和质粒
东亚飞蝗参照Gillespie等[10]的方法进行人工饲养:饲养温度30℃,相对湿度75%,光照时间12h/d;大肠杆菌JM 109 购自博大派克公司;金龟子绿僵菌菌株购自上海复祥生物科技有限公司;质粒pMD18-T购自宝生物工程有限公司。
1.1.2 主要试剂
Prime STARTMDNA Polymerase、SmartTMPCR cDNA Synthesis Kit为CLONTECH 公司产品; 限制性内切酶、牛小肠碱性磷酸酶(CIAP)、T4多核苷酸激酶(T4PNK) 和mRNA提取试剂盒购自Promega公司;High Pure Plasmid Isolation Kit 为Roche公司产品; 凝胶回收试剂盒为博亚生物技术有限公司产品; 其余试剂均为进口或国产分析纯试剂。
1.2 引物设计
为获得LmTLR9基因cDNA的5’ 端序列,采用SMART 5’-RACE 法,根据已知的cDNA片段序列设计嵌套式PCR引物T93、T94和T95。反转录引物T93为5’-AGGTCTTCTACTTGT-3’; 引物T94为5’-GCGCAGTCTCTTCAAGAA-3’; 引物T95为 5’-AATTGTCCAGACACCGATA -3’。
1.3 LmTLR9基因5’ 端cDNA 序列的克隆
取东亚飞蝗成虫中肠液氮研磨至粉末状,mRNA提取按试剂盒说明书进行。根据Genbank上已知的东亚飞蝗TLR9的部分cDNA序列(1230bp,含3’polyA),设计1条反转录引物T93和1对嵌套式PCR引物T94、T95,以东亚飞蝗mRNA 500ng为模板,按照5’-Full RACECore Set 描述的操作程序进行,首先以T93为反转录引物合成第一链cDNA,然后以其为模板,利用该试剂盒提供的5’PCR PrimerⅡA 和下游特异引物T94、T95,PCR 扩增出TLR9基因5’ 端cDNA 序列,然后将回收纯化后的PCR产物经PCR在3’ 端加A,并将产物连接到pMD218T Vector上。按文献采用氯化钙法制备大肠杆菌JM109感受态细胞,进行连接、转化、阳性克隆菌株的筛选及电泳鉴定。克隆菌株由上海Sangon公司进行DNA序列测定,将获得的序列和已知的3’端cDNA序列拼接得到LmTLR9序列,并进行分析。
1.4 序列分析
用ORF Finder 软件对克隆片段进行翻译,用Multalin软件进行同源性分析,用SOSUI WWW Server预测该氨基酸序列是否属于膜蛋白。用SMART软件分析氨基酸序列的结构功能域,用SOPMA 程序预测其二级结构。
1.5 荧光定量PCR 检测
取东亚飞蝗成虫初期雄虫,在其前胸背板用微量进样器接种含1.0×105个绿僵菌孢子的棉籽油5μl,分别于接种后0、24、48h提取东亚飞蝗的中肠的总RNA。根据东亚飞蝗TLR9和NADH的序列设计引物T9F 5’-GGAAGATT GTGGTCATTGTAG -3’;T9R 5’-ACCACTGACTGCGAAGA -3’; NADH F 5’- T CCACCAAAGACAGCAAC- 3’ ;NADH R 5’-T ATTCGT TTATGGGTTC 3’ 。以NADH为内参照。引物合成和测序由上海生物工程公司完成。荧光定量PCR 反应体系如下:10× PCR Buffer 2.5μl,10mmol/L dNTP 0.5μl,上、下游引物各0.5μl (10pmol/L),模板cDNA 1.5μl,Taq 酶0.2μl(50U/μl),10×SYBR Green Ⅰ 2.5μl,加去离子水至25μl。每个样本设3 个反应,反应条件为:94℃ 4 min;94℃ 20s,58℃ 20s,72℃ 30s,共40个循环。荧光定量PCR 结果以Ct值表示,Ct值为每个反应管内的荧光信号到达设定的域值时所经历的循环数。ΔCt值为基因的平均Ct值减去内标基因NADH的Ct值;ΔΔCt值为不同时间样品的ΔCt的差值;2-ΔΔCt为基因差异表达的倍数。
2 结果与分析
2.1 序列解析

图1 东亚飞蝗TLR9结构预测图
通过RT-PCR 和5’RACE方法克隆的东亚飞蝗TLR9基因cDNA部分序列( GenBank登录号:JQ910652,缩写名为LmTLR9),序列长度为2632bp。用ORF Finder对cDNA序列进行分析,该序列含有一个长2340bp的开放阅读框,由该序列推定的蛋白质序列由780个氨基酸残基组成。SOSUI软件预测东亚飞蝗TLR9受体是一个跨膜蛋白受体。根据SMART程序分析LmTLR9的氨基酸序列,LmTLR9是个3次跨膜蛋白( 图1),由胞外区、3个跨膜区(212~229aa,456~478aa,565~587aa)和胞内区3部分组成。其胞外结构域由多个串联重复的LRR序列组成,而胞内区含有与人白细胞介素1受体(IL-1R)高度同源的区域即TOLL/IL-1受体同源(TIR),说明LmTLR9分子具有病原分子模式识别和信号传导的作用。SOPMA 程序预测其二级结构:α 螺旋(Alpha Helix)占37.56 %,β 转角(Beta turn)占6.28 %,20.26%的延伸链(Extended strand),无规则卷曲(Random coil)占35.90% (图2)。
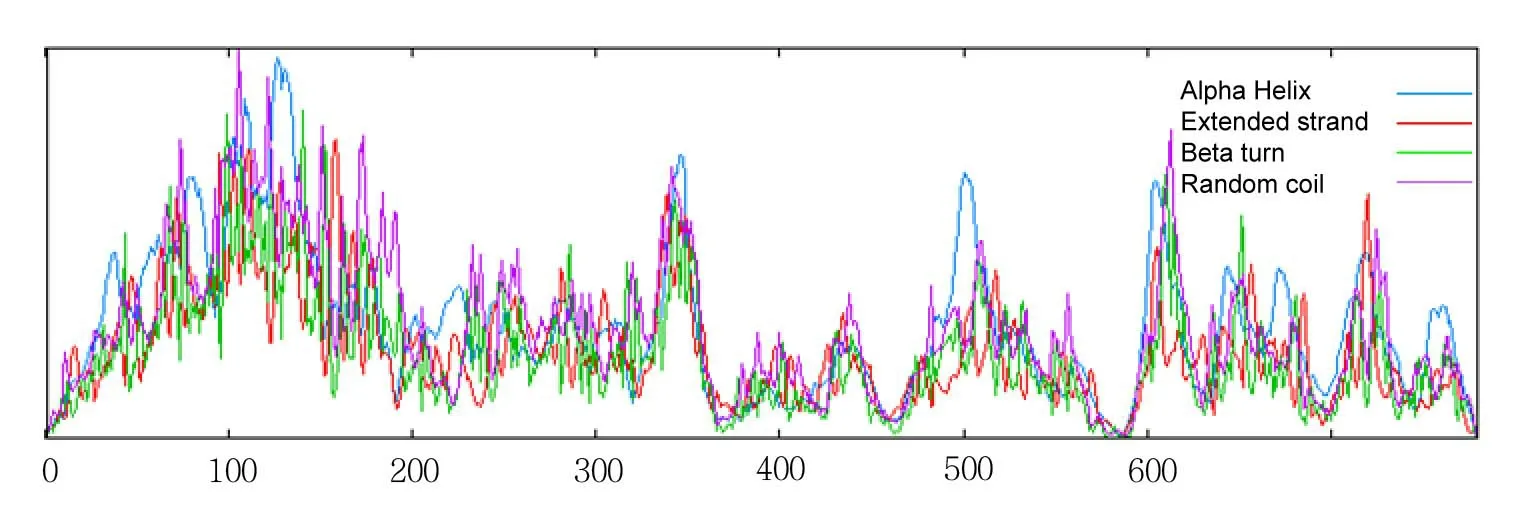
图2 东亚飞蝗TLR9二级结构预测图
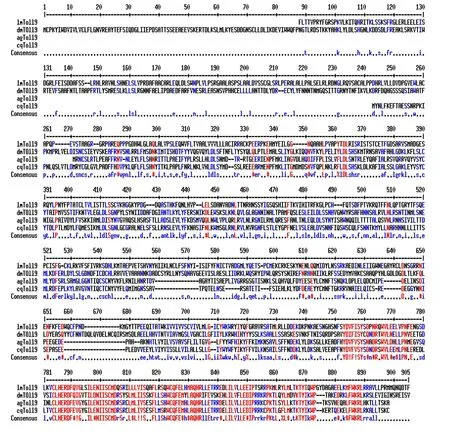
图3 东亚飞蝗TLR9 基因产物氨基酸序列同源性预测
2.2 东亚飞蝗TLR9氨基酸序列的同源性分析
推导氨基酸序列比较结果表明,东亚飞蝗TLR9与黑腹果蝇(登录号NP-649214)、冈比亚按蚊(登录号AAL37903)和致倦库蚊(登录号EDS27864)的TLR9 分子同源性分别为19.0%、26.0%和26.0%。通过分析发现,东亚飞蝗TLR9蛋白同其他昆虫的TLR9蛋白在受体同源区(TIR)具有较高的同源性,其他区域的同源性极低( 图3),表明TLR9在进化过程中保守性低。
2.3 东亚飞蝗TLR9基因的表达
荧光定量RT-PCR 方法检测LmTLR9基因在东亚飞蝗被绿僵菌侵染0、24、48h的表达水平,结果表明侵染绿僵菌24、48h的LmTLR9基因表达量分别为对照组的107.17%和104.97%,但差异不显著(Pgt;0.05),无统计学意义(表1)。这表明LmTLR9基因的表达量在侵染前后没有发生显著变化。
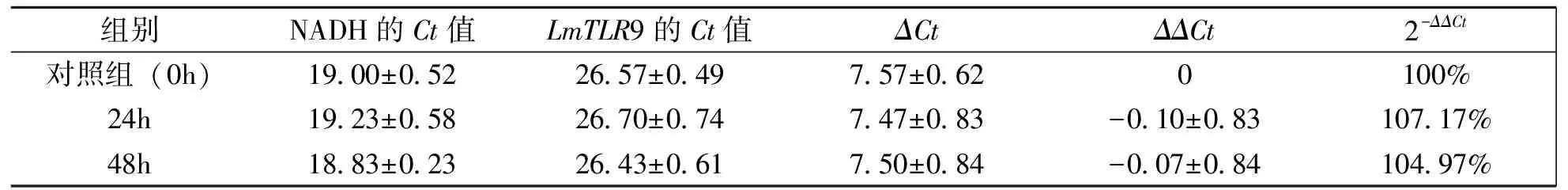
表1 东亚飞蝗TLR9基因的表达情况
3 讨论
生物农药是未来农药发展的趋势,蝗虫的免疫防御反应极大地延缓了目前使用的微生物杀虫剂的杀虫效率,因此,研究蝗虫免疫应答机制,找到免疫应答过程中的关键因子并以此为靶标,筛选对这个关键因子有抑制、阻断等功能的基因,对于高效杀虫生物的筛选、改良和设计具有十分重要的应用价值。金龟子绿僵菌(Metarhiziumanisopliae) 是一类应用广泛的昆虫病原真菌,在蝗虫防治中起着重要。在昆虫中,对PAMPs的识别是由Toll受体介导的[3]。目前已发现的TLR家族成员至少有10种,均参与机体的固有免疫反应。有研究表明,TLRs中以TLR2、TLR4和TLR9在抗真菌感染免疫的作用最为重要[11-14],例如,TLR2和TLR4可识别白念珠菌和烟曲菌,TLR9也可识别烟曲菌。
本研究采用RACE等手段,分离出了东亚飞蝗TLR9基因cDNA 序列,NCBI的GenBank 登录号为JQ910652(cDNA序列)。将LmTLR9 cDNA 序列用NCBI Blastn 工具与数据库进行比对,除其TIR部位,其他序列同源性很低。目前昆虫TLR9的氨基酸序列已在果蝇和蚊子中被分离鉴定出来,东亚飞蝗TLR9推导氨基酸序列与上述昆虫蛋白氨基酸序列同源性变动在19%~26% 之间,同源性主要表现在受体同源区(TIR)。蛋白分子结构预测结果表明,LmTLR9是跨膜蛋白,胞外区具有LRR结构域,胞内区具有TIR结构域,表现出典型的TLR家族结构特征,表明东亚飞蝗TLR9分子具有病原分子模式识别和信号传导的作用。本研究验证了TLR9在正常东亚飞蝗中肠组织中有表达,推测这可能与中肠内存在大量的肠道微生物菌群有关。在侵染绿僵菌24h和48h,LmTLR9 mRNA表达量没有显著变化,现已明了TLR9主要识别细菌的CpG,它是细菌DNA中以未甲基化的CpG二核苷酸为核心的特定寡核苷酸序列。笔者分析TLR9可能未能识别绿僵菌的CpG,因此没有参与绿僵菌入侵的信号转导。目前东亚飞蝗其他的TLRs仍未见报道。可以相信,随着对东亚飞蝗TLRs的研究逐渐深入,一定能对蝗虫的防治提供详尽理论基础和技术储备。
[1]Zheng L,Zhang L,Lin H.Toll-like receptors in invertebrate innate immunity[J].Journal of Invertebrate Survival,2005,2:105-113.
[2]Hetru C,Troxler L,Hoffmann J A.Drosophilamelanogasterantimicrobial defense [J].J Infect Dis,2003,187:327-334.
[3]Kawai A S.The role of pattern-recognition receptors in innate immunity:update on Toll-like receptors [J].Nature Immunology,2010,11:374-384.
[4]Luna C,Wang X L,Huang Y M,et al .Characterization of four Toll related genes during development and immune responses inAnophelesgambiae[J].Insect Biochemistry and Molecular Biology,2002,32:1171-1179.
[5]Christophides G K,Zdobnov E,Barillas-mury C,et al .Immunity-related genes and gene families inAnophelesgambiae[J ].Science,2002,298:159-165.
[6]Evans J D,Aronstein K,Imler J L.Immune Pathways and Defence Mechanisms in Honey BeesApismellifera[ J]. Insect Molecular Biology,2006,15:645-656.
[7]Cheng T C,Zhang Y C,Liu C,et al .Identification and analysis of Toll-related genes in the domesticated silkworm,Bombyxmori[J].Developmental and Comparative Immunology,2008,32:464-475.
[8]黎群英,夏玉先.东亚飞蝗Toll9受体基因及组织定位[J].西南大学学报,2008,(12):91-96.
[9]Liu Y C,Wang Z K,Yin Y P,et al.Expression,purification,and characterization of recombinantMetarhiziumanisopliaeacid trehalase inPichiapastoris[J].Protein expression and purification,2007,54:66-72.
[10]Gillespie J P,Burnett C,Chamley A K.The immune response of the desert locustSchistocercagregariaduring mycosis of the entomopathogenic fungus,Metarhiziumflavoviride.[J].Insect Physiol,2000,46:429-437.
[11]Blanco J L,Garcia M E.Immune response to fungal infections[J].Vet Immunol Immunopathol,2008,9:47-70.
[12]Netea M G,Ferwerda G,Van der Graaf,C A A,et al.Recognition of fungal pathogens by Toll-like receptors[J].Curr Pharm Des,2006,12:4195-4201.
[13]Meier A,Kirschning C J,Nikolaus T,et al.Toll-like receptor (TLR) and TLR4 are essential forAspergillusinduced activation of murine macrophages[J].Cell Microbiol.,2003,5:569-570.
[14]Nakamura K,Miyazato A,Xiao G,et al.Deoxynucleic acids fromCryptococcusneoformansactivate myeloid dendritic cells via a TLR9-dependent pathway[J].J Immunol,2008,180:4067-4074.
Q78
A
1673-1409(2012)06-S018-04
2012-06-10
福建省自然科学基金项目(2009J05068);福建医科大学博士启动基金项目(2009BS002)
刘迎春(1974-),女,福建福鼎人,博士,副教授,研究方向为生物医学工程。
10.3969/j.issn.1673-1409(S).2012.06.005
