姜黄素对IL-1β体外诱导兔关节软骨细胞分泌IL-8、sICAM-1和NO、PGE2的影响
2012-11-17刘巍朱雪松朱新辉逸弘杨惠林
刘巍 朱雪松 朱新辉 逸弘 杨惠林
1 南通市第一人民医院(南通226001) 2 苏州大学骨科研究所
骨关节炎(Osteoarthritis,OA)的病因与发病机制复杂,至今尚未完全阐明。合成性细胞因子和损伤(分解)性细胞因子在OA发病、治疗中的作用日益受到重视[1]。 白介素 1β(IL-1β)既是 OA 滑膜分泌的主要炎症因子,又是损害软骨细胞、促进关节软骨退变的重要因素[2]。IL-1β是引起OA症状和体征的主要因素之一,是OA病理生理过程的中心环节。它可以诱导软骨细胞产生MCP-1、IL-8、sICAM-1等细胞因子,致使炎性细胞游走、移行至损伤部位,并黏附、聚集导致炎症反应扩散[3、4]。 其中 IL-8是嗜中性粒细胞的重要趋化剂和活化剂,sICAM-1是主要的细胞粘附分子,二者都与早期炎症反应密切相关。
一氧化氮(NO)和前列腺素(PGE2)作为关节损伤和基质合成抑制的介质,在类风湿关节炎(RA)、OA和炎症性关节炎(IA)发病中的作用日益受到重视。OA患者血清和关节滑液中NO、PGE2含量显著升高[5]。一氧化氮合酶抑制剂在关节炎动物模型中能显著改变关节破坏的过程[6]。IL-1β在体外刺激软骨细胞能产生大量 NO、PGE2[7]。 目前认为,抑制 NO、PGE2途径是OA治疗的一种潜在的、重要的途径。
姜黄素(二阿魏酰基甲烷,curcumin)是从姜黄属中药姜黄、郁金、莪术、菖蒲等的根茎中提取的一种橙黄色酚性化合物,为姜黄属植物主要活性成分之一,具有破血行气、散风活血、通经止痛等多种功效。由于其毒性较低(小鼠灌胃的 LD50>2 g·kg-1)[8],临床广泛应用于慢性溃疡和疱疹、前列腺肥大、高血脂等疾病的治疗。近年研究发现,姜黄素具有强大的抗炎、抗氧化作用,能够抑制多种细胞分泌多种炎症因子[9,10]。为了探讨姜黄素在保护软骨和治疗骨关节炎的可能性,本实验观察了姜黄素抑制IL-1β刺激兔软骨细胞分泌促炎症因子IL-8、sICAM-1和NO、PGE2的作用。
1 材料和方法
1.1 主要试剂
IL-1β、盐酸萘乙二胺、Ⅱ型胶原酶、胰蛋白酶、透明质酸酶为Sigma公司产品。DMEM培养液、Ham F-12培养液为Gibco公司产品。磺胺购于上海化学试剂站。新生小牛血清(FBS)系杭州四季青生物工程材料研究所生产。人IL-8、sICAM-1 ELISA试剂盒(R&D Systems,晶美公司分装),BSA(华美生物工程公司),PGE2ELISA单克隆试剂盒购自美国R&D Systems化学公司;NO试剂盒购自南京建成生物工程研究所第一分所;考马斯亮蓝G-250(Fluka)、全自动酶标仪(Bio-Rad model 1450,USA)微量高速制冷离心机(Beckman,USA)、紫外分光光度计(Beckman,USA)。
常用药物的配制、贮存及使用方法:rhIL-1β制成200 μg/L浓度溶液,分装后-20℃保存,用前稀释,使用浓度为 10 μg/L。 姜黄素(Alexis Biochemicals,Switzerland), 纯度>99%。 2 mg 溶于 100 μl DMSO中后用无菌DMEM/F12培养液稀释成200 mg/L,避光4℃保存。
1.2 方法
1.2.1 软骨细胞分离培养
本实验在南通市人民医院中心实验室完成。取6~8周的新西兰兔,敲头处死,截取肩、肘和髋关节,用15号解剖刀削下胫骨近端、股骨远端及近端、肱骨近端关节表面软骨,用0.05%透明质酸酶常温消化3 min。将软骨切成约1 mm×1 mm×1 mm小块,移入酶消化瓶内室,37℃、100 r/min磁力搅拌下,依次用 0.2%胰酶30 min,0.15%胶原酶 60 min两次消化,1500 r/min离心5 min,收集细胞,放入含10%小牛血清的Ham F-12培养液中,在37℃、5%CO2的孵箱中培养,3 d后换液,以后隔日换液。待细胞长成单层后,加0.15%胰蛋白酶消化5~10 min,待细胞间隙变大,加DMEM培养液和PBS吹打,使细胞分散均匀,每1瓶再分配到3瓶中,用含10%FBS的DMEM培养液培养,每3 d换液1次。
1.2.2 试验分组
①IL-1β 诱导组:只加入 rhIL-1β(10 μg/L);②低剂量姜黄素组:加入 rhIL-1β(10 μg/L)和姜黄素(5 mg/L);③中剂量姜黄素组:加入 rhIL-1β(10 μg/L)和姜黄素(10 mg/L);④高剂量姜黄素组:加入rhIL-1β(10 μg/L)和姜黄素(20 mg/L);⑤空白对照组:4 ml/L FBS,DMEM/F-12;⑥姜黄素对照组:只加入10 mg/L姜黄素。每组设3个复孔,每组均重复3次。作用时间为24 h。
1.2.3 IL-8和sICAM-1产生和测定
干预结束时收集培养上清,测定IL-8和sICAM-1含量。将24孔板内细胞裂解后收集测定蛋白含量,按试剂盒说明书测定IL-8和sICAM-1含量。采用Bradford法测定细胞裂解液蛋白含量。IL-8和sICAM-1含量用每孔上清中的蛋白含量与相应细胞蛋白含量之比(ng/g)表示。
1.2.4 NO、PGE2产生和测定
干预结束时收集培养上清,测定NO、PGE2含量。
采用硝酸还原酶法测定NO吸光度值,在550 nm和0.5 cm光径下,紫外线分光光度计上测各管吸光度值。计算公式为NO(μmol/L)=(测定管吸光度值-空白管吸光度值)/(标准管吸光度值 -空白管吸光度值)×标准品浓度×样品测试前稀释倍数。
按照美国R&D Systems化学公司提供的PGE2ELISA单克隆试剂盒说明书的操作步骤测定PGE2吸光度值。在全自动定量绘图酶标仪450 nm处30 min内读取OD值。根据标准品求出标准方程,然后计算各组PGE2含量。
1.3 统计学分析
所有数据均用SPSS 11.0统计软件进行分析。数据以平均值±标准差(±s)表示,进行t检验和方差分析(LSD法),显著性检验水平为P<0.05。
2 结果
2.1 软骨细胞上清液IL-8、sICAM-1含量
IL-1β诱导组上清液IL-8含量是空白对照组的20倍(P<0.01)。与IL-1β诱导组比较,低剂量姜黄素组IL-8含量降低了32.09%(P<0.01),中剂量姜黄素组降低了40.01%(P<0.01),高剂量姜黄素组降低了47.92%(P<0.01)。姜黄素对照组与空白对照组比较无显著性差异(P>0.05)。
IL-1β诱导组上清液sICAM-1含量是空白对照组的11倍(P<0.01)。与IL-1β诱导组比较,低剂量姜黄素组sICAM-1含量降低了13.99%(P<0.01),中剂量姜黄素组降低了25.06%(P<0.01),高剂量姜黄素组降低了32.90%(P<0.01)。姜黄素对照组与空白对照组比较无显著性差异(P>0.05)。
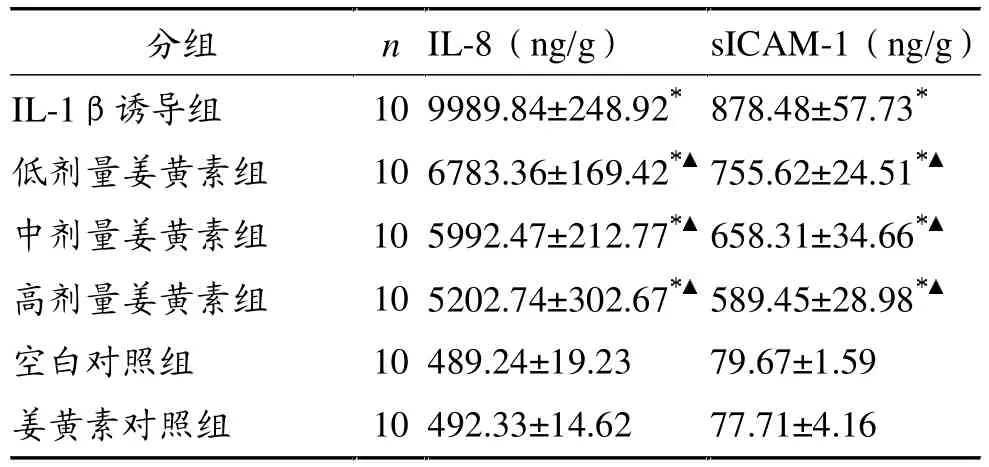
表1 各组兔软骨细胞上清液IL-8、sICAM-1含量比较
2.2 软骨细胞上清液NO及PGE2含量
IL-1β诱导组上清液NO含量是空白对照组的6倍(P<0.01)。与IL-1β诱导组比较,低剂量姜黄素组NO含量降低了20.59%(P<0.01),中剂量姜黄素组降低了35.84%(P<0.01),高剂量姜黄素组降低了52.90%(P<0.01)。姜黄素对照组与空白对照组比较无显著性差异(P>0.05)。
IL-1β诱导组上清中PGE2含量是空白对照组的13倍(P<0.01)。与IL-1β诱导组比较,低剂量姜黄素组PGE2含量降低了27.20%(P<0.01),中剂量姜黄素组降低了53.31%(P<0.01),高剂量姜黄素组降低了72.95%(P<0.01)。姜黄素对照组与空白对照组比较无显著性差异(P>0.05)。
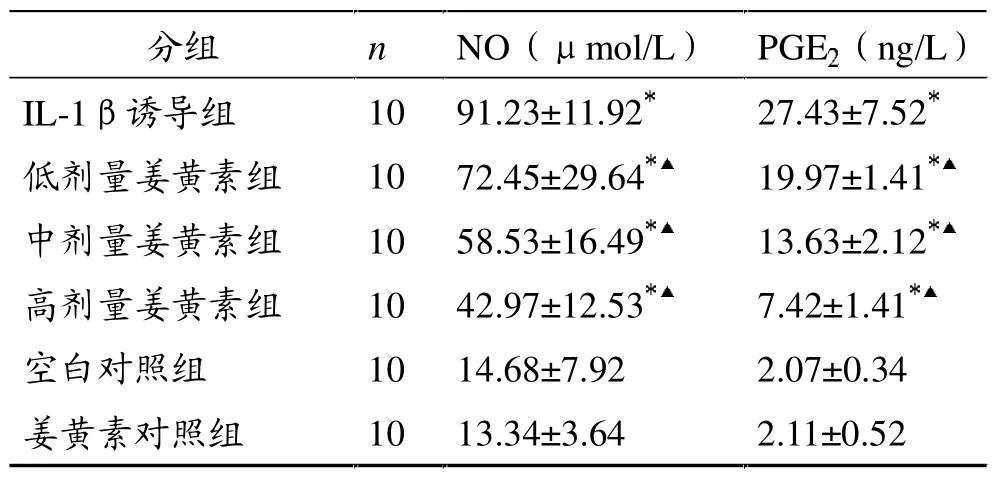
表2 各组兔软骨细胞上清NO及PGE2含量比较
3 讨论
细胞因子学说已经证实[3],IL-1β 在 OA 关节病变中是发挥主要作用的细胞因子,在成年健康人关节软骨中很少出现IL-1β,发生OA时,滑膜单个核细胞、软骨细胞受到一定刺激而产生IL-1β,激活并释放软骨中的IL-8、ICAM-1、前纤维蛋白溶酶。有研究表明IL-8和ICAM-1是OA炎症期的重要细胞因子[3,4,11]。本实验中,未受 IL-1β 刺激的兔软骨细胞分泌 IL-8和 sICAM-1的量极低,10 μg/L浓度的IL-1β使兔软骨细胞分泌的IL-8和sICAM-1分别比未受刺激兔软骨细胞增加了20倍和11倍。
姜黄素是传统的抗炎药物姜黄的主要药效成分,因为其确切的抗肿瘤和抗炎效果,近几十年得到广泛关注和研究。研究表明[12],姜黄素对OA软骨细胞有一定的保护功能,可以抑制由软骨细胞产生的多种促炎症因子和分解代谢相关的因子,如Cox-2、TNF-a、MMP-13 等。 Shakibaei等[13]报道,姜黄素能抑制由IL-1诱导的整合素的显著表达,还可抑制IL-1β诱导的软骨细胞凋亡,其机制均与姜黄素能有效地抑制MAPK信号途径和NF-κB的活化有关。
本实验发现,姜黄素有效抑制了IL-1β诱导兔软骨细胞产生IL-8和sICAM-1。5 mg/L浓度的姜黄素使IL-8含量降低了32.09%,10 mg/L浓度达到40.01%,20 mg/L浓度则达到47.92%。5 mg/L浓度的姜黄素使sICAM-1含量降低了13.99%,10 mg/L浓度达到25.06%,20 mg/L浓度则达到32.90%,姜黄素对sICAM-1的抑制似乎弱于IL-8,可能与其本身分泌量小差异不显著有关。实验中对每孔细胞都进行了蛋白定量,对培养上清的IL-8和sICAM-1含量进行了标化,排除了因细胞量不同造成的差异。
炎症部位诱导的IL-8和sICAM-1表达是调节细胞粘附和炎症反应的重要途径,如果下调两者的表达或抑制细胞因子诱导二者表达,那么炎症反应也将减弱。由于IL-8和sICAM-1在兔软骨细胞的构成性表达浓度较低,只有炎性细胞因子如IL-1β等能诱导它们大量产生[3、4],那么抑制这个途径就可能抑制持续存在的炎症反应。
IL-1β同时诱导体外培养兔软骨细胞产生大量NO和PGE2,其在较低浓度级就能诱导NO和PGE2产生。由于关节炎症性疾病以软骨破坏为主要特征,而软骨破坏与细胞因子(主要是IL-1β)密切相关。因此,寻找有效抑制IL-1β诱导NO和PGE2产生的药物具有十分重要的意义。关于姜黄素在软骨细胞修复过程中以及在对抗IL-1β的损害过程中对NO和PGE2影响的文献报道较少。本实验结果表明,IL-1β可明显增加软骨细胞培养液NO和PGE2的含量,分别增加了6倍和13倍;姜黄素能降低IL-1β引起的软骨细胞培养液NO和PGE2的升高;5 mg/L浓度的姜黄素使NO含量降低了20.59%,10 mg/L浓度达到 35.84%,20 mg/L浓度则达到 52.90%;5 mg/L浓度的姜黄素使PGE2含量降低了27.20%,10 mg/L浓度达到53.31%,20 mg/L浓度则达到72.95%。
本实验结果表明,姜黄素能够剂量依赖性地抑制IL-1β诱导兔软骨细胞产生 IL-8、sICAM-1和NO、PGE2,姜黄素对软骨细胞具有一定的保护功能,这种抑制作用的机制还有待进一步探讨。
[l]Oliviero F,Sfriso P,Baldo G,et al.Apolipoprotein A-I and cholesterol in synovial fluid of patients with rheumatoid arthritis,psoriatic arthritisand osteoarthritis.Clin Exp Rheumatol,2009,27(1):79-83.
[2]Goldring MB,Goldring SR.Osteoarthritis.J Cell Physiol,2007,213(3):626-634.
[3]Lawrence RC,Helmick CG,Arnett FC,et al.Estimates of the prevalence of arthritis and selected musculoskeletal disorders in the United States.Arthritis Rheum,1998,41(5):778-799.
[4]Feydy A,Pluot E,Guerini H,et al.Osteoarthlitis of the wrist and hand,and spine.Radiol Clin North Am,2009,47(4):723-759.
[5]Farrell AJ,Blake DR,Palmer RM,et al.Increased concentrations of nitrite in synovial fluid and serum samples suggest increased nitric oxide synthesis in rheumatic diseases.Ann Rheum Dis,1992 ,51(11):1219-1222.
[6]McCartney-Francis N,Allen JB,Mizel DE,et al.Suppression of arthritis by an inhibitor of nitric oxide synthase.J Exp Med,1993,178(2):749-754.
[7]Grabowski PS ,Macpherson H,Ralston SH.Nitric oxide production in cells derived from the human joint.Br J Rheumatol,1996,35(3):207-212.
[8]Brouet I,Ohshima H.Curcumin an anti-tumor promoter and anti-inflammatory agent,inhibits induction of nitric oxide synthase in activated macrophages.Biochem Biophys Res Commun,1995,206(2):533-540.
[9]Huang CD,Tliba O,Panettieri RA,et al.Bradykinin induces interleukin-6 production in human airway smooth muscle cells:modulation by Th2 cytokines and dexamethasone.Am J Respir Cell Mol Biol,2003,28(3):330-338.
[10]Literat A,Su F,Norwicki M,et al.Regulation of proinflammatory cytokine expression by curcumin in hyaline membrane disease (HMD).Life Sci,2001,70 (3):253-267.
[11]Ghasemi H,Ghazanfari T,Yaraee R,et al.Roles of IL-8 in ocular inflammations:a review.Ocul Immunol Inflamm,2011,19(6):401-412.
[12]Liaeini A,Sylvester J,Li WQ,et al.Inhibition of interleukin-1-stimulated MAP kinases,activating protein-1 (AP-l) and nuelear factor kappa B (NF-kappa B) transcription factors down-reguplates matrix metalloproteinase gene expression in artieular chondroeytes.Matrix Biol,2002,21 (3):251-362.
[13]Shakibaei M,Mobasheri A,Buhrmann C.Curcumin syner-gizes with resveratrol to stimulate the MAPK signaling pathway in human articular chondrocytes in vitro.Genes Nutr,2011,6(2):171-179.
