SIRT1与糖脂代谢及其与运动关系研究进展
2012-11-17王军力肖国强曹姣
王军力 肖国强 曹姣
1 怀化学院体育系(湖南怀化418008) 2 华南师范大学体育科学学院
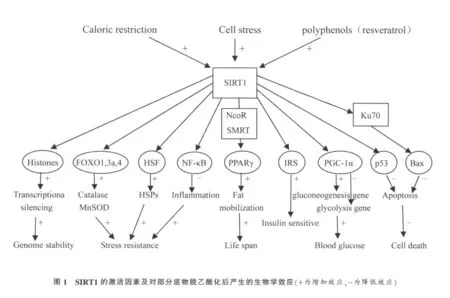
沉默信息调节因子2(silent information regulator 2,sir2)相关酶是一种烟酰胺腺嘌呤二核苷酸(NAD+)依赖的组蛋白脱乙酰化酶,其存在的广泛性(酵母、线虫、果蝇、啮齿类动物及人类等)和高度保守性[1]提示其在生命过程中扮演着重要角色。SIRT1(silent mating type information regulation 2 homolog 1),哺乳动物 sir2同系物[2],是近年研究最为热门和最为深入的哺乳动物sirtuins的家族成员。SIRT1在哺乳动物肝脏[3-5]、肌肉[6]、血管[7]、胰岛[8]、心脏[9]、脑[10]、脂肪[11]等组织中广泛表达。 限制饮食[12](Caloric restriction ,CR)、细胞应激[13]和多酚类小分子激活物[14,15](例如白藜芦醇,resveratrol) 能够诱导 SIRT1 表达或者活性升高。SIRT1激活后对组蛋白(Histones)[16]、叉头蛋白家族(forkhead box-containing protein,O subfamily,FOXO)[17,18]、热休克因子(Heat shock factor,HSF)[19]、 核 转 录 因 子 κB (nucleartranscription factor-κappaB,NF-κB)[20]、 过氧化物酶体增殖物激活受体γ(peroxisome proliferator-activated receptor γ,PPARγ)[21]、胰岛素受体底物(insulin receptor substrate ,IRS)[22,23]、 过氧化物酶体增殖物激活受体 γ辅激活子 1α(peroxisome proliferator-activated receptor γ coactivator-1α,PGC-1α)[24]、p53[25]和核蛋白Ku70[26]等底物具有强烈的脱乙酰化作用或调控转录作用,从而调节一系列生物学过程,包括基因沉默[27]、寿命调节[28]、调控细胞周期和细胞凋亡[29,30]、调节糖脂代谢[21,22]、参与炎性反应[20]和抵抗应激损伤[19,26]等(见图1)。
慢性疾病常伴随糖脂代谢异常,而SIRT1对糖脂代谢异常具有明显的改善作用。长期运动训练能够改善糖脂代谢异常,是防治慢性疾病的重要疗法之一,但其作用机理还未完全阐明。最近有研究表明运动训 练能够诱导心肌[31,32]和骨骼肌[6]SIRT1 表 达增加或者活性升高,那么运动改善糖脂代谢异常的机理是否与SIRT1有关十分值得关注。本文在总结SIRT1调节糖脂代谢重要作用的基础上,结合运动与SIRT1研究现状,展望SIRT1在运动与慢性代谢疾病关系中的研究前景,以期为运动与慢性疾病的研究提供参考。
1 SIRT1与糖代谢
1.1 SIRT1与胰岛β细胞功能
肥胖和2型糖尿病人群存在着胰岛素抵抗现象。但是,胰岛素抵抗并不是2型糖尿病发病的充分必要条件,只是2型糖尿病发病的重要诱因。如果β细胞能够代偿性分泌胰岛素弥补外周胰岛素抵抗,并不能诱发2型糖尿病,提示β细胞功能在2型糖尿病发病中的重要作用。研究发现与2型糖尿病相关的基因中大部分 (TCF7L2、KCNJ11、TCF2、SLC30A8、HHEX、CDKAL1、IGF2BP2、CDK-N2A/B和WFS1)与受损的β细胞功能有关,而仅有三种基因(FTO、MC4R和PPARG)与肥胖和胰岛素抵抗有关[33,34],强调了 β 细胞功能在 2型糖尿病发病机理中的重要作用。
1.1.1 SIRT1增加葡萄糖刺激的胰岛素分泌
胰岛β细胞在感受葡萄糖刺激的条件下,在多种调节因子的调控下分泌胰岛素。当葡萄糖经过葡萄糖载体蛋白 2(glucose transporter 2,GLUT2)进入胰岛β细胞后,通过糖酵解导致ATP/ADP比率增加,之后ATP依赖的K+通道关闭,引起细胞膜的去极化,打开电压门控Ca2+通道,内流的Ca2+触发了胰岛素的胞吐作用,导致胰岛素的分泌。SIRT1在胰岛中优势表达,而在外分泌腺中表达极少[8],提示SIRT1可能调节胰岛β细胞胰岛素分泌。通过转基因致胰岛β细胞特异性过表达SIRT1的3月龄和8月龄BESTO(β cell-specific SIRT1 overexpressing,BESTO)大鼠增加了葡萄糖刺激的胰岛素分泌 (glucose-stimulated insulin secretion,GSIS)[35], 而通过 siRNA 减少SIRT1 表达,GSIS 受到抑制[8]。SIRT1 调节 GSIS 是通过直接与解偶联蛋白 2(uncoupling protein 2,UCP2)基因启动子结合,抑制了UCP2的表达[8]。UCP2是一种线粒体内膜蛋白,能够使细胞呼吸链解耦联,导致ATP生成减少[8]。UCP2表达下降导致ATP/ADP比率增加,随后胰岛素分泌增加,增加外周组织对葡萄糖的摄取,维持糖稳态。当SIRT1表达减少时,UCP2过量表达,ATP/ADP 比率降低,抑制了 GSIS[8]。 2 型糖尿病是一种年龄依赖性的疾病,随着年龄的增加胰岛β细胞功能降低,导致GSIS分泌减少[36],这可能与胰岛β细胞SIRT1表达减少或者活性降低有关。老年BESTO大鼠(18-24月龄)由于血液烟酰胺腺嘌呤单核苷酸 (nicotinamide mononucleotide,NMN)的降低,导致胰岛β细胞NAD合成减少,最终致使SIRT1活性降低,引起GSIS减少,通过补充NMN能够恢复老年雌性BESTO大鼠葡萄糖刺激的胰岛素分泌能力[36]。进一步证实SIRT1在维持胰岛β细胞GSIS中的重要作用。
1.1.2 SIRT1脱乙酰化IRS-2维持胰岛β细胞功能
胰岛素受体底物2(IRS-2)是胰岛素受体底物家族成员之一,是胰岛素(insulin,INS)/胰岛素样生长因子(insulin-like growth factor-1,IGF-1)信号通路(INS/IGF-1-IR-IRS-PI3K-AKT)上游通路组成成分,主要分布于肝脏和胰岛β细胞中[37]。有研究表明胰岛β细胞功能失调可能是胰岛β细胞自身胰岛素抵抗造成的,而IRS-2介导的胰岛β细胞胰岛素信号通路在维持胰岛β细胞功能中有重要作用[38]。敲除小鼠胰岛β细胞IRS-2基因,会导致胰岛素分泌减少,小鼠出现糖耐量异常、外周胰岛素抵抗和血糖升高等2型糖尿病特征[39]。IRS-2接受上游信号刺激后,发生酪氨酸的磷酸化,进一步将信息传至下游信号分子,发挥胰岛素的生理学作用。基础状态下,IRS-2处于高度的乙酰化状态,胰岛素处理后能导致乙酰化状态水平下降,继而发生酪氨酸的磷酸化[22],IRS-2脱乙酰化对于IRS-2酪氨酸磷酸化是必需的,IRS-2赖氨酸残基脱乙酰化导致正电荷的暴露可能对胰岛素诱导酪氨酸的磷酸化起着重要作用[22]。在细胞培养条件下,SIRT1参与了胰岛素诱导的IRS-2脱乙酰化作用,与SIRT1表达正常的细胞比较,处于低水平SIRT1的细胞,IRS-2乙酰化水平增加,而胰岛素诱导的IRS-2的脱乙酰化水平降低,同时伴随着酪氨酸磷酸化的水平降低,导致胰岛素信号通路障碍,发生胰岛β细胞胰岛素抵抗[22]。
1.2 SIRT1与INS/IGF-1信号通路
INS/IGF-1信号通路是参与糖代谢的重要通路之一。胰岛素与受体结合后,受体发生自身的磷酸化激活胰岛素信号通路,随后IRS、PI3K、AKT依次发生磷酸化,发挥胰岛素的生理学功能。最近研究[40]发现,在胰岛素抵抗状态下,SIRT1水平降低,SIRT1活性抑制或者表达量降低诱导胰岛素抵抗,SIRT1过表达增加胰岛素敏感性,说明SIRT1与胰岛素信号通路之间有着紧密的联系。除上述提到SIRT1对IRS-2酪氨酸的磷酸化有非常重要的调节作用外,SIRT1 对胰岛素受体(insulin receptor,IR)磷酸化[41]和IRS-1磷酸化[23]也起到关键的调节作用。
1.2.1 SIRT1对PTP1B的影响
蛋白酪氨酸磷脂酶1B(protein tyrosine phosphatase 1B,PTP1B)是体内广泛表达的胰岛素受体磷脂酶,通过去磷酸化逆转蛋白酪氨酸激酶对IR和IRS磷酸化作用,是众所周知的胰岛素作用的负性调节子[41]。 Sun 等[40]研究表明 SIRT1 通过抑制 PTP1B 基因的表达直接调节胰岛素的作用。在胰岛素抵抗的状态下,C2C12细胞SIRT1过表达能够显著抑制PTP1B-mRNA和PTP1B蛋白的表达。在体研究也发现,大鼠在禁食的条件下肝脏SIRT1水平明显上升,恢复饮食后其水平恢复至正常水平[40]。同时,禁食的条件下PTP1B蛋白的活性明显下降,恢复饮食后其活性又重新恢复。进一步研究[40]表明SIRT1是在染色质水平抑制了PTP1B-mRNA的转录,导致PTB1B蛋白水平降低。值得注意的是SIRT1在非胰岛素抵抗的细胞中过度表达并不影响胰岛素信号传导和葡萄糖转运,也不显著影响PTP1B蛋白的表达,提示在胰岛素敏感状态下,SIRT1对PTP1B蛋白表达的影响较小。
1.2.2 SIRT1对IRS-1酪氨酸磷酸化的影响
利用RNA干涉敲除3T3-L1脂肪细胞SIRT1,抑制了葡萄糖载体蛋白 4(glucose transporter 4,GLUT4)细胞内转位和胰岛素刺激的葡萄糖的摄取,伴随着IRS-1的307位丝氨酸磷酸化的增加[23]。IRS-1丝氨酸/苏氨酸磷酸化是IRS信号的负性调节因子。IRS-1的307位丝氨酸磷酸化的增加导致IRS-1酪氨酸磷酸化和下游通路AKT磷酸化水平下降[23]。 利用 SIRT1 激活剂(SRT2530和 SRT1720)处理3T3-L1细胞会降低IRS-1的307位丝氨酸磷酸化的水平,而IRS-1和AKT酪氨酸磷酸化水平增加,改善了胰岛素的敏感性[23]。
1.3 SIRT1与肝脏葡萄糖代谢
肝脏通过对糖异生和糖酵解的调节有效地维持了葡萄糖稳态。在禁食期间,肝糖原分解和糖异生增加,而糖酵解受到抑制[42]。 Erion 等研究[42]表明在禁食的情况下,肝脏SIRT1过表达,其通过对PGC-1α、FOXO1和信号传感转录活化子3(signal transducer and activator of transcription3,STAT3) 脱乙酰化参与了糖异生调节,增加了糖异生基因的表达(磷酸稀醇式丙酮酸羧激酶PEPCK、果糖1,6二磷酸酯酶FBPase和6磷酸葡萄糖磷酸酶G6Pase),同时抑制了糖酵解基因的表达。采用反义寡核苷酸(antisense oligonucleotide,ASO) 方法敲除肝脏 SIRT1,降低肝脏糖异生,伴随血液葡萄糖水平降低[42]。进一步研究发现,参与糖异生的关键转录因子STAT3乙酰化和磷酸化水平升高,阻止其进入细胞核参与基因转录,导致糖异生关键酶PEBCK mRNA、FBPase mRNA和G6Pase mRNA降低[42]。这些研究表明肝脏SIRT1敲除会导致肝脏胰岛素敏感性增加。在肝脏中SIRT1正性调节肝 X 受体 α(liver X receptor α,LXR-α)的功能,通过对LXR-α脱乙酰化控制了胆固醇代谢,改善了葡萄糖耐量和胰岛素的敏感性[43,44],但是 SIRT1 是否是通过激活LXR-α增强了胰岛素的敏感性尚不清楚。最近Milne等[45]对Zucker fa/fa大鼠进行研究表明SIRT1的激活改善了全身胰岛素的敏感性和肝脏胰岛素应答,与上述研究似乎存在矛盾,需要进一步研究证实SIRT1对肝脏胰岛素敏感性的调节。
2 SIRT1与脂代谢
2.1 SIRT1对白色脂肪组织的影响
PPARγ是调节脂肪合成的关键因子。一方面在调节前脂肪细胞转化为成熟脂肪细胞中发挥着必不可少的作用[46],同时在成熟的脂肪细胞中,PPARγ通过诱导参与游离脂肪酸摄取基因和甘油三酯合成基因的表达,增加了白色脂肪组织 (white adipose tissue,WAT)对脂肪的储存能力[46]。 在 PPARγ 缺失的情况下,祖干细胞不能表现出任何脂肪细胞的特征[47]。在大鼠的成纤维细胞中,PPARγ是促进生脂程序非常重要的转录调节因子,既促进了WAT的形成也参与了棕色脂肪组织 (brown adipose tissue,BAT)的形成[48]。在脂肪组织形成过程中CCAT增强子结合蛋 白 (CCAT/enhancer-binding protein α,C/EBPα)同样发挥重要的作用[49],但是在 PPARγ 缺失的情况下,C/EBPα不能发动脂肪的形成。研究显示PPARγ是SIRT1重要的作用底物[21]。禁食的条件下,脂肪组织中SIRT1表达升高[50],其通过与核受体共抑制子(nuclear receptor corepressor,NCOR)和维甲酸/甲状腺素沉默调节子 (Silencing Medtiator for Retinoic Acid and Thyroid Hormone Receptor,SMRT) 相互作用,抑制了PPARγ的表达,进而下调了脂肪酸结合蛋白(adipocyte fatty acid binding protein 2,aP2)的表达[21]。 Baur等[51]用白藜芦醇(SIRT1 的激活剂)干预高脂饮食喂养的大鼠,结果表明大鼠体重增加减慢。这些研究显示SIRT1能够抑制脂肪生成,加速脂肪分解。
2.2 SIRT1对棕色脂肪组织的影响
SIRT1对棕色脂肪组织的作用尚不清楚。Timmons等[52]研究显示SIRT1可能通过抑制成肌分化抗原(myoblast determination protein,Myod)调节的肌源性基因的表达和诱导PGC-1α调节的线粒体基因的表达促进棕色脂肪组织的分化。最近在对雌性大鼠研究中发现,表达阿黑皮素(Pro-opiomelanocortin,POMC)的神经元选择性地调控生殖腺周围白色脂肪组织向棕色脂肪组织转化,增加了能量消耗[53]。特异性敲除POMC神经元的SIRT1,会由于能量消耗减少,非常敏感地引起饮食诱导的肥胖发生[53]。同时有研究表明SIRT1激活后,能够增加骨骼肌、肝脏和棕色脂肪组织的有氧代谢[54]。总之,这些研究发现SIRT1可以通过细胞自治 (cell autonomous)和非细胞自治(non-cell autonomous)的方式对BAT分化和功能进行调控。
3 SIRT1与运动
3.1 SIRT1与运动研究现状
目前国内外关于运动与SIRT1研究较少。Masataka等[6]研究SIRT1在骨骼肌中的分布和急性运动、耐力训练对骨骼肌SIRT1表达和骨骼肌代谢成分的影响发现,SIRT1在慢肌纤维中优势表达,急性跑台运动(20 m/min,18.5%坡度,45 min)2 h 后比目鱼肌中SIRT1水平增加。通过14天低强度耐力训练(20 m/min,18.5%坡度,90 min/day)和高强度耐力训练(30 m/min,18.5%坡度,60 min/day)发现,两训练组比目鱼肌SIRT1表达、己糖激酶和线粒体酶的活性及GLUT4含量均增加。上述研究提示SIRT1表达增加可能在运动引起的骨骼肌代谢适应中扮演非常重要的角色。Brendon等[55]研究发现高强度的间歇训练导致人类骨骼肌SIRT1活性升高,但是蛋白表达量降低。这与Masataka等的研究似乎相矛盾,可能是由于受试对象、运动类型、运动强度和运动时间不同造成的。运动不但能够影响骨骼肌SIRT1表达或者活性,而且也能够导致其它组织SIRT1表达或活性发生变化。Ferrara等[31]研究发现24月龄老年鼠心脏SIRT1活性降低,运动训练明显提高心肌SIRT1活性,同时伴随着FOXO3a、MnSOD、过氧化氢酶(CAT)水平的增加和细胞周期蛋白D(cyclin D)水平的降低。这提示,运动训练诱导SIRT1活性的增加,能够阻止衰老相关的系统受损。Steiner等[56]研究发现雄性ICR大鼠进行8周的跑台运动(25 m/min,1 h/day,18.5%坡度,6 day/week) 诱导大部分脑区SIRT1、PGC-1α、柠檬酸合成酶 mRNA(CSmRNA)和线粒体DNA(mtDNA)明显增加,提示运动诱导脑区SIRT1表达升高对于增加线粒体的生物合成具有重要作用。由于线粒体功能失调与多种衰老相关的神经系统疾病(老年痴呆等)有关,因此运动诱导脑区SIRT1表达或者活性升高对于延缓衰老相关的疾病可能具有重要调节作用。
3.2 运动诱导SIRT1表达或活性增加的可能机制
关于运动训练诱导SIRT1活性增加或表达增加的机制尚不明确。最近两项研究[32,57]表明运动训练能够诱导骨骼肌烟酰胺核糖基转移酶(nicotinamide phosphoribosyltransferase,NAMPT)活性升高,NAMPT是NAD+合成的关键酶,这可能是运动激活SIRT1活性的原因。有研究提出NO合酶可能是运动诱导SIRT1表达增加的主要原因。在NO合酶缺失鼠中,运动不能诱导或者大幅度降低SIRT1的表达[58]。急性运动[59]和 3~4 周的游泳训练[60]能够增加 NO 合酶磷酸化水平,在体条件下电刺激能够诱导NO合酶表达及活性增加[61],这些结果提示运动训练诱导NO合酶表达或活性增加是运动训练诱导SIRT1表达增加的可能原因之一。另一项研究发现,运动训练诱导骨骼肌 AMPK 活性增加[60,62],可能是运动诱导骨骼肌SIRT1表达增加的另一原因。给大鼠补充AMPK的激活剂[6]能够显著增加跖长伸肌SIRT1表达,因此AMPK可能参与了耐力训练诱导的SIRT1表达。
4 展望
已有研究表明在2型糖尿病、非酒精性脂肪肝及动脉粥样硬化等慢性疾病中伴随着胰岛β细胞[12]、肝脏[12]和血管内皮细胞[63]SIRT1 表达降低。 通过饮食控制、小分子SIRT1激活剂、转基因诱导SIRT1过表达,能对慢性疾病起到改善作用。大量研究已表明运动训练在慢性疾病的防治中发挥着重要作用。运动可 以 提高肌肉[6]和心脏[31,32]SIRT1的表达和活性,提示运动改善慢性疾病可能与SIRT1活性或表达增加有关。因此笔者认为今后可以在以下几个方面进行研究:(1)运动训练改善2型糖尿病糖代谢异常SIRT1的机制研究。通过观察运动训练对2型糖尿病大鼠胰岛β细胞SIRT1表达和胰岛β细胞凋亡的关系,及胰岛β细胞SIRT1表达与β细胞功能的关系 (例如葡萄糖刺激的胰岛β胰岛素分泌),观察运动训练对肌肉组织SIRT1表达与INS/IGF-1信号通路的关系,探讨运动训练改善2型糖尿病糖代谢异常的机理。同时,也可以在细胞培养的条件下通过电刺激引起细胞收缩模拟运动,观察是否能诱导SIRT1表达,如果能够实现则探讨与INS/IGF-1信号通路的关系。(2)运动训练改善非酒精性脂肪肝SIRT1机制研究。通过观察运动训练对肝脏SIRT1的表达和肝脏Mn-SOD和Nrf1(nuclear factor-eryth roid 2 p45 subunit-related factor 1)等抗氧化剂及反映炎性的NF-κB、IL-6和TNF-α的关系,同时结合肝脏形态学的变化,探讨运动训练改善非酒精性脂肪肝的SIRT1机理。(3)运动训练改善动脉粥样硬化的SIRT1机制研究。通过观察运动训练对动脉内皮SIRT1表达的影响及反映动脉血管内皮功能的NO、eNOS的变化,同时结合形态学的变化,探讨运动训练改善动脉粥样硬化的SIRT1的机制。(4)控制饮食(CR)和一些小分子激活剂(例如 resveratrol、SRT2530、SRT1720、SRT501 等) 能够激活 SIRT1 活性,在运动训练过程中同时给予动物这些小分子激活剂或者控制饮食,探讨二者共同作用对SIRT1表达和慢性疾病的改善作用。
5 小结
SIRT1和运动与糖脂代谢有着千丝万缕的联系,SIRT1过表达和活性升高与运动对2型糖尿病、非酒精性脂肪肝、脂代谢异常和动脉粥样硬化等慢性疾病都能起到明显的改善作用。因此运动诱导SIRT1表达或活性增加可能参与改善慢性疾病调控 。 CR和小分子激活剂 (resveratrol、SRT2530、SRT1720、SRT501等)能有效地激活SIRT1活性和促进SIRT1表达。因此,SIRT1可能成为医学和运动医学领域防治慢性疾病的一个新的有效治疗靶标。
[1]Chakrabarty SP,Ramapanicker R,Mishra R,et al.Development and characterization of lysine based tripeptide analogues as inhibitors of Sir2 activity.Bioorg Med Chem,2009,17(23):8060-8072.
[2]Cheng HL,Mostoslavsky R,Saito S,et al.Developmental defects and p53 hyperacetylation in sir2 homology(SIRT1)– deficientmice.Developmental Biology,2003,100 (19):10794-10799.
[3]Rodgers JT,Lerin C,Haas W,et al.Nutrient control of glucose homeostasis through a complex of PGC-1α and SIRT1.Nature,2005,434(7029):113-118.
[4]Rodgers JT,Puigserver P.Fasting-dependent glucose and lipid metabolic response through hepatic sirtuin1.Proc Natl Acad Sci USA,2007,104(31):12861-12866.
[5]Frescas D,Valenti L,Accili D.Nuclear trapping of the forkhead transcription factor FoxO1 via Sirt-dependent deacetylation promotesexpression of glucogenetic genes.J Biol Chem,2005,280(21):20589-20595.
[6]Suwa M,Nakano H,Radak Z,et al.Endurance exercise increases the SIRT1 and peroxisome proliferator-activated receptor γ coactivator-1α protein expressions in rat skeletal muscle.Clinical and Experiment,2008,57(7):986-998.
[7]Balestrieri ML,Rienzo M,Felice F,et al.High glucose downregulates endothelialprogenitorcellnumbervia SIRT1.Biochimicaet Biophysica Acta,2008,1784 (6):936-945.
[8]Bordone L,Motta MC,Picard F,et al.Sirt1 regulates insulin secretionby repressing UCP2 in pancreatic β cells.Plos Biology,2006,4(2):210-220.
[9]Makino N,Maeda T,Oyama JI,et al.Improving insulin sensitivity via activation of PPAR-increases telomerase activity.Am J PhysiolHeartCirc Physiol,2009,297 (6):H2188-H2195.
[10]Michán S,Li Y,Chou MM,et al.SIRT1 is essential for normal cognitive function and synaptic plasticity.J Neu-rosc,2010,30(29):9695-9707.
[11]Qiao L,Shao J.SIRT1 regulates adiponectin gene expression through Foxo1-C/enha-ncer–binding protein alpha transcriptional complex.Biol Chem,2006,281(52): 39915-39924.
[12]邓向群.SIRT1表达对大鼠胰岛β细胞凋亡及非酒精性脂肪肝形成的影响.武汉:华中科技大学博士学位论文,2007.
[13]Sedding D,Haendeler J.Do We Age On Sirt1 Expression?Circ Res,2007,100(10): 1512-1521.
[14]Yong J,Kong X,Martins Santos ME,et al.Activation of SIRT1 by resveratrol represses transcription of the gene for the cytosolic form of phosphoenolpyruvate carboxykinase(GTP) by deacetylating hepatic nuclear factor 4alpha.J Biol Chem,2009,284(40):27042-27053.
[15]Smith JJ,Kenney RD,Gagne DJ,et al.Small molecule activators of SIRT1 replicate signaling pathways triggered by calorie restriction in vivo.BMC Systems Biology,3:31.doi:10.1186/1752-0509-3-31.
[16]Frye RA.Characterization of five human cDNAs with homology to the yeast SIR2 gene:Sir2-like proteins (sirtuins)metabolize NAD and may have protein ADP-ribosyltransferase activity.Biochem BiophysResCommun,1999,260(1):273-279.
[17]Giannakou ME,Partridge L.The interaction between FOXO and SIRT1:tipping the balance towards survival.Trends Cell Biol,2004,14(8):408-412.
[18]Motta MC,Divecha N,Lemieux M,et al.Mammalian SIRT1 represses forkhead transcription factors.Cell,2004,116(4):551-563.
[19]Laura R,Saunders,Eric Verdin.Stress response and aging.Science,2009,323(20):1021-1022.
[20]Junq YJ,Lee JE,Lee AS,et al.SIRT1 overexpression decreases cisplatin-induced acetylation of NF-κB p65 subunit and cytotoxicity in renal proximal tubule cells.Biochem Biophys Res Commun,2012,419(2):206-210.
[21]Picand F,Kurtev M,Chung N,et al.Sirt1 promotes fat mobilization in white adipocytes by repressing PPARγ.Nature,2004,429(6993):771-776.
[22]Zhang J.The direct involvement of SirT1 in insulin-induced insulin receptor substrate-2 tyrosine phosphorylation.J Biol Chem,2007,282(47):34356-34364.
[23]Yoshizaki T,Milne JC,Imamura T,et al.SIRT1 exerts anti-inflammatory effects and improves insulin sensitivity in adipocytes.Mol Cell Biol,2009,29(5):1363-1374.
[24]Rodgers JT,Lerin C,Haas W,et al.Nutrient control of glucose homeostasis through a complex of PGC-1alpha SIRT1.Nature,2005,434(7029):113-118.
[25]Kume S,Haneda M,Kanasaki K,et al.Silent information regulator 2 (SIRT1) attenuates oxidative stress-induced mesangial cell apoptosis via p53 deacetylation.Free Radic Biol Med,2006,40(12): 2175-2182.
[26]Saunders LR,Verdin E.Sirtuins:critical regulators at the crossroads between cancer and aging.Oncogene,2007,26(37):5489–5504.
[27]Denu JM.The Sir2 family of protein deacetylases.CurrOpin Chem Biol,2005,9(5):431~440.
[28]Chua KF,Mostoslavsky R,Lombard DB,et al.Mammalian SIRT1 limits replicative lifespan in response to chronic genotoxic stress.Cell Metab,2005,2(1):67-76.
[29]Motta MC,Divecha N,Lemieux M,et al.Mammalian SIRT1 represses forkhead transcription factors.Cell,2004,116(4):551-563.
[30]Cheng HL,Mostoslavsky R,Saito S,et al.Developmental defects and p53 hyperacetylation in Sir2 homolog(SIRT1)-deficient mice.Proc Natl Acad Sci USA,2003,100(19):10794-10799.
[31]Ferrara N,Rinaldi B,Corbi G,et al.Exercise training promotes SIRT1 activity in aged rats.Rejuvenation Res,2008,11(1):139-150.
[32]Koltai E,Szabo Z,Atalay M,et al.Exercise alters SIRT1;SIRT6;NAD and NAMPT levels in skeletal muscle of aged rats.Mech Ageing Dev,2010,131(1):21-28.
[33]Florez JC.Newly identified loci highlight beta cell dysfunction as a key cause of type 2 diabetes:Where are the insulin resistance genes?Diabetologia,2008,51(7):1100-1110.
[34]Iozzo P,Beck-Nielsen H,Laakso M,et al.Independent influence of age on basal insulin secretion in nondiabetic humans.European Group for the Study of Insulin Resistance.J Clin Endocrinol Metab,1999,84(3):863-868.
[35]Moynihan KA,Grimm AA,Plueger MM,et al.Increased dosage of mammalian Sir2 in pancreatic β cells enhances glucose-stimulated insulin secretion in mice.Cell Metab,2005,2(2):105-117.
[36]Ramsey KM,Mills KF,Satoh A,et al.Age-associated loss of Sirt1-mediated enhancement of glucosestimulated insulin secretion in beta cell-specific Sirt1-overexpressing(BESTO) mice.Aging Cell,2008,7(1):78-88.
[37]Brady MJ.IRS2 takes center stage in the development of type 2 diabetes.Clin Invest,2004,114(7):886-888.
[38]Withers DJ,White M.The insulin signaling system-a common link in the pathogenesis of type 2 diabetes.Endocrinology,2000,141(6):1917-1921.
[39]Withers DJ,Burks DJ,Towery H.Disruption of IRS-2 cause type 2 diabetes in mice.Nature,1998,391(6670):900-904.
[40]Sun C,Zhang F,Ge X,et al.SIRT1 improves insulin sensitivity under insulin-resistant conditions by repressing PTP1B.Cell Metab,2007,6(4):307-319.
[41]Elchebly M,Payette P,Michaliszyn E,et al.Increased insulin sensitivity and obesity resistance in mice lacking the protein tyrosine phosphatase-1B gene.Science,1999,283(5407):1544-1548.
[42]Erion DM,Yonemitsu S,Nie Y,et al.SIRT1 knockdown in liver decreases basal hepatic glucose production and increases hepatic insulin responsiveness in diabetic rats.PNAS,2009,106(27): 11288-11293.
[43]Laffitte BA,Chao LC,Li J,et al.Activation of liver X receptor improves glucosetolerance through coordinate regulation of glucose met-abolism in liver and adipose tissue.Proc Natl Acad Sci USA,2003,100(9):5419-5424.
[44]Commerford SR,Vargas L,Dorfman SE,et al.Dissection of the insulin-sensitizing effect of liver X receptor ligands.MolEndocrinol,2007,21(12):3002-3012.
[45]Milne JC,Lambert PD,Schenk S,et al.Small molecule activators of SIRT1 as therapeutics for the treatment of type 2 diabetes.Nature,2007,450(7170):712-716.
[46]Evans RM,Barish GD,Wang YX.PPARs and the complex journey to obesity.Nat Med,2004,10(4):355-361.
[47]Farmer SR.Regulation of PPARgamma activity during adipogenesis.Obes,2005,29 (Suppl1): S13-S16.
[48]Barak Y,Nelson MC,Ong ES,et al.PPAR gamma is required for placental,cardiac,and adipose tissue development.Mol Cell,1999,4(4):585-595.
[49]Freytag SO,Paielli DL,Gilbert JD,et al.Ectopic expression of the CCAAT/enhancer-binding protein alpha promotes the adipogenic program in a variety of mouse fibroblastic cells.Genes Dev,1994,8(14):1654-1663.
[50]Kersten S,Desvergne B,Wahli W.Roles of PPARs in health and disease.Nature,2000,405(6785):421-424.
[51]Baur JA,Pearson KJ,Price NL,et al.Resveratrol improves health and survival of mice on a high-calorie diet.Nature,2006,444(7117):337–342.
[52]Timmons JA,Wennmalm K,Larsson O,et al.Myogenicgene expression signature establishes that brown and white adipocytes originate from distinct cell Lineages.Proc Natl Acad Sci USA,2007,104(11):4401-4406.
[53]Ramadori G,Fujikawa T,Fukuda M,et al.SIRT1 deacetylase in POMC neurons is required for homeostatic defenses against diet-induced obesity.Cell Metab,2010,12(1):78-87.
[54]Feige JN,Lagouge M,Canto C,et al.Specific SIRT1 activation mimics low energy levels and protects against dietinduced metabolic disorders by enhancing fat oxidation.Cell Metab,2008,8(5):347-358.
[55]Gurd BJ,Perry CG,Heigenhauser GJ,et al.High-intensity interval trainning increases SIRT1 activity in human skeletal muscle.Appl Physiol Nutr Metab,2010,35(3):350-357.
[56]Steiner JL,Murphy EA,McClellan JL,et al.Exercise training increases mitochondrial biogenesis in the brain.J Appl Physiol,2011,111(4):1066-1071.
[57]Costford SR,Bajpeyi S,Pasarica M,et al.Skeletal muscle NAMPT is induced by exercise in humans.Am J Physiol Endocrinol Metab,2010,298(1):E117-E126.
[58]Nisoli E,Tonello C,Cardile A,et al.Calorie restriction promotesmitochondrial biogenesis by inducing the expression of Enos.Science,2005,310(5746):314-317.
[59]Chen ZP,Stephens TJ,Murthy S,et al.Effect of exercise intensity on skeletal muscle AMPK signaling in humans.Diabetes,2003,52(9):2205-2212.
[60]Tatchum-Talom R,Schulz R,McNeill JR,et al.Upregulation of neuronal nitric oxide sy nthase in skeletal muscle by swim training.Am J Physiol Heart Circ Physiol,2000,279(4):H1757-1766.
[61]Reiser PJ,Kline WO,Vaghy PL.Induction of neuronal type nitric oxide synthase in skel etal muscle by chronic electrical stimulation in vivo.J Appl Physiol,1997,82(4):1250-1255.
[62]Fujii N,Hayashi T,Hirshman MF,et al.Exercise induces isoformspecific increase in 5’AMP-activated protein kinase activity in human skeletal muscle.Biochem Biophys Res Commun, 2000,273(3):1150-1155.
[63]张庆军.人SIRT1基因cDNA内皮细胞特异性转基因鼠系的建立及其对动脉粥样硬化的影响.北京:中国协和医科大学博士学位论文,2006.
