跑台运动对去卵巢大鼠肝脏GSK-3β和PPAR-γ蛋白表达的影响
2012-11-17段玉双卜淑敏杨少锋王国娇
段玉双卜淑敏杨少锋王国娇
1潍坊医学院(山东潍坊261053) 2首都体育学院
绝经女性由于卵巢功能衰退易发生肥胖,肥胖导致脂代谢紊乱,而肝脏是脂质代谢的主要场所之一。研究表明,糖原合成激酶-3β(GSK-3β)和过氧化物酶体增殖物激活受体-γ(PPAR-γ)在脂肪酸氧化及脂质代谢中起重要作用,是脂类代谢的关键调控因子[1]。相关研究表明,大鼠经过16周跑台运动后,训练组所有组织PPAR-γ表达均升高[2]。单独运动对去卵巢大鼠肝脏GSK-3β和PPAR-γ蛋白表达的影响鲜见报道。我们的前期研究表明,跑台运动显著抑制去卵巢大鼠体重和腹腔内脂肪重量增加[3],在此基础上,本研究进一步观察了中等强度跑台运动对去卵巢大鼠肝脏在Ser9位点磷酸化的GSK-3β(PGSK-3β)和PPAR-γ蛋白表达的影响,为探讨运动对去卵巢大鼠肝脂代谢影响的机制提供参考。
1 材料和方法
1.1 实验动物和分组
健康3月龄雌性SD大鼠80只,体重(230±10)g。购自并饲养于北京大学医学部实验动物科学部[实验动物生产许可证号:SCXK (京)2006-0008,使用许可证号为:SYXK(京)2006-0025]。适应饲养1周后,按体重分层后随机分为假手术组(Sham,20只)和去卵巢手术组(OVX,60只)。手术前,两组大鼠均禁食12~18h,腹腔注射水合氯醛(0.3 ml/100g)麻醉,去卵巢手术组均从背部切除双侧卵巢,假手术组不切除卵巢,只将卵巢旁与卵巢等大的脂肪组织切除。术后恢复1周,按体重分层后将去卵巢手术组大鼠又随机分为去卵巢静止 (OVX)、去卵巢运动(EX)和雌激素(E2)3 个组,每组 20 只。
1.2 运动训练和17β-雌二醇注射方案
跑台运动训练和17β-雌二醇配制及注射方案均参考我们前期研究报道[4]并适当调整。手术后第2周,去卵巢运动组大鼠在小动物跑台上开始适应训练1周,跑速从第1天的15 min、0坡度逐渐增加到第5天的45 min、坡度5°。正式运动训练方案为跑速18 m/min、时间45 min、坡度5°,每周 5次。 从手术后第2周开始,每周一、三、五上午9点,雌激素组颈部皮下注射3次17β-雌二醇,注射剂量为25 μg/kg体重。所有处理均在上午进行。每周称体重1次,根据体重调整17β-雌二醇的注射剂量。假手术组和去卵巢静止组每天只在笼中自由活动。
1.3 样品采集和处理
分别于去卵巢后7周和14周时各处死一半动物。取材前大鼠均禁食12~14h,腹腔注射10%水合氯醛(3 ml/kg)麻醉,迅速将同一部位的一块肝脏切成小块分装入Eppendof离心管后,-80℃冷冻保存以提取蛋白。
1.4 主要试剂和仪器
17β-雌二醇:Sigma公司;水合氯醛注射液:由北京大学医学部实验动物科学部提供;PPAR-γ抗体(SC-7273)和 β-actin 抗体(sc-1616R):美国 Santa Cruz公司;山羊抗兔IgG或马抗小鼠IgG/碱磷酶标记抗体:中杉金桥生物技术有限公司分装;BCIP/NBT显色浓缩液:中杉金桥生物技术有限公司分装;RIPA蛋白裂解液(P0013B):碧云天生物技术有限公司;SDS-PAGE蛋白上样缓冲液(P0015):碧云天生物技术有限公司;DSPT-202小动物跑台:杭州段氏制造厂;DYY-7C型电泳仪:北京六一仪器厂。
1.5 Western blotting 测定 GSK-3β、P-GSK-3β 和PPAR-γ蛋白表达
取200 mg肝脏在液氮中研磨成粉末,加入1 ml组织裂解液,4℃、12000 r/min 离心 30 min,取上清,留一部分检测蛋白浓度,其余蛋白样品与SDS-PAGE蛋白上样缓冲液(5×)(按照 4∶1)混匀,沸水煮 5 min,分装后-40℃保存。取蛋白样品40 μg上样,以80V电压,在10%的SDS-聚丙烯酰胺凝胶中分离约2 h后,以80V电压转移2 h。在质量分数为5%脱脂奶粉中室温封闭1 h,将PVDF膜与按说明书稀释的GSK-3β(1∶800)、P-GSK-3β(1∶800)、PPAR-γ(1∶600)或 β-actin(1∶600)一抗 4℃过夜,次日 TBST 洗 3×10 min,分别加山羊抗兔 IgG/碱磷酶标记(1∶800)或马抗小鼠 IgG/碱磷酶标记(1∶800)二抗室温孵育 2 h,TBST 洗 3×10 min,在BCIP/NBT显色液中显色至条带出现,放入水中终止显色,拍照,扫描各条带灰度值。
1.6 统计学分析
采用SPSS16.0统计软件进行分析。实验数据采用均数±标准差表示,组间比较采用One-Way ANOVA,P<0.05为差异有显著性,P<0.01为差异有极显著性。
2 结果
2.1 肝脏P-GSK-3β/GSK-3β比值
手术后第7和14周时,去卵巢静止组大鼠肝脏P-GSK-3β/GSK-3β比值显著低于假手术组 (P<0.01),去卵巢运动组和雌激素组肝脏P-GSK-3β/GSK-3β比值均显著高于去卵巢静止组(P<0.01),结果分别见图1和图2。

2.2 肝脏PPAR-γ蛋白表达
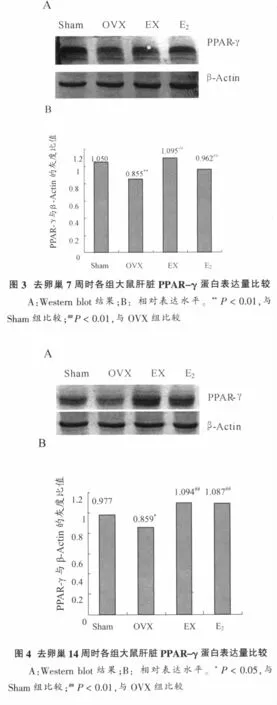
手术后第7和14周时,去卵巢静止组大鼠肝脏PPAR-γ蛋白表达量显著低于假手术组(7周时P<0.05,14周时P<0.01),而去卵巢运动组和雌激素组肝脏PPAR-γ蛋白表达量均显著高于去卵巢静止组(P <0.01),结果见图 3和图 4。
3 讨论
脂代谢紊乱是妇女绝经后面临的机体异常之一,是内源性雌激素水平下降所致[5]。肝脏是脂类代谢的重要场所,能够分泌多种酶类,参与调节脂类的消化、吸收、运输、分解代谢和合成代谢等,而GSK-3β和PPAR-γ是其中的调控因子之一。
国内外模拟临床绝经导致脂代谢紊乱常采用去卵巢大鼠模型[6]。我们前期研究表明,去卵巢7周和14周,与假手术组相比,去卵巢静止组体脂含量、肝脏TC、TG显著升高,而肝脏重量和指数未见显著变化[4],表明去卵巢大鼠在肝脏重量和指数未见明显改变的情况下,腹腔内脂肪积累,肝脏已发生脂代谢紊乱。
GSK-3β是一种多功能蛋白激酶。以往研究表明[7],GSK-3β 在 N 端 Ser9 位点发生磷酸化后,活性降低。本研究以P-GSK-3βSer9相对于总GSK-3β的比值作为判断其活性的依据。GSK-3β可抑制糖原合成及葡萄糖转运,促进糖异生,抑制胰岛素的分泌并阻碍胰岛素信号转导,从而发挥升高血糖的作用。运动对GSK-3β蛋白表达的影响研究比较晚,且大部分集中在运动通过GSK-3β调节和改善胰岛素抵抗方面。Bishop等[8]研究证实:糖尿病鼠肝脏GSK-3β mRNA是对照组的143%,且糖尿病鼠肝脏GSK-3β半衰期延长为8 h,而对照组为5 h。在培养的糖尿病肝细胞的介质中,补充胰岛素可以降低GSK-3β mRNA到接近正常水平。陈丹等[9]实验发现:大鼠运动锻炼6周后骨骼肌GSK-3β含量较胰岛素抵抗组减少27.24%,即运动能降低胰岛素抵抗大鼠骨骼肌细胞GSK-3β蛋白表达水平。但目前运动对去卵巢大鼠肝脏GSK-3β蛋白表达及磷酸化水平的影响尚不清楚。本实验中,去卵巢静止组P-GSK-3β/GSK-3β显著降低,而运动干预7周和14周后,此比值显著升高,说明运动有效抑制去卵巢大鼠肝脏GSK-3β蛋白表达和/或增加GSK-3β在N端Ser9位点磷酸化水平而降低其生理学效应,从而减轻GSK-3β对其下游靶对象的负性调节,但其机制还有待进一步研究证实。
PPAR-γ是一种核转录受体,属于PPAR家族(PPARs)。PPAR-γ除了在脂肪细胞分化中起关键作用外,还在介导脂肪酸氧化及脂质代谢中起重要作用[10],是脂类代谢的关键调控因子。运动与PPAR-γ关系的研究大部分集中在运动通过PPAR-γ来调节胰岛素抵抗、脂肪分化和抗炎症等方面。陈玉娟等[11]研究发现:8周耐力游泳运动可促进大鼠脂肪组织PPAR-γ蛋白表达量增加。冯彦景[12]研究发现,经12周游泳训练可使胰岛素抵抗小鼠肝脏PPAR-γ蛋白表达水平显著升高。在去卵巢模型中,肝脏PPAR-γ蛋白表达情况及运动对其影响鲜见报道。本实验中,去卵巢手术后第7周和14周时,大鼠肝脏PPAR-γ蛋白表达量均降低,而中等强度跑台运动和雌激素干预7周和14周均能使去卵巢大鼠肝脏PPAR-γ蛋白含量显著增加。说明运动和雌激素均能有效而稳定地上调肝脏PPAR-γ蛋白表达。运动时机体发生很多变化,包括激素反应、能量代谢和酸碱平衡等,这些可能影响PPARs家族基因在肝脏组织中的表达,而PPAR-γ能够诱导肝细胞表达载脂蛋白、脂肪酸氧化酶系与脂蛋白脂酶等,从而促进脂质的氧化代谢,降低血脂浓度;介导载脂蛋白apoA-1表达;促进脂蛋白脂肪酶合成,使乳糜微粒和极低密度脂蛋白合成减少,促进脂质代谢平衡,从而起到改善机体脂质代谢紊乱的作用。
4 小结
本实验结果表明,中等强度跑台运动上调去卵巢大鼠肝脏P-GSK-3β/GSK-3β比值及PPAR-γ蛋白表达,且效果稳定。
[1]Tanaka Y,Kaminuma T Momose H.Identification of regulation network of lipid metabolism by nuclear receptors.Genome Informatics,2003,14:362-363.
[2]Kawamura T,Yoschida K,Sugawara A,et al.Regulation of skeletal muscle peroxisome proliferator-activated receptor gamma expression by exercise and angiotensin-convertingenzyme inhibition in fructose-fed hypgertensive rats.Hypertens Res,2004,27(1):61-70.
[3]张灏,卜淑敏,朱一力,等.跑台运动对去卵巢大鼠体重、腹腔内脂肪重量以及血清瘦素和脂联素含量的影响.中国运动医学杂志,2009,9(2):175-178.
[4]段玉双,卜淑敏,杨少锋.中等强度跑台运动对去卵巢大鼠肝脏脂类水平的影响.中国运动医学杂志,2010,29(5):570-572.
[5]Schneider JG,Tompkins C,Blumenthal RS,et al.The metabolic sundrome in women.Cardiol Rev,2006,14:286-291.
[6]Bitto A,Altavilla D,Bonaiuto A,et al.Effects of aglycone genistein in a rat experimental model of postmenopausal metabolic syndrome.J Endocrinol,2009,200(3):367-376.
[7]Ferrer I,Gomez-Isla T,Puig B,et al.Current Advances on different kinases involved in tau phosphorylation,and implications in alzheimer's disease and tauopathies.Curr Alzheimer Res,2005,2(1):3-18.
[8]Bishop JR,Foley E,Lawrence R,et al.Insulin-dependent diabetes mellitus in mice does not alter liver heparan sulfate.J Biol Chem,2010,285(19):14658-14662.
[9]陈丹,毕会民.饮食、运动对胰岛素抵抗大鼠骨骼肌中GSK-3β 表达的影响.中国现代医学杂志,2009,19(22):3421-3424.
[10]Kamon J,Yamauchi T,erauchi Y,et al.The mechanisms by which PPAR gamma and adiponectin regulate glucose and lipid metabolism. Nippon Yakurigaku Zasshi,2003,122(4):294-300.
[11]陈玉娟,张海峰,何玉秀,等.8周耐力游泳运动对大鼠白色脂肪组织PPAR-γ蛋白表达及脂肪细胞增殖分化的影响.中国运动医学杂志,2007,9(26):568-579.
[12]冯彦景.游泳训练对胰岛素抵抗小鼠PPAR-γ及糖代谢的影响.湖南长沙:中南大学硕士学位论文,2010.9-10.
