模拟不同海拔高住低练对大鼠心肌VEGF和HSP70的影响
2012-11-17刘文锋汤长发印大中瞿树林龚晓明
刘文锋 汤长发 印大中 瞿树林 龚晓明
1 湖南师范大学体适能与运动康复湖南省重点实验室 (湖南长沙 410012)
2 湖南师范大学蛋白质化学与发育生物学教育部重点实验室
低氧训练是利用缺氧的特殊环境,使机体氧运输系统、神经系统及运动系统等产生多种运动性适应变化。其中,血管内皮生长因子(Vascular endothelial growth factor,VEGF)通过与血管内皮细胞表面的特异性受体结合而明显促进成纤维细胞、血管内皮细胞生长,合成和分泌胶原等细胞外基质,并能强烈促进新血管形成、毛细血管新生,是心肌在组织水平上适应低氧、维持和提高机能的重要机制之一[1]。热休克蛋白70(Heat Shock Protein 70,HSP70)是目前研究较多的一种细胞保护蛋白,环境温度升高、运动等均可诱导其表达,表达的强弱与组织细胞的受损程度有关[2]。当细胞遇到病理性相关因素导致的蛋白质损伤、聚焦变性等有害应激时,分子伴侣启动相关功能对细胞进行保护,增强机体对多种应激源引起的损伤的适应能力,其中HSP72属于诱导型HSP70[3]。许多研究表明,在包括高热、低氧缺血和再灌注等细胞应激时,若没有热休克蛋白的保护作用会导致细胞死亡[4]。Matsumori[5]研究表明 HSP70 保护心脏冠状动脉内皮细胞,调节血管平滑肌舒张功能,认为HSP70的内皮保护功能是其保护缺血心肌的重要保护机制。由于不同的运动强度、持续时间对心肌细胞HSP70的表达影响不同,研究如何调动内源性保护途径来预防和治疗运动性心肌损伤成为重要的课题。Bussolati等[6]在活体内发现VEGF诱导了HSP32的表达。Chiara等[7]将 VEGF、HSP(70与32分别)与氯化血红素(hemin)结合施加到猪内皮细胞,作用24 h后发现,减少了脂多糖(LPS)诱导的内皮细胞凋亡,从而表明,这些分子可能通过不同的通路发生了协同效应。HSP70与VEGF两者相互作用是个值得研究的课题。低氧与训练结合均发挥了各自的优势,低氧浓度、低氧方式等不同对机体的影响不同。本实验采用模拟不同海拔高住低练的应激模型,了解大鼠心肌保护性蛋白VEGF和HSP70的表达情况,为揭示其分子网络机制和科学低氧训练提供研究资料。
1 材料与方法
1.1 实验对象及分组
健康2月龄SD(Sprague-Dawley)大鼠48只,体重(200±11.31)g,购自长沙市开福区东创实验动物科技服务部,证号:湘scxk 2009-003。实验室温度20~23℃,相对湿度为45%~55%;以国家标准啮齿类动物饲料饲养大鼠,自由饮水,并保持每天换饮水和加足饲料。实验中对动物的处置符合中华人民共和国科学技术部2006年颁布的《关于善待实验动物的指导性意见》规定。
适应性喂养1周后,按体重随机分为6组:常氧对照组(C)、14.5%O2低氧暴露组(14.5%O2LH)、12.7%O2低氧暴露组(12.7%O2LH)、常氧训练组(TL)、14.5%O2高住低练组(14.5%O2HiLo)、12.7%O2高住低练组(12.7%O2HiLo),每组8只。
1.2 实验方案
1.2.1 低氧处理
采用美国Hypoxic公司的低氧装置(由低氧发生器和密封帐篷连接组成)进行低氧实验。依分组在常氧(20.9%氧浓度,平原地区)、14.5%氧浓度(相当于海拔高度2800 m)和12.7%氧浓度(相当于海拔高度4000 m)三种不同氧浓度适应1周后,两个单纯低氧暴露组每天在低压氧舱中暴露22 h后2 h舱外常氧活动;两个高住低练组每天在低压氧舱中暴露22 h后1 h常氧生活,然后1 h常氧训练。所有进行低氧暴露的动物每周实验6天,共4周。
1.2.2 运动训练安排
适应喂养3天后,采用杭州立泰科技有限公司PT实验动物跑台进行一次5~10 min适应性跑台运动,速度为16 m/min,坡度为0。正式实验期间,每天训练速度为35 m/min,运动时间从30 min至60 min递增,每3天增加5 min。每天训练1次,每周6天,周六休息1天,共训练4周。
1.3 标本制备
实验结束后24 h,用100 g/L水合氯醛麻醉大鼠(600 mg/kg),大鼠仰卧于手术台上,暴露胸腔,迅速取一小块心尖部位的心肌置于包埋盒,放入4%多聚甲醛缓冲溶液(0.1M,pH7.4)中,固定24 h后,进行常规脱水、透明、进蜡、包埋等,用于VEGF和HSP70免疫组织化学标本制作。
1.4 VEGF和HSP70的免疫组织化学检测
将石蜡切片脱蜡脱水;用3%H2O2室温孵育10 min,阻断内源性过氧化物酶;微波炉修复抗原,PBS液冲洗5 min×3次;用5%~10%山羊血清室温孵育10 min;滴加一抗(1:50,兔源VEGF和HSP70多克隆抗体,购自武汉博士德生物试剂有限公司),置4℃冰箱过夜;室温孵育15 min,PBS液冲洗5 min×3次;滴加二抗(PV6001/6002二步法免疫组化检测试剂,购自武汉博士德生物试剂有限公司),37℃恒温箱中孵育30 min(烤片),PBS液冲洗5 min×3次;采用终浓度为0.05%DAB-0.03%H2O2的显色剂显色4~5 min,PBS液充分冲洗,苏木素常规染色4~5 min,1%盐酸酒精分色数秒;烘干,中性树胶封片。用PBS代替一抗作为空白对照。
1.5 形态学计量(morphometry)
显微镜下大鼠心肌VEGF和HSP70免疫组织化学阳性物质着色为黄褐色。每组选片10张,镜下(×400)每张切片随机取5个视野进行分析。用Simple PCI 6.0计算机显微图像分析系统分析免疫组化阳性产物灰度值。采用阳性指数(positive index,PI)作为VEGF和HSP70阳性产物表达量,阳性指数=阳性强度光密度值×阳性反应面积/测量面积[8]。
1.6 统计学分析
所有数据均用SPSS13.0统计学软件进行处理,用平均值±标准差(±s)表示;低氧暴露、常氧训练组和高住低练组各组间显著性差异采用方差分析,两低氧暴露组和两高住低练组组内比较采用t检验,显著性水平为 = 0.05,Ρ< 0.05具有显著性差异,Ρ< 0.01具有非常显著性差异。
2 结果
2.1 各组大鼠心肌VEGF阳性物质表达
图1显示,镜下大鼠心肌VEGF免疫组织化学阳性物质着色为黄褐色,着色区域主要在心肌细胞或内皮细胞的胞膜或细胞浆中。正常细胞核呈蓝色。C组、14.5%O2LH组和12.7%O2LH组,阳性着色面积较小,颜色较浅,胞核不着色;14.5%O2HiLo组VEGF阳性面积较大,颜色呈深褐色,呈区域性分布,主要分布在心肌细胞或内皮细胞的胞膜或细胞浆中,甚至细胞核也着色;但12.7%O2HiLo组阳性表达的阳性物质颜色变浅,染色分布较均匀,无着色很明显的区域。
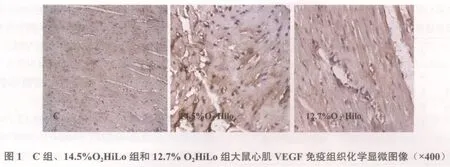
表1显示,与C组比较,两LH组、TL组和两HiLo组VEGF阳性物质表达量均有所增加,除12.7%O2LH组外,其他各组表达显著增加(Ρ< 0.05, < 0.01);与TL组相比,两HiLo组VEGF阳性物质表达量显著增加(Ρ< 0.05);与两LH组相比,两HiLo组VEGF阳性物质表达量显著增加(Ρ< 0.05);14.5%O2LH组VEGF阳性物质表达量较12.7%O2LH组显著增加(Ρ< 0.05),12.7%O2HiLo组比14.5%O2HiLo组显著降低(Ρ<0.05),14.5%O2HiLo组VEGF阳性物质表达量较14.5%O2LH组显著增加(Ρ< 0.05),14.5%O2HiLo组VEGF阳性物质表达量较12.7%O2LH组显著增加(Ρ< 0.05)。

表1 各组大鼠心肌VEGF免疫组织化学分析阳性指数和表达面积结果
2.2 各组大鼠心肌HSP70阳性物质表达
图2显示,镜下大鼠心肌HSP70免疫组织化学阳性物质呈颗粒状,染色为黄褐色,着色区域主要在细胞核仁周围的细胞浆中,正常细胞核呈浅蓝色。C组着色较浅,分布均匀,TL组与之相当;两LH组和两HiLo组HSP70阳性表达面积明显增大,颜色呈深褐色,着色区域主要分布在胞核周围地带,细胞浆着色较均匀;12.7%O2比14.5%O2的HSP70阳性表达增加,细胞核及周围染色增加,但低氧暴露组HSP70阳性表达与低氧训练组之间相当,区分度不明显。

表2显示,与C组相比较,两LH组和两HiLo组HSP70阳性物质表达量均有所增加(Ρ<0.05),其中,12.7%O2LH组表达最明显,而TL组增加不显著(Ρ> 0.05);与TL组相比,两HiLo组HSP70阳性物质表达量显著增加(Ρ< 0.05);与LH组相比,12.7% O2HiLo组HSP70阳性物质表达量显著增加(Ρ< 0.05),而14.5% O2HiLo组表达量增加不显著(Ρ> 0.05);14.5% O2LH和HiLo两组HSP70阳性物质表达量分别比12.7%O2LH和HiLo两组显著降低(Ρ< 0.05),而两LH组HSP70阳性物质表达量分别与两HiLo组相比无显著性差异(Ρ> 0.05)。

表2 各组大鼠心肌HSP70免疫组织化学分析阳性指数和表达面积结果
3 讨论
3.1 模拟不同海拔高住低练对大鼠心肌VEGF的影响
本研究发现,14.5%O2低氧暴露组,12.7%O2两高住低练组的VEGF阳性物质表达量增加(Ρ<0.05),而14.5%O2高住低练组表达增加非常显著(Ρ< 0.01)。Hudlicka等[9]报道,高原适应后的心率下降与心脏毛细血管增生有关。影响毛细血管增生的因素中,VEGF是一种能特异性作用于血管内皮细胞的、强促细胞分裂素和促血管生成因子,由低氧诱导,是目前最重要的促血管增生的因子。本实验结果表明,常氧运动组的VEGF阳性物质表达量显著增加(Ρ< 0.05)。研究发现耐力训练可促进心肌毛细血管的增生,毛细血管密布也增加,毛细血管的增生可增加心脏的血氧供应,是心脏对耐力训练良好适应的表现[10]。
本实验结果表明,12.7%O2低氧暴露组VEGF阳性物质表达量较14.5%O2低氧暴露组显著降低,12.7%O2高住低练组表达量较14.5%O2高住低练组显著降低。这表明低氧和运动的交互效应与单纯低氧诱导VEGF阳性物质表达不同。翁锡全等[11]的研究结果表明,常压下不同低氧环境模拟高住低练对大鼠心肌VEGF mRNA表达作用结果不同,常压下14.5%氧含量(相当于海拔3000 m)模拟高住低练能诱导VEGF上调,而在常压下12.6%氧含量(相当于海拔4000 m)模拟高住低练时VEGF mRNA基因表达量却减少。其训练模型不同于本实验,表现在低氧浓度相同但低氧持续时间不同,但得到的结果类似,表明低氧训练中,随着海拔高度增加,低氧刺激对VEGF的影响更加明显,但海拔高度过高,如4000 m高度可能不利于VEGF表达,如本实验中12.7%O2低氧暴露组VEGF增加则不明显,其机制仍需进一步研究。
3.2 模拟不同海拔高住低练对大鼠心肌HSP70的影响
本实验结果显示,14.5%O2和12.7%O2的低氧暴露和高住低练均能诱导HSP70阳性物质表达量显著增加。HSP70有非常广泛的应激保护作用,研究已经阐明,低氧、运动和低氧运动可诱导HSP70表达,从而对心脏起一定的保护作用,增强缺血后心肌功能的恢复[12,13]。本实验中,常氧训练组HSP70有所增加。胡亚哲等[14]研究表明,心肌形态结构在有氧训练后发生适应性改变,心肌细胞HSP70表达增加;过度训练后则发生病理性改变,心肌细胞HSP70表达较有氧训练组亦显著增加。
本实验结果显示,与常氧训练组相比,两高住低练组HSP70阳性物质表达量显著增加,表明低氧促进了HSP70表达;14.5%O2低氧暴露和14.5%O2高住低练两组HSP70阳性物质表达量比12.7%O2低氧暴露和12.7%O2高住低练两组明显降低,表明不同低氧浓度诱导的HSP70阳性物质表达不同;而两低氧暴露组HSP70阳性物质表达量与两高住低练组无显著性差异,表明低氧与训练未形成交互效应。魏勇等[15]提出运动时产生的体温升高使线粒体氧化磷酸化解偶联,产生氧自由基和H2O2,诱导了HSP合成表达。同时,其他研究也认为运动应激导致的HSP70合成可能与运动时机体内环境改变有关。概言之,运动过程中机体内环境变化,包括高热、钙离子和pH值改变、缺氧、组织损伤后炎症介质释放及自由基生成等,导致细胞结构与功能改变和蛋白质变性损伤,从而诱导HSP表达,并可能与能量耗竭有关。
4 总结
单纯低氧暴露、常氧运动及高住低练三种应激因素均诱导细胞保护性蛋白VEGF和HSP70表达;14.5%O2HiLo组VEGF表达最显著,而12.7%O2LH组HSP70表达最显著。
[1]Goldberg MA,Schneider TJ. Smiliarities between the oxygensensing mechanisms regulating the expression of vascular endothelial growth factor and erythropoietin. J Biol Chem,1994,269:4355-4361.
[2]扈盛,胡亚哲. 热休克蛋白70在末端病中表达的研究.中国运动医学杂志,2002,21(3): 232- 234.
[3]席利利. 运动对大鼠骨骼肌FOS和HSP70表达的影响研究. 首都体育学院硕士学位论文,2008. 16-30.
[4]胡娟. 低氧刺激与机体适应性应激蛋白研究进展. 中国公共卫生,2004,20(5):321-323.
[5]Matsumori Y,Northington FJ,Hong SM,et al. Reduction of caspase-8 and-9 cleavage is associatedwith increased c-FLIP and increased binding of Apaf-1 and Hsp70 after neonatal hypoxic/ischemic injury in mice overexpressing Hsp70. Stroke,2006,37(2):507.
[6]Bussolati B,Ahmed A,Pemberton H,et al. Bifunctional role for VEGF-induced heme oxygenase-1 in vivo:induction of angiogenesis and inhibition of leukocytic in filtration. Blood,2004,103:761-766.
[7]Chiara B,Augusta Z,Maria Elena T,et al. Heat shock protein 70,heat shock protein 32,and vascular endothelial growth factor production and their effects on lipopolysaccharideinduced apoptosis in porcine aortic endothelial cells. Cell Stress & Chaperones,2005,10(4),340-348.
[8]刘文锋,瞿树林,汤长发.“ 高住低练”对大鼠肝组织低氧诱导因子-1 的蛋白表达的研究. 中国运动医学杂志,2008,27(1):11-14.
[9]Hudlicka O,Brown MN,Weiss JB,et al. Factors involved in capillary growth in heart. Mol Cell Bioch,1995,147:57-68.
[10]常芸,林福美,吕丹云. 耐力训练后大鼠心肌毛细血管的研究之一——毛细血管显微形态计量研究. 中国运动医学杂志,1990,9(3):152-157.
[11]翁 锡全,黄丽英,林文弢. 常压模拟高住低练对大鼠心肌血管内皮生长因子基因表达的影响. 中国运动医学杂志,2003,22(4):354-357.
[12]Hamilton KL,Staib JL,Phillips T,et al. Exercise,antioxidants,and HSP 72:Protection against myocardial ischemia/reperfusion. Free Radic Biol Med,2003,34(7):800-809.
[13]石真玉,肖国强. 热休克蛋白70与运动. 中国体育科技,2006,42(5):136-141.
[14]胡亚哲,陈艳,扈诗兴,等. 运动训练诱导大鼠心肌细胞热休克蛋白70表达. 中国运动医学杂志,2009,28(5):561-563.
[15]魏勇,陈佩杰. 运动应激后热休克蛋白的表达及其意义. 中国运动医学杂志,2002,21(1):74-76.
