半月板纤维软骨细胞与壳聚糖/聚磷酸钙体外复合培养的实验研究
2012-11-17付维力王践云李箭万昌秀叶京兵罗大辉李棋
付维力 王践云 李箭 万昌秀 叶京兵 罗大辉 李棋
1 四川大学华西医院骨科(成都 610041) 2 四川大学高分子科学与工程学院
近年来,利用组织工程原理和技术重建严重损伤的半月板或治疗半月板缺失的患者,已成为国内外研究的热点[1-6]。目前,应用于组织工程半月板的支架材料还处于广泛的筛选和试验阶段,而单一的无机材料和单一的有机材料均难以满足临床对组织工程半月板的生物活性及生物力学性能的综合要求。如何结合天然和合成、有机和无机支架材料的各自优点,构建符合组织工程半月板要求的复合材料,是目前支架材料的研究热点[7]。壳聚糖(chitosan,CS)具有良好的生物相容性和可调节的生物降解性能,其结构单元氨基葡萄糖与细胞外基质(extracellular matrix,ECM)中蛋白多糖分子链的结构单元糖胺聚糖相似。它属于pH依赖性阳离子聚合物,可与阴离子反应生成聚电解质配合物而具多重生物活性,其单体上的氨基基团可作为活性基团与醛基反应。但其缺点是力学强度不够。而聚磷酸钙(calcium polyphosphate,CPP)具有良好的生物相容性和良好的化学稳定性,并具备优良的力学性能。壳聚糖与聚磷酸钙两者复合可以取长补短,提高其力学强度和生物相容性。因传统交联剂如戊二醛、乙二胺等随着材料降解逐渐出现毒副作用,本实验针对复合支架材料的降解和交联剂的选择等问题,探索了一种天然材料海藻酸钠来源研制的新型生物交联剂醛基化海藻酸钠(aldehyde alginate,ADA)[8,9],在此基础上,采用化学交联固化法将CS、ADA和CPP有机地结合起来,制备一种新型多孔半月板组织工程支架材料;通过观察半月板细胞在不同配比CS/CPP支架材料上的生长、增殖状况,为支架材料探索最佳的CS/CPP比例,为组织工程半月板支架材料的优选提供实验依据。
1 材料与方法
1.1 实验动物及主要试剂、仪器
实验动物:清洁级健康1周龄新西兰乳兔,雌雄不限,约200~300 g,由四川大学华西动物实验中心提供。1:1 DMEM/F12(DF)、FBS、胰蛋白酶、EDTA、Ⅱ型胶原酶(Sigma公司,美国);CO2培养箱(SANYO公司,日本);离心机(Eppendorf公司,德国),倒置相差显微镜(Olympus公司,日本),扫描电镜(JSM-6700F,JEOL,日本);鼠抗兔Ⅰ型胶原单克隆抗体、鼠抗兔Ⅱ型胶原单克隆抗体(Oncogene公司,美国);SABC免疫组化试剂盒(武汉博士德生物技术有限公司);DAB显色试剂盒(北京中杉金桥生物技术有限公司);碳酸钙、磷酸、高碘酸钠(分析纯,成都科龙化工试剂厂);海藻酸钠(分析纯,浙江晶岩生物有限公司);壳聚糖(医用级,浙江澳兴生物有限公司)。
1.2 半月板纤维软骨细胞的分离培养
无菌条件下取1周龄新西兰乳兔双膝内外侧半月板,放入盛有DF培养基的培养皿中,用含1%庆大霉素的PBS冲洗3遍,剪成约1 mm×1 mm×1 mm碎块,然后用0.25%胰蛋白酶37℃预消化30 min,再加入0.2%Ⅱ型胶原酶37℃恒温水浴摇床振荡消化4~6 h。经显微镜观察,大部分细胞消化下来后,用巴氏吸管吹打2 min,终止消化,用200目筛网过滤消化后的细胞悬液,1.2k r/min离心5 min,弃上清,PBS洗两次,细胞按1×106/瓶重悬于含10%FBS的DF培养基的底面积为25 cm2的培养瓶,置于37℃、5%CO2、95%湿度培养箱中培养。每3 d换液1次,隔日倒置相差显微镜下观察细胞形态变化和生长情况。待细胞铺满瓶底(80%~90%融合)后,用含0.1%EDTA的0.25%胰蛋白酶消化传代。通过细胞化学(HE染色、甲苯胺蓝、番红O)、Ⅰ型和Ⅱ型胶原免疫组化对体外培养的半月板细胞进行表型鉴定,取第3代细胞进行实验。
1.3 壳聚糖/聚磷酸钙复合支架材料的制备
称取质量比例分别为10:0、7:3、5:5、3:7的CS、CPP,分别溶入醋酸溶液和无水乙醇,共混加热搅拌制备成均一的CS/CPP混合物,加入ADA溶液交联,高速搅拌2 min。迅速将制备的CPP/CS/ADA凝胶转入到模具中,将填有凝胶混合物的模具转入冰箱中,于-20℃冷冻4 h,使固液相分离。之后使用冷冻干燥机于压力为0.5 mmHg、-5℃条件下干燥24 h,以完全除去溶剂。干燥完毕后,即得到不同CS/CPP比例的复合多孔支架。取制备的不同配比CS/CPP三维多孔支架,样品表面喷铂金处理后,于扫描电镜下观察样品的结构形貌,通过排液法测定支架的孔隙率。取三维多孔支架(直径5 mm,高3 mm)分别加入6孔板内,封口后经Co-60 射线(照射总剂量为25KGy)消毒后备用。
1.4 组织工程化半月板的体外复合培养
取单层培养条件下生长良好的第三代半月板纤维软骨细胞,经0.25%胰蛋白酶和0.1%EDTA按1:1混合酶消化,收集细胞,制备2×107/ml密度的细胞悬液。用10 µl的微量移液枪将细胞悬液以10 µl/材料样品缓慢均匀滴加于材料上,然后放于37℃培养箱孵育2 h,使细胞粘附到材料中。再将剩下的细胞滴加到材料上,并于材料底部滴加10µl培养基保湿,置于37℃培养箱孵育2 h,使接种的半月板细胞第二次沉淀到支架上,缓慢从材料旁边加入含10%FBS的DF培养液进行复合培养。隔日换液,体外复合培养7 d。
1.5 观察指标
形态学观察:复合后,隔日于倒置相差显微镜下观察细胞在支架材料上的生长和粘附情况。
组织学染色观察:复合培养7 d后,各取一块不同配比的材料于4%多聚甲醛中固定,梯度酒精脱水,二甲苯透明,常规石蜡包埋,5 µm切片,行HE组织化学染色,光镜下观察。
扫描电镜观察:复合培养7 d后取出标本,分别取一块不同配比的材料PBS漂洗,2.5%戊二醛固定2 h,PBS冲洗,梯度乙醇上行脱水,醋酸异戊酯保存,CO2干燥器干燥、喷金、黏托,扫描电镜观察细胞在材料上的生长情况。
2 结果
2.1 半月板纤维软骨细胞的分离培养观察(图1)
半月板纤维软骨细胞原代接种后8 h有少量细胞开始贴壁,48~72 h多数细胞贴壁完全,胞质逐渐展开,细胞变大伸长,形成突起,呈多角形,细胞形态规则,轮廓清晰,镜下观察有立体感,出现明显的集落样分区,表现“细胞群聚”现象,7~9 d后,细胞长满传代。传代后细胞贴壁生长能力和增殖速度明显加快。第2代后细胞形态开始逐渐变为梭形,第3代后细胞生长速度减慢,增殖减缓。细胞HE染色、甲苯胺蓝、番红O和免疫组化染色显示:体外分离培养的第3代半月板细胞Ⅰ型和Ⅱ型胶原均表达阳性,并分泌蛋白聚糖,其基本维持半月板纤维软骨细胞的表型。
2.2 支架材料的检测
扫描电镜下观察可见:孔径大小和分布较均匀,并且相互贯通,孔径分布在200~500 µm之间(图2)。通过排液法测定支架的孔隙率在75%~86%之间。使用ADA交联制备出的复合支架生物材料具有较高的孔隙率和孔径。
2.3 半月板纤维软骨细胞与壳聚糖/聚磷酸钙体外复合培养观察
2.3.1 倒置相差显微镜观察
半月板纤维软骨细胞接种后呈球形,黏附于多孔支架边缘,培养液中可见少量悬浮细胞,1 h后细胞开始贴壁,4 h后大部分细胞贴壁完全,呈短梭形或多角形,形态规则;3~5 d后可见细胞在支架上黏附良好,支架孔隙逐渐被细胞以及分泌的基质填满,细胞支架复合体轮廓逐渐明显。
2.3.2 HE染色
HE染色(图3)可见:半月板软骨细胞粘附于支架材料上,呈梭形或多角形,胞浆红染,细胞核呈圆形或者卵圆形。可见核仁和细胞质,细胞可见分裂相。孔洞内可见细胞生长,并有基质分泌。
2.3.3 扫描电镜观察
扫描电镜观察(图4)可见,复合培养7 d,细胞在支架上均匀分布,紧贴支架上生长,细胞多数呈多角形,形态规则,大小均一,立体感强,可见大量基质分泌。其中3:7的CS/CPP支架材料上,半月板细胞生长良好,数目最多,接近覆盖整个支架表面,生长极其旺盛,连接紧密,融合成片,细胞外基质分泌也最多。
3 讨论
3.1 半月板纤维软骨细胞的鉴定
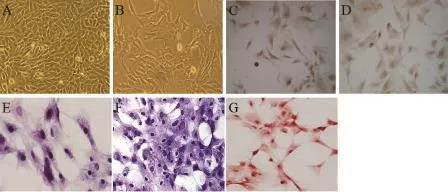
图1 MFCs形态学、细胞化学和免疫组化染色观察(倒置相差显微镜×200)

图2 扫描电镜观察不同比例CS/CPP复合三维多孔支架(×1200)
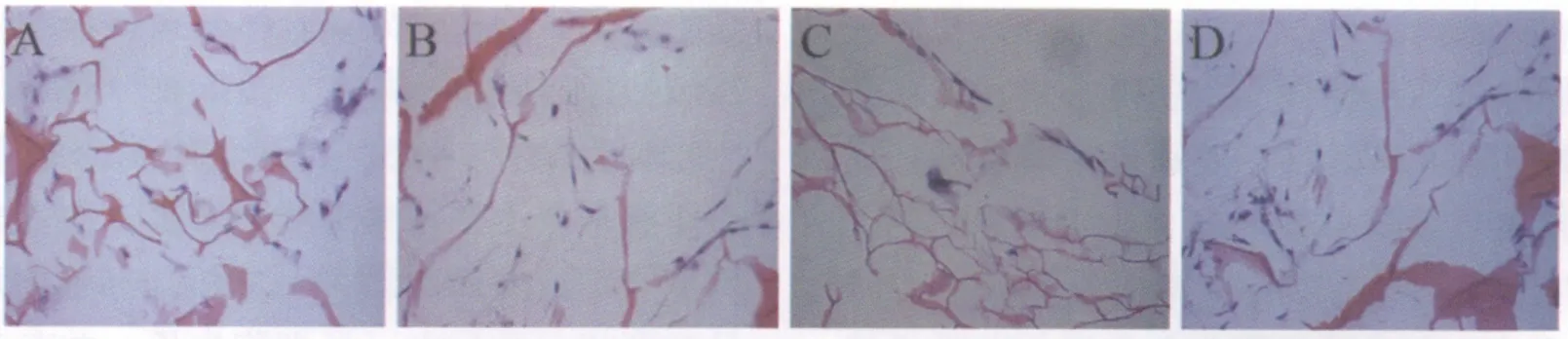
图3 MFCs与不同比例CS/CPP复合培养7d组织学观察(HE×200)
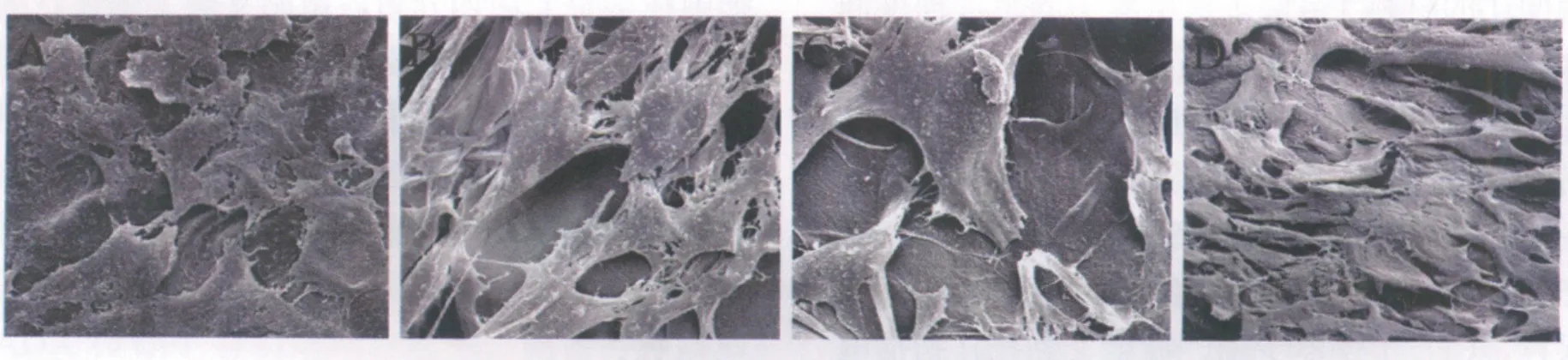
图4 MFCs与不同比例CS/CPP复合培养7d扫描电镜观察(×1200)
对于将半月板细胞归类于软骨细胞还是成纤维细胞,一直存在争议。有学者研究发现,半月板组织包含成纤维细胞样细胞和软骨细胞两种细胞亚型,因此认为将其称为纤维软骨细胞较合适。形态学上,半月板细胞在单层培养条件下显示三种不同的细胞类型:伸长的成纤维细胞样细胞、多边形细胞和小圆的软骨细胞样细胞[10]。半月板组织ECM中胶原成分主要为I型胶原(占90%以上),此外,还含有II、III、V型等胶原成分[11]。有学者根据半月板细胞形态、分布和ECM的不同,把半月板细胞分为不同的细胞亚群:纤维软骨细胞、成纤维细胞样细胞和位于浅表层区的细胞。纤维软骨细胞位于半月板内侧2/3和深部,呈圆形或椭圆形,有活跃的分泌功能,ECM成分主要为Ⅰ、Ⅱ型胶原,其比例为2:3,提供半月板的支架结构和抗拉伸性能,还包括提供抗压缩性能的蛋白多糖;成纤维细胞样细胞位于外周1/3,该区域含少量ECM,主要为Ⅰ型胶原[12]。再者,由于成年兔半月板组织细胞成分较少,我们采用1周龄新西兰乳兔为实验动物。II型胶原含量可能也与半月板组织的发育有关。综上,本研究通过Ⅰ、Ⅱ型胶原和蛋白聚糖的表达鉴定第三代细胞仍具备半月板纤维软骨细胞的表型。
3.2 半月板细胞与支架材料的复合培养
半月板细胞与支架材料的复合是体外构建组织工程半月板的关键技术,主要通过细胞和支架材料的双向选择评价其用于半月板组织工程的可行性。主要影响因素有:支架材料的组成、孔隙率、孔径、厚度,细胞的种类和代数,植入方式、接种密度、时间,复合体所处的微环境等。Neves等[13]研究得出,细胞-支架复合物体外培养7天时能获得最高的细胞密度。7天后细胞增殖到平台期时,ECM的合成速率显著下降。故建议构建组织工程半月板时,细胞/支架复合物在体外培养不应超过7天。Iwasa等[14]研究发现,构建软骨组织工程接种的细胞密度应不少于2×107/ml。本实验采用二次沉淀接种法将第三代半月板纤维软骨细胞以2×107/ml种植于不同配比CS/CPP支架上,体外培养7天,该方法可以增加种子细胞沉积粘附的数量和ECM的分泌。
3.3 生物材料的生物学界面反应
生物材料是构建组织工程半月板的重要组成部分,也是影响组织构建最关键的因素之一,用于组织修复再生的支架材料必须同时具有生物活性和生物可控降解性[15]。将细胞与三维多孔的支架材料联合培养构建组织是组织工程的基本方法[16,17]。人体细胞的微生态环境主要是它分泌的ECM和信号分子等有机生物活性物质共同构成细胞生长的环境,调控细胞的正常代谢及迁移、增殖、分化、信号转导等活动。研究细胞-生物材料的生物学界面(Biointerface)是深入探索构建组织工程化半月板的本质和基础,也是进一步从仿生角度研发组织工程半月板支架材料的重要内容。其生物学界面反应是材料表面及降解产物的动态变化对细胞微生态环境的影响,从而导致细胞行为和分子水平功能蛋白基因表达的变化[18]。针对当前生物材料和组织工程支架急需提高生物活性、可控降解性和促进再生功能性等研究的热点问题,本课题研制了一种新型组织工程半月板支架——壳聚糖/聚磷酸钙复合材料。壳聚糖结构单元氨基葡萄糖与细胞外基质中糖胺聚糖类似结构,能与生长因子、受体和粘连蛋白产生许多特异相互作用,并可调控生物活性分子释放,壳聚糖中大量自由氨基的存在使其表面具有很强的吸附作用,有利于细胞的粘附。通过对聚磷酸钙制备工艺的研究,建立了计算聚合度的数学模型,其分子主链为“-P-O-P-”键,在结构上仿生物活化能ATP的高能磷酸键[19];体外与半月板细胞的复合培养实验表明,该键的断裂为细胞生长提供了能量,明显促进半月板细胞的粘附和生长。因此,不同配比CS/CPP复合材料中,随着CPP含量增加,半月板细胞数量和细胞外基质呈逐渐增多的趋势;其中3:7的CS/CPP支架材料上半月板细胞数目最多,接近覆盖整个支架表面,生长极其旺盛,连接紧密,融合成片,细胞外基质分泌也最多。再者,CPP降解过程中产生的钙离子,可能参与细胞与细胞外基质的相互作用和信号分子的传递,细胞识别与粘合的分子机制主要通过细胞粘附因子介导细胞间或与细胞微生态环境间相互识别与结合,多数细胞粘附因子作用依赖钙离子,存在钙离子结合位点,因此含CPP较多的复合材料更有利于半月板细胞的粘附,但目前CPP降解过程中产生的钙离子参与信号转导的分子生物学机制仍不清楚。
综上所述,我们探索使用一种天然材料海藻酸钠来源研制的新型生物交联剂ADA,采用化学交联固化法,将CS、ADA和CPP有机结合起来,制备一种新型多孔半月板组织工程支架材料,观察半月板细胞在不同配比的CS/CPP支架材料上的生长、增殖状况,结果显示:三维多孔的CS/CPP复合材料能促进半月板细胞的粘附、生长,其中3:7的CS/CPP支架材料细胞相容性和生物活性最好,最适于半月板纤维软骨细胞粘附和生长,并能促进半月板细胞增殖和维持其表型,有望成为组织工程半月板良好的支架载体。
[1]van Tienen TG,Hannink G,Buma P. Meniscus replacement using synthetic materials. Clin Sports Med,2009,28(1):143-156.
[2]Buma P,Ramrattan NN,van Tienen TG,et al. Tissue engineering of the meniscus. Biomaterials,2004,25(9):1523-1532.
[3]Hoben GM,Athanasiou KA. Meniscal repair with fibrocartilage engineering. Sports Med Arthrosc,2006,14(3):129-137.
[4]Baker BM,Nathan AS,Huffman GR,et al. Tissue engineering with meniscus cells derived from surgical debris. Osteoarthritis Cartilage,2009,17(3):336-345.
[5]Gunja NJ,Athanasiou KA. Passage and reversal effects on gene expression of bovine meniscal fibrochondrocytes.Arthritis Res Ther,2007,9(5):R93.
[6]Yamasaki T,Deie M,Shinomiya R,et al. Transplantation of meniscus regenerated by tissue engineering with a scaffold derived from a rat meniscus and mesenchymal stromal cells derived from rat bone marrow. Artif Organs,2008,32(7):519-524.
[7]付维力,王践云,万昌秀,等. 组织工程半月板支架材料研究进展. 生物医学工程学杂志,2010,(2):458-462.
[8]李华,史国齐,万昌秀. 壳聚糖/海藻酸钠自组装微球的制备及释药性能. 华西药学杂志,2008,(3):249-252.
[9]王践云,金娟,叶文靖,等. 新型天然交联剂氧化海藻酸钠制备及其性能研究. 化学试剂,2009,(2):97-100.
[10]Nakata K,Shino K,Hamada M,et al. Human meniscus cell: characterization of the primary culture and use for tissue engineering. Clin Orthop Relat Res,2001,(391 Suppl):S208-S218.
[11]Verdonk PC,Forsyth RG,Wang J,et al. Characterisation of human knee meniscus cell phenotype. Osteoarthritis Cartilage,2005,13(7):548-560.
[12]Kambic HE,Mcdevitt CA. Spatial organization of types I and II collagen in the canine meniscus. J Orthop Res,2005,23(1):142-149.
[13]Neves AA,Medcalf N,Brindle KM. In fl uence of stirring-induced mixing on cell proliferation and extracellular matrix deposition in meniscal cartilage constructs based on polyethylene terephthalate scaffolds. Biomaterials,2005,26(23):4828-4836.
[14]Iwasa J,Ochi M,Uchio Y,et al. Effects of cell density on proliferation and matrix synthesis of chondrocytes embedded in atelocollagen gel. Artif Organs,2003,27(3):249-255.
[15]Chung C,Burdick JA. Engineering cartilage tissue. Adv Drug Deliv Rev,2008,60(2):243-262.
[16]韩平,杨志明,智伟,等. 膀胱平滑肌细胞与小肠黏膜下层体外复合培养的实验研究. 中国修复重建外科杂志,2007,(12):1366-1370.
[17]杨强,彭江,卢世璧,等. 新型脱细胞软骨基质三维多孔支架的制备. 中国修复重建外科杂志,2008,(3):359-363.
[18]Hench LL,Polak JM. Third-generation biomedical materials. Science,2002,295(5557):1014-1017.
[19]邱凯,万昌秀,陈馨,等. 骨组织工程支架材料聚磷酸钙体外降解规律的研究. 四川大学学报(工程科学版),2005,(1):61-64.
