粒细胞巨噬细胞集落刺激因子与乙肝疫苗协同诱导小鼠细胞免疫应答
2012-11-17周兴军李立敏董向锋董爱华
周兴军,宋 欣,李立敏,董向锋,董爱华,2
(1.华北制药集团 新药研究开发有限责任公司,2.微生物药物国家工程研究中心,河北 石家庄 050015)
乙型肝炎(乙肝)病毒感染是引起慢性肝病的主要病因,并常导致肝硬化及肝癌。它是一种胞内寄生物,它的清除与机体的细胞免疫有关,尤其是细胞毒性T淋巴细胞(CTL)和Th1细胞因子的分泌。研究表明慢性乙肝患者与自限性乙肝相比较,特异性的CTL反应,Th细胞反应,Th细胞和Th1细胞因子(IFN-γ)均明显低下,针对核心抗原的特异性CD4+和CD8+T细胞与慢性HBV感染的消除有关。利用疫苗治疗慢性乙肝病毒感染的作用机制是通过对抗原的改造和(或)抗原递呈途经的改变,使得T细胞更易识别抗原,促使前体T细胞增殖分化成效应T细胞来实现[1]。所以,增强乙肝疫苗的细胞免疫功能,有助于清除病毒感染的细胞,避免持续感染引起的慢性病变。本文着重探讨粒细胞巨噬细胞集落刺激因子(Gm-csf)与基因工程乙肝疫苗协同诱导小鼠细胞的免疫应答,为临床采用乙肝疫苗作为治疗措施提供实验依据。
1 材料
BALB/c小鼠,SPF级,雌性,体重16~18 g,购于北京维通利华实验动物技术有限公司,许可证编号:SCXK(京)2002-0003。
重组(CHO细胞)乙肝疫苗[Recombinant Hepatitis B Vaccine(Chinese Hamster Overy)](10 μg/mL)、注射用重组人 Gm-csf[Recombinant Human Granulocyte/Macrophage Colony-Stimulating Factor for Injection](rhGm-csf)(300 μg/支)、CHO 细胞表达的基因工程乙肝疫苗原液(HBsAg原液),均由华北制药集团金坦生物技术股份有限公司生产;乙肝病毒表面抗体酶联免疫法诊断试剂盒,北京万泰生物药业有限公司。
IFN-γ、和IL-5的酶联免疫吸附试剂盒,上海雄森科技实业有限公司;抗HBs用“乙型肝炎病毒表面抗体酶联免疫法诊断试剂盒”,北京万泰生物药业有限公司;MTT、SDS、HRP标记羊抗鼠 IgG1、IgG2a均购自Sigma公司。
2 方法
2.1 脾细胞增殖实验及细胞因子含量的测定
将BALB/c小鼠,随机分为4组,每组5只。原液组:给予乙肝疫苗原液2μg/只;疫苗组:给予乙肝疫苗2μg/只;混合疫苗组:给予乙肝疫苗2μg/只,同时给予rhGm-csf 20μg/只;GM+疫苗组:给予乙肝疫苗2μg/只的前3 d,连续3 d给予rhGm-csf 20μg/d。分别在第0,14天免疫两次,并在第21天眼眶放血处死。常规制备脾细胞悬液,用含15%胎牛血清的RPMI 1640完全培养基调整细胞浓度为1×107/mL,在96孔培养板中每孔加入脾细胞悬液100μL和含HBsAg原液(10μg/mL)的完全培养基100μL,阴性对照孔用完全培养基代替。在37℃,5%CO2孵箱中培养72 h后,每孔各取脾细胞培养上清液100μL,用小鼠IFN-γ和IL-5的酶联免疫吸附检测试剂盒测定细胞因子含量;剩余细胞采用MTT 法[2],每孔加入MTT(5mg/mL)20 μL,继续培养6 h,每孔再加入10%SDS 100μL,置37℃,湿盒中过夜,用酶联检测仪在570 nm/630 nm波长下读取各孔A值,检测脾细胞的增殖程度,即刺激指数。刺激指数=(A实验/A阴性对照)×100%。
2.2 HBsAg特异性CTL活性的测定
2.2.1 HBsAg特异性CTL效应细胞制备 分组及给药同2.1项。常规制备脾细胞悬液,用含15%胎牛血清的RPMI 1640完全培养基调整细胞浓度为1×107/mL。
2.2.2 靶细胞制备 取培养24~48 h的靶细胞YAC-1,用完全培养基洗涤2次,再调整细胞浓度至1×105/mL。
2.2.3 CTL活性测定实验组为效应细胞与靶细胞各100μL加入96孔板中,自然释放组以同体积的完全培养基代替效应细胞,空白对照组以同体积的完全培养液代替靶细胞,每份标本设3复孔,置37℃,5%CO2孵箱中培养4 h后,吸取各孔上清100μL后,每孔加入MTT(5mg/mL)20μL,继续培养6 h,每孔加入10%SDS100μL,置37℃,湿盒中过夜,用酶联检测仪在570 nm/630 nm波长下读取各孔A值,以A值计算杀伤率。杀伤率(%)=[(A空白+A自然释放-A实验)/A自然释放]×100%。
2.3 抗体IgG1、IgG2a亚型滴度检测
将2.2项下的小鼠血清收集到离心管中,3 000 r/min离心 15 min,分离血清,检测血清中抗体IgG1、IgG2a亚型滴度。用pH 9.6碳酸盐缓冲液将CHO表达的HBsAg原液稀释至2μg/mL,每孔100 μL包被在酶标板上,4℃湿盒中过夜;次日,洗涤后加入按一定比例稀释的小鼠血清,37℃培养1 h,洗板,然后每孔分别加入1∶4 000稀释的HRP标记羊抗鼠IgG1或IgG2a,37℃培养1 h,洗板,加显色剂,37℃静置10~15 min,加入1 mol/L H2SO4终止反应,在450 nm/630 nm波长下读取各孔A值。以空白对照作为阴性对照,A样品/A阴性对照>2.1判为阳性,A阴性对照<0.05按0.05 计算,高于0.05 按实际 A值计算,以出现阳性最高稀释度作为该样品的滴度。
2.4 统计学方法
原液组、疫苗组、混合疫苗组和GM+疫苗组免疫效果用t检验判断有无显著性差异。
3 结果
3.1 脾细胞增殖实验
GM+疫苗组小鼠脾细胞增殖速度最快,显著性高于其它组(P<0.01或0.05)。结果见表1。
3.2 CTL 活性测定
GM+疫苗组小鼠脾细胞CTL活性均显著高于其它组(P<0.01),结果见表1。
表1 脾细胞刺激指数及小鼠脾细胞对靶细胞的杀伤率(n=5,±s)Tab.1 The stimulation index and specific cytolytic activity of mice splenic lymphocytes in different groups(n=5,±s)
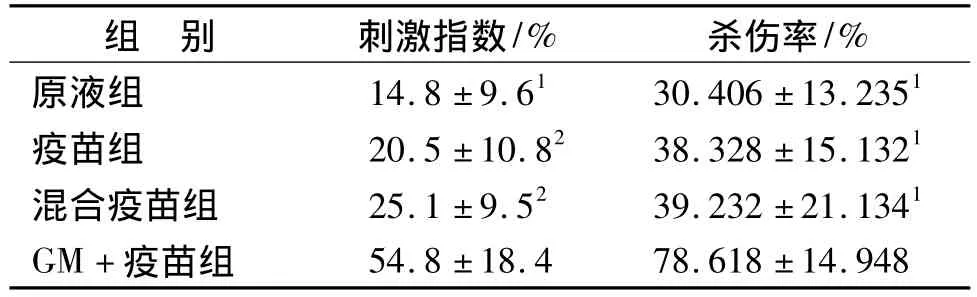
表1 脾细胞刺激指数及小鼠脾细胞对靶细胞的杀伤率(n=5,±s)Tab.1 The stimulation index and specific cytolytic activity of mice splenic lymphocytes in different groups(n=5,±s)
与GM+疫苗组相比:1 P<0.01,2 P<0.05Compared with the GM+Vaccine group:1 P<0.01,2 P<0.05
组 别 刺激指数/% 杀伤率/%原液组 14.8±9.61 30.406±13.2351疫苗组 20.5±10.82 38.328±15.1321混合疫苗组 25.1±9.52 39.232±21.1341 GM+疫苗组54.8±18.4 78.618±14.948
3.3 细胞因子
GM+疫苗组小鼠的脾细胞培养上清IFN-γ含量较多,GM+疫苗组显著高于疫苗组(P<0.05);混合疫苗组脾细胞培养上清IL-5含量较多,故活化的Th2型T细胞,分泌IL-5细胞因子,参与激活B细胞介导的体液免疫应答。结果见表2。
表2 脾细胞培养上清液中IFN-γ和IL-5含量(n=5,±s)Tab.2 The concentration of IFN-γand IL-5 of mice in splenic lymphocytes supernate(n=5,±s)

表2 脾细胞培养上清液中IFN-γ和IL-5含量(n=5,±s)Tab.2 The concentration of IFN-γand IL-5 of mice in splenic lymphocytes supernate(n=5,±s)
与GM+疫苗组相比:1P<0.05Compared with the GM+Vaccine group:1P<0.05
组 别 IFN-γ 含量/(pg/mL)IL-5含量/(pg/mL)原液组0 9.067±0.146疫苗组 14.025±2.2881 14.133±0.278混合疫苗组 16.462±9.5041 16.133±0.231 GM+疫苗组32.501±11.713 13.367±0.155
3.4 抗体IgG1、IgG2a亚型滴度
GM+疫苗组小鼠血清抗体中IgG2a占优势,混合疫苗组小鼠血清抗体中以IgG1为主。结果见表3。
表3 抗体IgG1、IgG2a亚型滴度(n=5,±s)Tab.3 The total antibody titer of sera in mice after the once immunization(n=5,±s)

表3 抗体IgG1、IgG2a亚型滴度(n=5,±s)Tab.3 The total antibody titer of sera in mice after the once immunization(n=5,±s)
?
4 讨论
以往对乙肝疫苗效果的评价指标一般为测定抗体反应,近年来疫苗诱导的细胞免疫受到人们的重视。乙肝表面抗原作为一种外源蛋白,不仅可使机体产生相应抗体,而且进入机体后,可由抗原提呈细胞(APC)进行酶解加工处理,生成的短肽与APC表面MHC分子形成复合物,呈递给T细胞进行激活,诱导CD8+抗原特异性的CTL产生,从而对胞内病原体产生灭活作用[3]。
在乙肝免疫治疗研究中,通常用以评价特异性细胞免疫学指标,有特异性CTL杀伤能力,刺激产生Th1类细胞因子如IFN-γ的水平,特异性T细胞增殖能力,以及特异性IgG2a的水平等[4]。CTL特异性识别HBV感染的细胞,通过细胞裂解、非细胞裂解(如分泌细胞因子)途径限制病毒传播,或通过细胞病毒作用,清除感染病毒的细胞。Gm-csf是一个具有多项潜能的骨髓造血生长因子,不仅能够作用于造血干、祖细胞促进骨髓造血,而且还作用于目前已知体内功能最强的抗原提呈细胞——树突状细胞,以促进免疫应答,调节免疫反应[5]。
本研究结果显示,提前3 d给予Gm-csf的GM+疫苗组小鼠机体的Th1/Th2免疫应答发生的明显变化,作为Th1样细胞因子代表的IFN-γ的产量明显增加,说明在机体的免疫细胞被Gm-csf激活的同时,接收到乙肝疫苗的抗原刺激,会诱发更加迅速、有效的抗原提呈,增强了机体的Th1样免疫应答。以上初步研究结果表明Gm-csf有助于提高CHO来源的乙肝疫苗细胞免疫,提示在乙肝的治疗方面可能会起到一定的作用。
[1]胡 辉,彭晓谋.慢性乙型肝炎的治疗性疫苗研究进展[J].热带医学杂志,2004,4(3):336-339.
[2]贾 茜 ,周兴军,王 辉,等.MTT法测定三种基因工程细胞因子生物学活性方法研究[J].中国生化药物杂志,2000,21(1):8-11.
[3]张 驰,廖雪雁,梁争论,等.不同来源乙肝表面抗原的细胞免疫学对比研究[J].中华微生物学和免疫学杂志,2004,24(1):48-51.
[4]易学瑞,祖 萍,袁有成,等.脂质体佐剂对增强HBsAg免疫原性的作用[J].上海免疫学杂志,2002,22(6):395-397.
[5]赵忠信.重组人粒细胞巨噬细胞集落刺激因子的临床新用途[J].中国肿瘤生物治疗杂志,2007,7(1):71-73.
