17-甲氧基-7-羟基-苯并呋喃查尔酮对大鼠心肌缺血再灌注损伤的保护作用
2012-11-17覃斐章黄仁彬
覃斐章,简 洁,焦 杨,黄仁彬
(1.广西医科大学 药学院,广西 南宁 530021;2.桂林医学院,广西 桂林 541004)
玉郎伞系豆科植物疏叶崖豆[Millettia pulchra(Dunn)Kurzvar.Laxior(Dunn)Z.Wei]的干燥根,为广西壮族的习用药材,用于治疗高血压、老年性痴呆,跌打损伤和风湿、消化不良、产后及病后虚弱等[1]。本课题组对玉郎伞成分进行了分离鉴定,从中筛选出一个具有较强抗氧化活性的新化合物[2]——17-甲 氧 基-7-羟 基-苯 并 呋 喃 查 尔 酮(YLSC),已获国家发明专利(200710034771.2)。我们初步的研究证实,YLSC具有较强的抗氧化、耐缺氧和抗凝血能力,对H2O2及缺氧复氧所致的心肌细胞损伤有较强的保护作用[3],提示YLSC在抗心肌缺血方面有一定的潜力。为进一步了解YLSC的药理作用,本实验观察了YLSC对缺血再灌注(I/R)大鼠的影响,并初步探讨其作用机制。
1 材料
YLSC(HPLC面积归一法检测纯度为98%),由广西医科大学药理教研室提供;氯化三苯四氮唑(TTC),Solarbio公司。
蛋白质、肌酸激酶(CK)、乳酸脱氢酶(LDH)、天门冬氨酸氨基转移酶(AST)测定试剂盒,南京建成生物工程研究所;细胞凋亡原位检测试剂盒,Roche公司;兔葡萄糖调节蛋白78(GRP78)多克隆抗体、兔caspase12多克隆抗体、鼠β-actin单克隆抗体,Santa Cruz Biotechnology;IgG-HRP、Immobilon-P试剂盒,Pierce公司。
动物呼吸机器,上海奥尔科特生物科技有限公司;722s可见光分光光度计,上海精密科学仪器有限公司生产;Western电泳仪,美国Bio-Rad公司。
SPF级SD大鼠,雌雄各半,体重250~280 g,广西医科大学实验动物中心提供,试验动物生产许可证:SCXK(桂)2009-0002,试验动物使用许可证:SYXK(桂)2009-0004。
2 方法
2.1 动物分组与给药方法
SD大鼠50只随机分为5组(每组10只):假手术组、模型组、溶媒组、YLSC低剂量组、YLSC高剂量组。假手术组和模型组均给予生理盐水;溶媒组给予含0.5%二甲基亚砜(DMSO)的生理盐水;YLSC低剂量组和YLSC高剂量组分别给予YLSC 2.50 和5.00mg/kg,YLSC 溶液用含0.5%DMSO 的生理盐水配制。各组均按2mL/kg尾静脉注射给药,1次/d,连续给药7d。末次给药后10 min复制大鼠I/R模型。
2.2 大鼠I/R模型的建立
20%乌拉坦腹腔注射麻醉大鼠。行气管插管,连接人工动物呼吸机,设置参数为:呼吸频率60~70次/min,潮气量50mL/kg,呼吸比1∶2。四肢皮下插入针灸针,连接肢导联,监测Ⅱ导联心电图。自胸骨左缘第3,4肋间开胸,放入泪囊牵张器撑开两侧肋骨,以便心脏暴露良好。剪破心包膜,左手用眼科捏夹一小棉球,用棉球将胸腺及左心耳轻轻向上推开,于冠状动脉左前降支根部进针穿5-0号缝合线(进针深度约1 mm,宽度约1.5~2 mm),备结扎用。缺血30 min再灌注60 min建立大鼠I/R模型,以左室前壁紫绀及ST段抬高,QRS幅度升高为结扎成功标志,ST段逐渐降低,左室前壁缺血区紫绀消失为复灌成功标志。假手术组仅穿线不结扎。
2.3 指标检测
2.3.1 血清CK、LDH、AST的测定实验结束后心脏取血3mL,室温静置2 h,4 000 r/min离心10 min,吸取上清液分装,-20℃保存备用。按试剂盒说明书测定血清CK、LDH、AST含量。
2.3.2 心肌梗死面积的测定再灌注结束后尾静脉注射5mg/mL伊文斯蓝1.5mL,30 min后打开胸腔,取出心脏,生理盐水充分洗净残血,滤纸吸干,剪去血管、结缔组织、心房和右心室,留下左心室。将左心室置于-20℃冰箱冷冻30 min,平行房室沟将其切成5~8片,每片厚1~2 mm。切片置于1%TTC中37℃孵育15 min,正常心肌组织染成蓝色,缺血心肌组织染成红色,梗死心肌组织不染色呈白色。将切片展开平铺于载玻片上,数码相机拍照,用病理图像分析软件计算梗死区总面积占缺血区总面积的百分比(infact size/area at risk zone,IS/AAR)。
2.3.3 TUNEL法检测心肌细胞凋亡率 用TUNEL法检测心肌凋亡阳性细胞的分布情况。将每个心脏标本切为5片,每片取5个阳性视野,即每个标本计25个视野。正常细胞核呈蓝色,阳性凋亡细胞核呈棕黄色,平均计算阳性细胞数占总细胞数的百分比作为细胞凋亡率。
2.3.4 Western blot法检测蛋白GRP78、caspase12的表达 抽提组织蛋白,Bradford法计算蛋白含量。取样品100μg,经SDS-PAGE电泳、转膜至PVDF膜上,5%脱脂奶粉封闭后加入相应稀释倍数的一抗(GRP78、caspase12 的抗体体积比分别为1∶1 000,1∶2 000),4℃孵育过夜。TTBS洗膜3次后加入相应的二抗工作液(兔抗羊IgG体积比为1∶1 000,马抗鼠IgG体积比为1∶2 000),室温孵育2 h,Immobilon-P试剂盒显影成像。用Quantity One软件分析蛋白条带的吸光度值,以目的条带的吸光度值/内参β-actin的吸光度值作为蛋白的相对表达量。
2.4 统计学处理
3 结果
3.1 YLSC对大鼠血清CK、LDH、AST含量的影响
由表1可知,与假手术组相比,模型组可以显著升高大鼠血清CK、LDH、AST的含量(P<0.01);与模型组比较,YLSC可以减少 I/R大鼠心肌 CK、LDH、AST的漏出(P<0.05或 P<0.01),且呈剂量依赖关系。
表1 YLSC对大鼠血清CK、LDH、AST含量的影响(n=10,±s)Tab.1 Effects of YLSC on contents of CK,LDH and AST in serum(n=10,±s)

表1 YLSC对大鼠血清CK、LDH、AST含量的影响(n=10,±s)Tab.1 Effects of YLSC on contents of CK,LDH and AST in serum(n=10,±s)
与假手术组比较:1 P<0.01;与模型组比较:2 P<0.05,3 P<0.01 1 P<0.01 vs sham group;2 P<0.05,3 P<0.01 vs model group
组 别 剂量/(mg/kg) CK/(u/L) LDH/(u/L) AST/(u/L)假手术组 -13.57±1.44 2308.7±270.4 285.6±39.2模型组 - 16.73±1.721 4516.3±572.61 958.6±102.71溶媒组 - 16.54±1.581 4538.9±453.01 1025.8±115.41 YLSC 低剂量组 2.50 14.66±1.552 3724.5±412.81,2 813.0±76.51,2 YLSC 高剂量组 5.00 14.27±1.532 3541.2±380.31,3 754.1±66.81,3
3.2 YLSC对I/R大鼠心肌梗死面积的影响
结果见表2。与模型组比较,YLSC可明显降低I/R 大鼠的IS/AAR(P<0.01)。
3.3 YLSC对I/R大鼠心肌细胞凋亡率的影响
结果见表2,图1。
阳性凋亡细胞核呈棕黄色,细胞核边集,染色质固缩,细胞体积变小;正常心肌细胞核呈蓝色。假手术组仅见个别散在的凋亡细胞;模型组假手术组比较,凋亡细胞明显增加(P<0.01);YLSC可以剂量依赖性的减少I/R大鼠的细胞凋亡率(与模型组比较:P<0.01)。
表2 YLSC对I/R大鼠心肌梗死面积和心肌细胞凋亡率的影响(n=10,±s)Tab.2 Effects of YLSC on infact size and apoptosis rate in rats with I/R injury(n=10,±s)
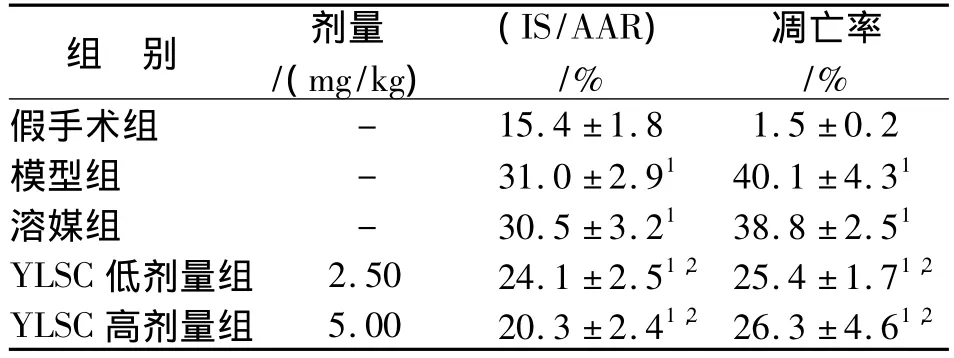
表2 YLSC对I/R大鼠心肌梗死面积和心肌细胞凋亡率的影响(n=10,±s)Tab.2 Effects of YLSC on infact size and apoptosis rate in rats with I/R injury(n=10,±s)
与假手术组比较:1 P<0.01;与模型组比较:2 P<0.011 P<0.01 vs sham group;2 P<0.01 vs model group
组 别 剂量/(mg/kg)(IS/AAR)/%凋亡率/%假手术组 - 15.4±1.8 1.5±0.2模型组 - 31.0±2.91 40.1±4.31溶媒组 - 30.5±3.21 38.8±2.51 YLSC 低剂量组 2.50 24.1±2.51,2 25.4±1.71,2 YLSC 高剂量组 5.00 20.3±2.41,2 26.3±4.61,2

图1 假手术组(A)、模型组(B)、溶媒组(C)、YLSC低剂量组(D)和YLSC高剂量组(E)大鼠心肌心肌细胞凋亡率变化(TUNEL法,×400)Fig.1 Comparison of apoptosis level in sham group(A),I/R group(B),vehicle group(C),YLSC 2.50mg/kg group(D)and YLSC 5.00mg/kg group(E)(TUNEL,×400)
3.4 YLSC对心肌GRP78和caspase12表达的影响
结果见图2。与假手术组比较,模型组GRP78和caspase12表达明显增加(P<0.01),给予 YLSC后,GRP78和caspase12表达量明显减少,且呈剂量依赖性(与模型组比较:P<0.05或P<0.01)。
4 讨论
心肌缺氧时,氧自由基生成,能量代谢障碍,使心功能受损。再灌注后活性氧大量生成,炎症介质释放,细胞内钙超载,使细胞膜损伤,完整性丧失,通透性增加,心肌酶漏出。心肌酶释放的多少可以作为心肌损伤的判断标准之一。另有研究认为,心肌梗死范围的大小可以作为评价药物心肌保护作用的金指标[4]。本实验结果显示,应用YLSC后,大量存在于心肌细胞中的CK、LDH、AST的漏出减少,心肌梗死面积减少,表明YLSC可减轻I/R所致的心肌细胞损伤,对缺血心肌具有保护作用。
内质网是分泌蛋白和膜蛋白的重要合成场所[5]。干扰内质网的功能,可使蛋白质发生错误折叠,未折叠蛋白(unfolded protein response,UPR)在腔内聚集,Ca2+平衡紊乱,造成内质网应激(endoplasmic reticulum stress,ERS)。UPR的目的是维持细胞内的平衡,但激烈和持续的ERS能导致细胞凋亡[6]。许多研究发现,I/R介导了ERS。大鼠心肌I/R模型[7]、H9c2细胞[8]、乳鼠心肌细胞[9]等均发现,I/R(或缺氧复氧处理)可导致内质网伴侣蛋白GRP78、caspase12等被特异性的激活,表达增多,活性上调,表明ERS在I/R的发生发展中起着重要的作用。
GRP78是内质网的应激蛋白,属热休克蛋白70家族中的一员,序列高度保守。机体缺氧时,氧化应激导致内质网蛋白折叠能力下降,蛋白合成遭到破坏,最终损伤细胞。GRP78可与内质网中未折叠的或错误折叠的蛋白结合,从而使与GRP78结合的3个UPR的敏感受体IRE1(the inositol-requiring enzyme l)、PERK(the PKR-like ER kinase)、ATF6(the activating transcription factor 6)从GRP78复合物中解离出来,引发UPR,促使机体对ERS作出反应,调节内质网钙稳态失衡的状态。故GRP78被认为是内质网稳态的“中心调节剂”,GRP78表达上调是ERS的标志之一[10]。caspase12在ERS时被特异性的激活[11],为ERS的标志因子,死亡受体途径和线粒体途径介导的细胞凋亡均不引起caspase12活化。caspase12激活后裂解为caspase3等下游效应蛋白,导致心肌细胞损伤,促发细胞凋亡。本实验发现,I/R诱导的大鼠细胞凋亡率明显增加,GRP78和caspase12表达明显增加,给予YLSC后,上述指标得到不同程度的改善,并呈一定的剂量依赖性。表明YLSC可以减轻 I/R诱导的ERS,减少心肌细胞凋亡。
综上所述,I/R可破坏心肌细胞,导致细胞坏死和凋亡,心肌酶漏出,促使 ERS蛋白GRP78、caspase12表达。YLSC能保护心肌细胞,对抗I/R引起的损伤,其心肌保护作用可能与抑制ERS蛋白GRP78、caspase12的表达有关。
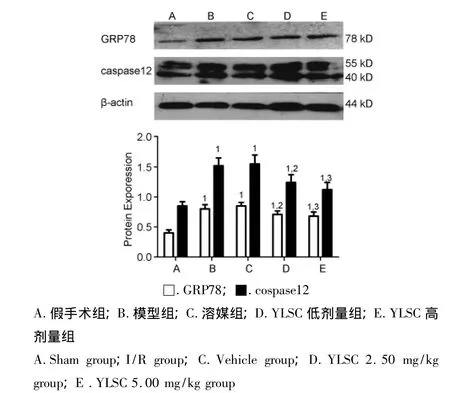
图2 YLSC对心肌蛋白GRP78和caspase12表达的影响(n=10,±s)Fig.2 Effect of YLSC on expression of GRP78 and caspase12 in cardiac myocytes(n=10,±s)
[1]广西壮族自治区卫生厅.广西中药材标准[S].南宁:广西科学技术出版社,1992:31-32.
[2]简 洁,张士军,邱 莉,等.壮药玉郎伞查尔酮类成分的研究[J].中国医院药学杂志,2010,30(20):1734-1737.
[3]简 洁.玉郎伞黄酮成分的单体分离与药效研究[D].南宁:广西医科大学,2009.
[4]Naderi R,Imani A,Faqhihi M,etal.Phenylephrine induces early and late cardioprotection through mitochondrial permeability transition pore in the isolated rat heart[J].J Surg Res,2010,164(1):e37-e42.
[5]Ron D.Translational control in the endoplasmic reticulum stress response[J].J Clin Invest,2002,110:1383-1388.
[6]Ferri K F,Kroemer G.Organelle-specific initiation of cell death pathways[J].Nat Cell Biol,2001,3:255-263.
[7]Wang Xinbao,Huang Xiaomei,Ochs T,etal.Effect of sulfur dioxide preconditioning on rat myocardial ischemia/reperfusion injury by inducing endoplasmic reticulum stress[J].Basic Res Cardiol,2011,106:865-878.
[8]Zhang P L,Lun Mingyue,Teng Jiamin,etal.Preinduced molecular chaperones in the endoplasmic reticulum product cardiomyocytes from lethal injury[J].Ann Clin Lab Sci,2004,34(4):449-456.
[9]马青变,高 炜,郭艳红,等.缺氧复氧诱导大鼠心肌细胞内质网应激反应[J].北京大学学报:医学版,2005,37(4):386-388.
[10]Lee A S.Mammalian stress response induction of the glucose-regulated protein family[J].Curr Opin Cell Biol,1992,4(2):267-273.
[11]胡国梁,何昆仑,范 利,等.衣霉素诱导乳鼠原代心肌细胞凋亡的实验研究[J].军医进修学院学报,2010,31(3):260.
