华蟾素诱导L1210细胞凋亡及作用机制的研究
2012-11-16刘伟
刘伟
华蟾素诱导L1210细胞凋亡及作用机制的研究
刘伟①
目的:探讨华蟾素对离体小鼠急性淋巴细胞白血病L1210细胞的作用。方法:将L1210细胞分为对照组及药物处理组。MTT实验检测细胞活性及增殖抑制情况;DNA 亲和染料Hoechst 33258荧光染色观察细胞核变化;Western Blot 检测细胞凋亡通路相关蛋白表达水平的改变。结果:华蟾素在0.25~1.0 μM浓度范围内即表现出显著的细胞生长增殖抑制,而且有时间和浓度依赖性;Hoechst 33258染色发现高浓度的华蟾素作用48 h,L1210细胞即表现出凋亡形态改变;Western Blot实验表明,细胞凋亡通路相关蛋白Caspase-3, Caspase-8, Caspase-9表达明显高于对照组。结论:华蟾素有诱导L1210细胞凋亡的作用。
华蟾素; L1210细胞; 细胞凋亡; Caspase-3
白血病是危害儿童最严重、发病率最高的恶性肿瘤。随着工业的发展,环境污染及工业材料的滥用,儿童白血病发病率逐年上升。目前,对儿童白血病的治疗仍缺乏有效的药物及治疗方案。探讨新型有效、低度诱导白血病细胞凋亡药物是当前白血病治疗领域的重要任务。中药素来以低毒优越于西药,所以,在众多中药品种中发现有潜在诱导白血病细胞凋亡、阻滞细胞增殖的药物应该是正确的方法。
华蟾素是中华大蟾蜍全皮的水溶性制剂,其化学成分复杂,具有低毒、抗癌谱广的优点。华蟾素制剂已经用于临床消化系统及妇科肿瘤的辅助治疗,增强了化疗药物的药理作用。华蟾素制剂用于血液系统肿瘤的研究较少,本文以L1210细胞为模型,研究华蟾素对L1210细胞的作用,并探讨其分子机制,为临床治疗血液系统肿瘤提供实验依据。
1 材料与方法
1.1 材料 小鼠急性淋巴白血病L1210细胞,购自中国科学院上海生化细胞研究所细胞库。
1.2 试剂 华蟾素注射液购自深圳市三九医药贸易有限公司;MTT及Hoechst33258购自Sigma公司;DMSO购自Amresco;Anti-Caspase-3, Caspase-8, Caspase-9, β-Actin antibody购 自 Santa Cruz;HRP-Goat anti-rabbit antibody 及ECL化学发光液购自普利莱基因有限公司。
1.3 方法
1.3.1 细胞增殖实验(MTT) 对数生长期细胞接种于96孔细胞培养板中,接种浓度1×104个/ml。边缘孔不加,除去边缘效应。细胞接种24 h后,加入含不同浓度华蟾素的培养液,华蟾素初始浓度100 μmol/L, 依次倍比稀释至终浓度 0.1 μmol/L,0.25 μmol/L,0.5 μmol/L,1.0 μmol/L,每个浓度无重复;对照组除不加华蟾素外其余均同加药组;分别培养 12 h, 24 h, 36 h,48 h 后每孔加入 20 μl MTT,37℃继续孵育4 h,扣板法去除培养液,每孔加入200 μl DMSO,振荡10 min直至蓝色结晶物完全溶解,立即用全自动酶标仪检测OD570值。
1.3.2 Hoechst 33258染色观察L1210细胞凋亡形态学变化对数生长期细胞L1210按1×104个/ml浓度接种于提前用多聚赖氨酸处理的盖片上。不同浓度的华蟾素处理48 h后,倾去培养液,加入预冷PBS洗涤细胞2次;加入4%多聚甲醛4℃固定5 min;调整Hoechst 33258染液浓度至终浓度5 μg/ml,37 ℃避光染色15 min;弃去染液,在荧光显微镜下观察拍摄。
1.3.3 Western Blot检测细胞凋亡通路相关蛋白表达水平的改变 对数生长期细胞接种至100 mm培养皿中,培养过夜后加入不同浓度的华蟾素继续培养48 h。终止培养,加入冰预冷PBS洗两次,细胞刮收集细胞。加入细胞裂解液50 mmol/L Tris-HCl (pH7.5),0.3 mol/L NaCl, 1% NP-40,0.1%去氧胆酸钠,0.1% SDS, 1 mmol/L EDTA , 50 mmol/L 氟化钠,1 mmol/L 偏矾酸钠;抑肽酶 20 μg/ml, 亮肽酶 10 μl/ml,(均购自 Amresco 公司 ),100 mmol/L PMSF( 购自 Sigma 公司 )。冰浴裂解30 min;16 000 g,4 ℃离心30 min,收集上清并加入loading buffer,震荡混匀95℃水浴5 min。细胞总蛋白经10 %SDS-PAGE电泳分离后,转移至PVDF膜;经5%脱脂奶粉室温封闭1 h后,加入一抗,4℃孵育过夜,PBST洗3次,每次5 min;加入二抗,室温孵育1 h,PBST洗3次,每次5 min;然后加入ECL化学发光液,X光片暗室曝光、显影及定影。
2 结果
2.1 华蟾素对L1210细胞增殖的抑制作用 采用MTT法检测不同浓度华蟾素对L1210细胞增殖抑制作用。从图1可见,对数生长期L1210细胞加入华蟾素后均有不同程度的增殖抑制作用,随着华蟾素浓度的增加,L1210细胞增殖抑制作用逐渐增加。而且,当同一华蟾素浓度作用时间逐渐延长时,对L1210抑制作用逐渐增强。

图1 不同浓度的华蟾素作用不同时间对L1210细胞活力的影响
2.2 华蟾素对L1210细胞诱导凋亡形态学变化 不同浓度华蟾素作用L1210细胞48 h后,细胞经DNA亲和染料Hoechst33258染色后发现,华蟾素作用细胞48 h,细胞发生了典型的凋亡形态学改变,表现为细胞皱缩、细胞核凝集、核碎片化(见图2)。
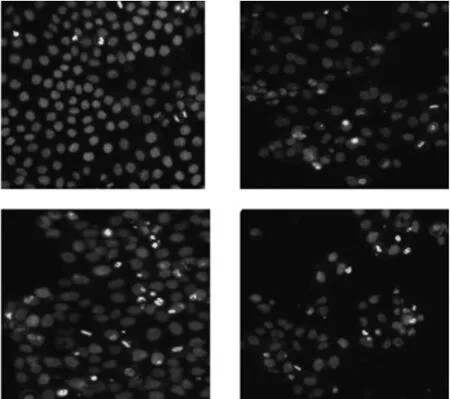
图2 华蟾素对L1210细胞形态恋化的影响
2.3 华蟾素诱导L1210细胞凋亡通路相关蛋白表达水平的改变 不同浓度华蟾素作用L1210细胞48 h后,Western Blot检测细胞凋亡通路相关蛋白表达水平的改变。图3所示,华蟾素能明显诱导L1210细胞Caspase-3,Caspase-8,Caspase-9表达增高,提示L1210细胞经华蟾素作用后发生了凋亡。
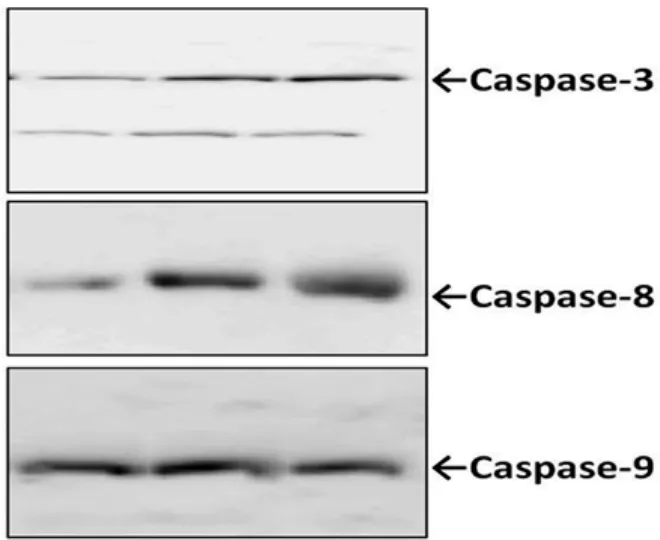
图3 华蟾素对细胞凋亡信号通路相关蛋白表达的影响
3 讨论
华蟾素应用于肿瘤治疗已有多年的历史。华蟾素抗肿瘤作用的机制主要有细胞毒性作用,直接作用于细胞DNA[1-2];启动细胞免疫机制增强宿主细胞免疫能力及特异性抗原杀伤能力[3-4];诱导肿瘤细胞凋亡作用[5];抑制肿瘤细胞血管生成作用[6-7]。华蟾素诱导肿瘤细胞凋亡的作用在肝癌细胞及胃癌细胞中均见报道[8-9],但具体凋亡发生机制还不清楚。
笔者首先使用不同浓度华蟾素作用L1210细胞不同时间,MTT实验检测细胞活性及增殖抑制情况,结果发现细胞活性明显低于对照组,说明华蟾素具有抑制L1210细胞增殖的作用。多种因素可以使细胞增殖发生抑制,比如细胞毒性、细胞自噬及坏死,细胞周期阻滞及细胞凋亡等。为进一步检测L1210细胞增殖阻滞的分子机制,笔者首先观察了细胞形态学改变。细胞形态学变化比较客观地显示了细胞经华蟾素作用后发生了凋亡变化。即表现出细胞皱缩、细胞核凝聚、细胞核片段化改变等典型的凋亡形态学改变。Western Blot进一步从蛋白分子水平上表明经华蟾素作用,L1210细胞凋亡通路相关蛋白Caspase-3, Caspase-8, Caspase-9表达水平增高,Caspase 是一个含有半胱氨酸活性的胞质蛋白酶家族,迄今至少发现14 个成员。Caspase-3 是目前发现的细胞凋亡过程中激活的关键酶,也是细胞凋亡的主要效应分子[10],Caspase-3激活后继续激活一系列凋亡蛋白,使细胞发生不可逆性凋亡。所以这说明,华蟾素作用L1210细胞后细胞发生了凋亡。
发现新型抗癌活性高、毒副作用小的抗肿瘤药物一直是肿瘤治疗领域的重要任务。本实验充分证明,华蟾素在低浓度时及能诱导L1210细胞发生Caspase依赖性凋亡,为临床应用华蟾素治疗儿童白血病提供了一定的理论依据。
[1] 张静.华蟾素联合化疗治疗晚期恶性肿瘤的疗效分析[J].肿瘤,2000,20(5):379-381.
[2] 张莉.华蟾素诱导U937细胞凋亡及其作用机制[J].肿瘤,2007,27(5):341-344.
[3] 王新艳,李玉华,朱谥豢,等.卵巢癌组织KLKⅡ基因的表达意义[J].第四军医大学学报,2006,27(22):2023-2025.
[4] 王玉霞,程志强,贾立群.华蟾素提高晚期恶性肿瘤患者抗感染能力的临床观察[J].中日友好医院学报,2001,15(2):102-103.
[5] 蒋淑莲,文剑,杜建霞.华蟾素增强细胞因子诱导的杀伤细胞对肝癌细胞的杀伤活性[J].中国生化药物杂志,2007,28(3):164-166.
[6] 王玲,刘世坤,周于禄,等.华蟾素对人乳腺癌细胞阿霉素耐药性的逆转作用[J].中国药理学通报,2007,23(5):677-680.
[7] 左小东,崔永安,秦叔奎,等.华蟾素对肿瘤细胞周期及bcl-2蛋白表达的影响[J].现代中西医结合杂志,2003,12(6):567-568.
[8] 吴万垠,柴小妹,刘伟胜.华蟾素联合长春瑞滨对小鼠Lewis肺癌细胞周期的影响[J].中国癌症杂志,2004,14(4):363-365.
[9] 韩仲明,苏红星,黄晋生,等.华蟾素对喉癌细胞生长及癌基因表达的影响[J].中国中西医结合杂志,2001,21(特集):126-127.
[10] Weng C,Li Y. Specific cleavage of Mcl-1 by caspase-3 in tumor necrosis factor-related apoptosis-inducing ligand ( TRAIL) -induced apoptosis in Jurkat leukemia T cells[J].J Biol Chem,2005,280(11):1049.
10.3969/j.issn.1674-4985.2012.24.008
①河南省新蔡县人民医院 河南 新蔡 463500
刘伟
2012-04-05) (本文编辑:车艳)
