术后肠内免疫营养支持在营养不良的胃肠道肿瘤患者中的应用研究
2012-11-16刘建中张金生兰涛陈辉王丛梅
刘建中 张金生 兰涛 陈辉 王丛梅
术后肠内免疫营养支持在营养不良的胃肠道肿瘤患者中的应用研究
刘建中①张金生①兰涛①陈辉①王丛梅①
目的:探讨术后肠内免疫营养支持疗法在伴有营养不良的胃肠道肿瘤患者中的应用价值。方法:依据标准选择研究对象,对112例营养不良的胃肠道恶性肿瘤患者分别采取肠内免疫营养支持(观察组)和普通肠内营养支持(对照组)方式进行治疗,观察对比两组患者的免疫学检测指标以及不良反应发生率、并发症发生情况以及平均住院时间。结果:术后1 d,患者的淋巴细胞、NK细胞、CD3、CD4、CD4/ CD8、IgA、IgG、IgM、IgE、C3、C4、CH50免疫学指标与术前比较明显下降,且差异具有统计学意义(P<0.05)。术后9 d,观察组淋巴细胞、NK细胞、CD3、CD4、CD4/CD8、C3、C4、CH50几项指标回升幅度明显高于对照组,差异有统计学意义(P<0.05);同时,观察组CRP迅速下降,明显低于对照组,差异有统计学意义(P<0.05)。观察组不良反应发生率低于对照组,但差异无统计学意义(P>0.05);观察组并发症发生率明显低于对照组,且差异有统计学意义(P<0.05);观察组平均住院天数为(8.6±1.4)d,对照组为(10.2±1.1)d,两组比较差异有统计学意义(P<0.05)。结论:对于合并营养不良的胃肠道恶性肿瘤患者,选择肠内免疫支持疗法进行治疗具有较高的应用价值;与普通肠内营养治疗相比,在恢复机体免疫功能、减少术后并发症及缩短平均住院时间等方面更具优势。
肠内免疫营养支持; 消化道肿瘤; 免疫功能; 胃肠道恶性肿瘤
胃肠道肿瘤患者常伴有严重的营养不良,尤其是恶性胃肠道肿瘤患者,存在营养不良的同时往往还存在免疫抑制,为了保证胃肠道恶性肿瘤患者术后机体各方面功能能够迅速恢复,常于术后早期进行肠内营养支持治疗,然而对于伴有营养不良的胃肠道恶性肿瘤患者而言,仅进行普通的肠内营养治疗常难以达到改善机体免疫功能、促进患者早期恢复的目的。
免疫营养支持疗法是近年来在肠内营养治疗的基础上发展起来的一种营养支持手段,在进行普通肠内营养治疗的同
时,补充具有药理学作用的特殊营养物质,如精氨酸、谷氨酰胺、ω-3多不饱和脂肪酸等。通过刺激免疫细胞,增强免疫应答功能,从而维持机体正常的免疫反应,扭转对机体组织和器官的生理功能的损害,同时保护肠屏障功能完的整性,减少细菌移位[1]。本研究对112例营养不良的胃肠道肿瘤患者分别采取肠内免疫营养支持和普通肠内营养支持方式进行治疗,以探讨术后肠内免疫营养支持在营养不良的胃肠道肿瘤患者中的应用价值。
1 资料与方法
1.1 一般资料 选择2008年8月-2011年8月笔者所在医院收治的营养不良胃肠道肿瘤患者,经病理证实为胃肠道恶性肿瘤,同时经主观综合性营养评估法证实术前合并营养不良,且行肿瘤根治性切除手术。排除术前存在胃潴留或肠梗阻者,合并内分泌、代谢及免疫系统疾病或伴有感染性疾病者;排除有严重心、肺、肝及肾功能障碍者;晚期肿瘤患者亦不作为研究对象[2]。经上述入选及排除标准筛选后,本研究共入选患者112例,按照随机原则将112例患者分为肠内免疫营养组(观察组)和普通肠内营养组(对照组),各56例。观察组患者男31例,女25例,年龄27~67岁,平均(56.60±9.80)岁;体重下降5~12 kg,平均(7.3±1.7)kg;血红蛋白、总蛋白、白蛋白均值分别为(9.18±1.50)g/L、(55.90±1.75)g/L、(32.90±1.60)g/L;手术方式分别为直肠癌根治术17例、胃癌根治术24例、结肠癌根治术15例;手术时间(220±35)min;术中失血量为(250±57)ml。对照组患者男33例,女23例,年龄28~69岁,平均(55.90±9.40)岁;体重下降4~13 kg,平均(6.9±1.8)kg;血红蛋白、总蛋白、白蛋白均值分别为(9.15±1.45)g/L、(56.05±1.60)g/L、(33.10±1.40)g/L;手术方式分别为直肠癌根治术18例、胃癌根治术23例、结肠癌根治术15例;手术时间(210±40)min;术中失血量为(245±60)ml。两组患者一般资料及病情差异无统计学意义(P>0.05),具有可比性。
1.2 营养支持方法 两组患者分别于术后进行肠内免疫营养支持和普通肠内营养支持治疗,其中结直肠癌患者术中置入鼻胃营养管,而胃癌患者于术中放置鼻肠营养管或空肠造瘘管。具体治疗方案如下。
1.2.1 观察组 采取肠内免疫营养支持疗法进行治疗。术后第2天开始输入瑞能(华瑞公司生产),术后2~3 d减量至初始剂量的1/2,热量为62.5 kJ/(kg·d),含氮量为0.175 g/(kg·d);采用恒速泵经鼻胃营养管、鼻肠营养管或空肠造瘘管持续输注,滴速从20 ml/h开始,6~8 h递增20 ml/h(根据患者的耐受情况决定),通过静脉补充不足液量及热量[2]。从第4天开始,输入全量瑞能,热量为125 kJ/(kg·d),含氮量为0.35 g/(kg·d);滴速为125~150 ml/h,连续应用7 d[2]。
1.2.2 对照组 对照组患者采取普通肠内营养支持疗法进行治疗。术后第2天开始输入瑞素(华瑞公司生产),治疗剂量、方法、疗程与观察组相同。为了保证两组患者氮的摄入量相等,在应用瑞素的同时添加纽崔莱蛋白质粉(安利公司生产),2.5 g/100 ml[2]。两种制剂成分见表1。

表1 两组患者应用不同营养制剂成分表(每100 ml)
1.3 观察及检测指标
1.3.1 临床观察项目 观察患者治疗期间及治疗后有无恶心、呕吐,腹胀、腹痛以及腹泻等不良反应,了解患者有无肠梗阻、肠瘘等并发症,并观察患者有无术后感染,统计患者平均住院时间。
1.3.2 检测指标 于术前5 d、术后1 d和术后9 d清晨抽取患者的静脉血,应用流式细胞计数仪检测外周血淋巴细胞总数、T淋巴细胞亚群CD3、CD4、CD8、CD4/CD8,免疫球蛋白IgG、IgM、IgA、IgE水平采用酶联免疫法进行检测,前列腺素E2(PGE2)的浓度采用放射免疫分析法进行检测,α1抗胰蛋白酶、C反应蛋白(CRP)和纤维蛋白原采用特殊蛋白质测定仪进行检测,C3、C4和CH50采用比浊法和50%溶血实验法进行检测。
1.4 统计学处理 采用统计学软件SPSS 11.0对所得数据资料进行统计分析,计量资料以(±s)表示,采用t检验,计数资料采用 字2检验,P<0.05为差异有统计学意义。
2 结果
2.1 临床观察结果比较 观察组发生恶心、呕吐1例,腹痛、腹泻2例,不良反应发生率为5.36%;对照组发生恶心、呕吐2例,腹胀、腹痛、腹泻2例,不良反应发生率为7.14%,两组患者在调整营养液滴注速度之后均得以缓解,不良反应发生情况比较差异无统计学意义(P>0.05)。观察组发生肠梗阻1例,术后感染2例,并发症发生率为5.36%;对照组发生肠梗阻2例,术后感染5例,并发症发生率为12.5%,两组比较差异有统计学意义(P<0.05)。观察组平均住院(8.6±1.4)d,对照组(10.2±1.1)d,两组比较差异有统计学意义(P<0.05)。
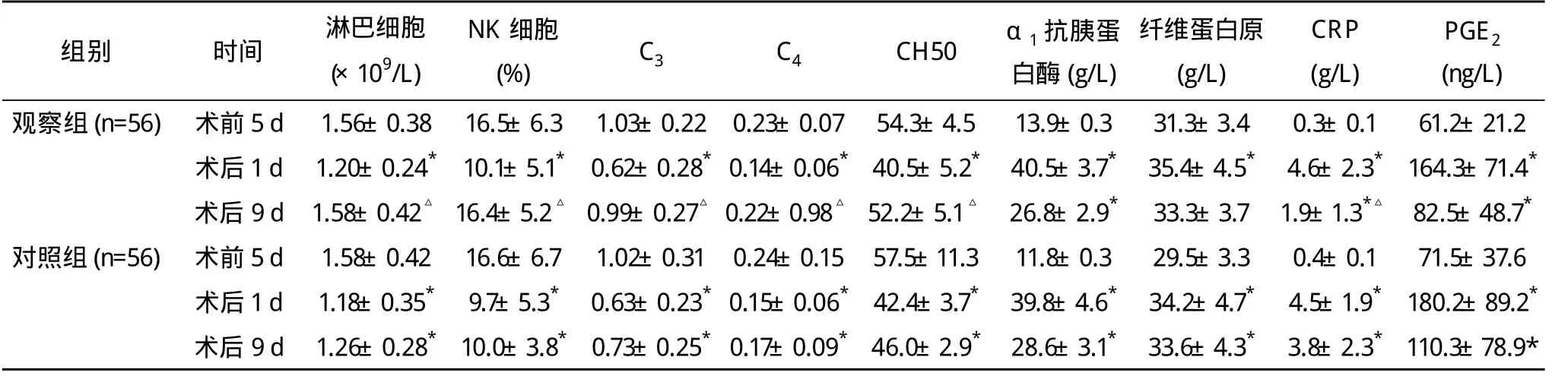
2.2 检测指标结果比较 术后1 d,患者的淋巴细胞、NK细胞、CD3、CD4、CD4/CD8、IgA、IgG、IgM、IgE、C3、C4、CH50免疫学指标与术前比较明显下降,差异有统计学意义(P<0.05);术前及术后1 d,两组比较,差异均无统计学意义(P>0.05)。术后9 d,两组患者上述指标有不同程度的回升,其中观察组淋巴细胞、NK细胞、CD3、CD4、CD4/CD8、C3、C4、CH50已回升接近正常水平,回升幅度明显高于对照组,差异有统计学意义(P<0.05)。
术后1 d,患者的PGE2、α1抗胰蛋白酶、CRP和纤维蛋白原与术前比较显著升高,差异有统计学意义(P<0.05);术前及术后1天,两组比较,差异均无统计学意义(P>0.05)。术后9 d,两组患者上述指标有不同程度的下降,其中观察组CRP明显低于对照组,差异有统计学意义(P<0.05)。见表2。
表2 两组患者术前及术后1、9 d各检测指标比较(±s)

表2 两组患者术前及术后1、9 d各检测指标比较(±s)
组别 时间 CD3(%) CD4(%) CD8(%) CD4/CD8 lgG(g/L) lgA(g/L) lgM(g/L) lgE(IU/ml)观察组(n=56) 术前5 d 60.2±3.6 30.8±3.5 26.8±1.7 1.15±0.12 13.4±1.7 2.68±0.50 1.11±0.27 70.2±82.1术后1 d 54.4±3.8* 26.9±5.8* 29.0±2.1* 0.88±0.10* 10.1±1.6* 1.27±0.31* 0.72±0.13* 68.1±79.2术后9 d 56.7±3.2 32.0±5.2△ 27.4±1.8 1.12±0.12△ 12.4±1.7△ 1.97±0.29 1.15±0.27 86.3±71.0对照组(n=56) 术前5 d 58.7±6.5 31.2±5.2 27.0±1.5 1.01±0.11 12.5±2.1 2.47±0.39 1.09±0.22 100.8±63.0术后1 d 54.3±5.7* 25.1±3.0* 29.5±2.3* 0.86±0.18* 8.8±1.4* 1.19±0.21* 0.69±0.12* 98.2±60.3术后9 d 55.1±4.3 27.8±4.7* 28.3±1.6 0.89±0.09* 11.4±1.4 1.86±0.31 1.10±0.18 111.2±26.1
续表2
3 讨论
由于易出血和摄食减少,消化道恶性肿瘤患者常伴有营养不良,同时因肿瘤可释放免疫抑制因子,使宿主免疫力急剧降低,从而发生免疫抑制。当患者进行手术治疗时,因此而造成的创伤和应激则加重了营养不良和免疫抑制。
营养不良是导致肿瘤患者术后发生并发症的重要危险因素之一,及早地纠正和改善营养不良,是提高临床疗效、改善患者预后的重要措施。营养支持疗法一直被认为是外科手术患者围手术期治疗的重要手段[3]。随着近年来对胃肠道肿瘤的进一步研究发现,普通的营养支持疗法不能够满足手术患者在改善免疫抑制状况治疗方面的需求[4-6],而肠内免疫支持疗法则应运而生,并在此方面彰显其优势,越来越受到广大临床医生的认可。
瑞能是一种肠内免疫营养剂,近年来应用于胃肠道肿瘤患者的治疗中,并取得了不错的疗效。其组成特点是高蛋白、高脂肪含量,以及高热量密度;其组成成分不仅包括蛋白质、脂肪、碳水化合物、多种维生素,还富含精氨酸、谷氨酸、ω-3多不饱和脂肪酸及核苷酸。研究表明,ω-3多不饱和脂肪酸以和核苷酸可通过免疫增强作用,提高肿瘤患者的免疫功能;ω-3多不饱和脂肪酸能够治疗肿瘤恶液质,实现抑制肿瘤生长的效果,同时还可以使免疫抑制物PGE2的产生得到抑制[7-8],从而促进患者康复。有研究报道,消化道肿瘤患者围手术期使用富含精氨酸、核苷酸等的免疫营养制剂,可迅速恢复患者的免疫功能,并控制过度炎性反应,进而降低感染等并发症的发生率;此外,因住院时间的缩短,治疗费用也得到相应的降低[9-10]。
本研究中观察组的疗效明显优于对照组,研究结果显示,术后1 d,患者的淋巴细胞、NK细胞、CD3、CD4、CD4/ CD8、IgA、IgG、IgM、IgE、C3、C4、CH50免疫学指标与术前比较明显下降,且差异具有统计学意义(P<0.05),这说明手术创伤对患者所造成代谢改变严重影响了患者的免疫功能,增强了免疫抑制作用。而术后9 d,尽管两组患者上述指标均有不同程度的回升,但观察组大部分指标回升更为明显,回升幅度明显高于对照组,差异有统计学意义(P<0.05),这说明肠内免疫营养支持疗法能够有效改善免疫抑制,使机体恢复正常的免疫功能。术后9 d,两组患者PGE2、α1抗胰蛋白酶、CRP和纤维蛋白原几项指标有不同程度的下降,其中观察组CRP显低于对照组,差异有统计学意义(P<0.05)。与此同时,临床观察结果显示,观察组不良反应发生率低于对照组,但差异无统计学意义(P>0.05);观察组并发症发生率明显低于对照组,且差异有统计学意义(P<0.05);观察组平均住院天数为(8.6±1.4)d,对照组为(10.2±1.1)d,两组比较差异有统计学意义(P<0.05),结果表明,瑞能与瑞素相比在同样控制不良反应发生率的同时能够明显降低并发症的发生率,缩短住院时间,提高胃肠道恶性肿瘤患者的整体疗效,说明肠内免疫营养支持治疗对于伴有营养不良的胃肠道恶性肿瘤患者更具优势。
综上所述,对于合并营养不良的胃肠道恶性肿瘤患者而言,选择肠内免疫支持疗法进行治疗,对于改善患者营养状况,恢复机体免疫功能,减少术后并发症的发生均具有重要作用,同时还能够缩短平均住院时间,具有较高的应用价值。
[1] 赵永亮,余佩武,兰远志,等.肠内营养对胃癌患者为手术期恢复的影响[J].重庆医学,2008,53(12):98-99.
[2] 刘建中,兰涛,张金生,等.合并营养不良的胃肠道恶性肿瘤患者术后应用肠内免疫营养的临床研究[J].中华胃肠外科杂志,2011,14(10):59-62.
[3] 黎介寿.肠内营养-外科临床支持的首选途径[J].中国临床营养杂志,2003,11(3):171-172.
[4]李立涛,赵春临,朱阿丽,等.营养不良的胃癌患者术后肠内营养与肠外营养效果的比较[J].郑州大学学报(医学版),2007,42(3):570-571.
[5] Cynber L. Immune enhancing diets for stressed patients with a special emphasis on arginine content: analysis of the analysis[J]. Curr Opin Clin Nutr Metab Care,2003,6(2):189-193.
[6] 陈红,贾建国,李非,等.消化道恶性肿瘤术后早期肠内与肠外营养治疗的比较[J].中国临床营养杂志,2004,12(3):181-185.
[7] 吴国豪,王浩,张延伟,等.消化道肿瘤手术后早期应用免疫增强型肠内营养的作用[J].肠外与肠内营养,2003,10(1):8-14.
[8] 陈亚军,齐玉梅.精氨酸免疫营养作用的研究进展[J].中国临床营养杂志,2007,15(5):310-314.
[9] Braga M, Gianotti L, Nespoli L, et al. Nutritional approach in malnourished surgical patients[J]. Arch Surg,2002,137(2):174-180.
[10] Heyland D K. Parenteral nutrition in the critically ill patient: more harm than good?[J]. Proc Nutr Soc,2000,59(3):457-466.
Applied Research of Enteral Immune and Nutritional Support in Malnourished Patients with Gastrointestinal Cancer
/LIU Jian-zhong,ZHANG Jin-sheng, LAN Tao, et al.
Objective: To explore the application value of enteral immune and nutritional support in gastrointestinal cancer patients with malnutrition. Method: The subjects, selected according to the standard enteral immune and nutritional support(study group) and ordinary enteral nutrition(control group) to treatment of 112 cases of malnutrition in patients with malignant tumors of the gastrointestinal tract swelling, were taken to observe the two groups. To compare the patients with immunological detection of indicators, and incidence of adverse reactions, complications and the average length of stay. Result: The postoperative 1 day, the patient’s lymphocytes, NK cells, CD3, CD4 and CD4/CD8, IgA, and IgG and IgM,IgE, C3, C4, and of CH50 immune markers compared with preoperative decreased, and the difference was statistically significance(P<0.05). 9 days of postoperative, lymphocytes, NK cells, CD3, CD4, CD4/CD8, C3, C4, and of CH50 several indicators of recovery rate in study group was significantly higher than control group, the difference was statistically significant(P<0.05), the CRP in study group was lower than the control group, the difference was statistically significant(P<0.05). The incidence of adverse reactions in study group was lower than the control group, but the difference was not statistically significant(P>0.05). The incidence of complications in study group was significantly lower than the control group, and the difference was statistically significant(P<0.05). The average hospital days were (8.6±1.4)days in study group, the control group were (10.2±1.1)days, the difference was statistically significant in the two groups(P<0.05). Conclusion: Enteral immune and nutritional support has a high value for the merger malnourished patients with gastrointestinal cancer, compared with enteral nutrition therapy, restoring immune function and reduce postoperative concurrent disease and shorten the average length of stay more competitive.
Enteral immune and nutritional support; Gastrointestinal tumors; Immune function; Gastrointestinal malignancies
Hebei Cangzhou People’s Hospital, Cangzhou 061000, China
//Medical Innovation of China,2012,9(24):001-003
10.3969/j.issn.1674-4985.2012.24.001
①河北省沧州市人民医院 河北 沧州 061000
刘建中
2012-06-09) (本文编辑:王宇)
