新疆红枣多糖酶法提取工艺研究
2012-11-15吴洪斌王永刚刘成江王俊刚赵志永金新文
吴洪斌,王永刚,刘成江,王俊刚,赵志永,金新文,*
(1.新疆农垦科学院农产品加工研究所,新疆石河子832000;2.鹤壁职业技术学院,河南鹤壁458030)
新疆红枣多糖酶法提取工艺研究
吴洪斌1,王永刚2,刘成江1,王俊刚1,赵志永1,金新文1,*
(1.新疆农垦科学院农产品加工研究所,新疆石河子832000;2.鹤壁职业技术学院,河南鹤壁458030)
以新疆红枣为原料,利用纤维素酶对红枣多糖进行提取,通过响应面设计优化最佳提取工艺,旨在提高红枣多糖提取含量。实验证明,酶添加量0.85mg/mL、酶解时间60min、酶解温度50.0℃、液料比10∶1为红枣多糖最佳提取条件,其多糖提取含量达7.71%。通过对上述各种因素的优化,确定了红枣多糖的最佳提取条件,为相关生产加工企业提供一定的参考依据和理论支持。
红枣,多糖,纤维素酶,提取工艺
红枣(Zizyphus Jujube Mill)又名大枣、华枣,是鼠李科枣属植物枣树的果实。红枣原产于我国,是我国的特产果品,栽培面积及产量均占世界的90%以上[1]。红枣营养丰富,富含糖类、粗纤维、维生素、氨基酸、矿物质等营养成分,具有多种营养保健功能[2]。多糖(Polysaccharide)又称多聚糖,是由单糖聚合而成的高分子化合物,广泛存在于动植物的组织中。目前有相关研究表明,红枣多糖可提高小鼠血液、肝脏及脑组织中超氧化物歧化酶(SOD)及过氧化氢酶(CAT)活性[3];可使运动小鼠部分组织的抗氧化酶活性发生不同程度的良性变化,减少自由基生成,提高机体免疫力[4];硫酸化修饰可显著增强红枣多糖对超氧化物阴离子、羟自由基、DPPH自由基的清除作用[5];另外红枣多糖还具有较强的抗肿瘤、抗氧化、抗衰老、降血糖、降血脂等作用[6-10]。由上述研究结果可以看出,红枣多糖在改善人体生理功能方面起到至关重要的作用。因此,进行提取红枣多糖工艺研究,确定其最佳工艺参数,进而提高红枣多糖的含量,具有重要的意义。本实验通过研究红枣多糖的提取工艺,对酶添加量、酶解时间、酶解温度及液料比等因素进行优化,确定红枣多糖最佳提取工艺,为相关生产加工企业提供一定的参考依据和理论支持。
1 材料与方法
1.1 材料与仪器
红枣 产自新疆阿克苏农一师,红枣经挑选、水洗后,放置在真空干燥箱中60℃干燥12h,去核后粉碎至粒度为80目的粉末,作为原料待用;无水乙醇、丙酮、浓盐酸、氢氧化钠、浓硫酸、苯酚 天津市风船化学试剂科技有限公司;纤维素酶 sigma公司;以上普通试剂 均为分析纯;酶 均为生化试剂。
DZF-6050真空干燥箱 上海鸿都电子科技有限公司;SHHW21.600AⅡ三用电热恒温箱 天津市泰斯特仪器有限公司;LGJ-18S冷冻干燥机 北京松源华兴科技发展有限公司;TGL-10B高速离心机 上海安亭科学仪器厂;BS223S型电子天平 北京赛多利斯仪器系统有限公司;SHZ-Ⅲ型循环水真空泵、RE-52AA旋转蒸发器 上海亚荣生化仪器厂;PHSJ-3F实验室pH计、752N紫外可见分光光度计 上海精科。
1.2 实验方法
1.2.1 红枣多糖提取工艺 红枣粉→酶法浸提→灭酶→抽滤残渣→减压浓缩→乙醇沉淀多糖→冷冻干燥→红枣粗多糖→复溶→脱色→脱蛋白→乙醇沉淀多糖→冷冻干燥→精制多糖
1.2.2 葡萄糖标准曲线的绘制 准确称取在105℃烘干至恒重的分析纯葡萄糖0.01g,配制成0.1mg/mL的葡萄糖标准溶液。分别移取上述葡萄糖标准液1、2、3、4、5、6mL放置于10mL容量瓶中,用蒸馏水定容至刻度,得到不同浓度梯度的葡萄糖溶液。分别移取1mL上述溶液置于10mL具塞试管中,依次加入5%苯酚溶液1.0mL及5mL浓硫酸。充分混合后置于100℃水浴中,静置30min。取出迅速冷却至室温,在490nm处进行比色。以浓度为横坐标,以吸光度值为纵坐标绘制标准曲线,得到标准曲线方程为:y=0.0067x+0.0002,R2=0.9988。
1.2.3 红枣多糖提取工艺单因素实验 通过参考大量相关文献和进行预实验,选择适宜的因素水平进行单因素实验,除待定因素外,其他参数均为最优水平:液料比为10∶1,酶解温度为50℃,酶解时间为60min,酶添加量为0.9mg/mL,结果以红枣多糖提取率为评判标准。其方法如下:酶添加量:液料比10∶1,酶解温度50℃,酶解时间为3h,酶添加量分别为0.6、0.9、1.2、1.5mg/mL,实验重复3次;酶解时间:液料比为10∶1,酶解温度为50℃,酶添加量为0.9mg/mL,酶解时间分别为20、40、60、80min,实验重复3次;酶解温度:液料比为10∶1,酶添加量为0.9mg/mL,酶解时间为3h,酶解温度分别为30、40、50、60℃,实验重复3次;液料比:酶解温度为50℃,酶添加量为0.9mg/mL,酶解时间为3h,液料比分别为6∶1、8∶1、10∶1、12∶1,实验重复3次。
1.2.4 红枣多糖提取工艺响应面实验 根据Design-Expert 7.0软件Box-Behnken的组合实验设计原理,确定响应面设计每个因子的适宜范围。在单因素实验基础(酶添加量0.9mg/mL,酶解时间60min,酶解温度为50℃,液料比为10∶1)上,选取酶添加量(A,mg/mL)、酶解时间(B,min)、酶解温度(C,℃)、液料比(D,mL/g)四因素为自变量,各自变量的低、中、高实验水平分别以-1,0,1编码,因素及水平编码见表1。

表1 响应面实验水平及编码设计Table 1 Level and code of variables of response surface method
1.2.5 测定方法 多糖的测定方法:采用苯酚硫酸法[11]进行测定(多糖含量以葡萄糖计)。
多糖提取率(%)=(提取液中多糖的含量/红枣干物质)×100%
1.2.6 数据统计分析 所有数据均做平行实验,采用Design-Expert 7.0数据处理软件,进行响应面数据分析,P<0.05为具有显著性差异。
2 结果与分析
2.1 红枣多糖单因素实验结果分析
通过上述实验操作,得到各因素影响如图1所示。
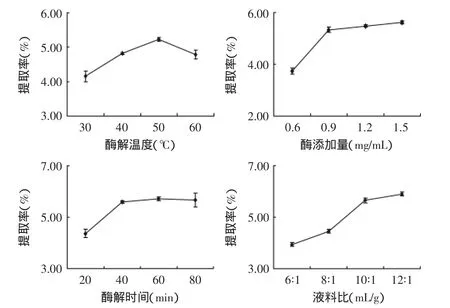
图1 各因素对红枣多糖提取率的影响Fig.1 Effect of different factors on extract yield
通过对上述单因素结果分析可知,随着酶解温度的增加,红枣多糖含量呈现先升高后降低的趋势,在50℃时达到最大。红枣多糖提取率在50℃后开始下降是由于温度升高导致酶活性降低,酶促作用受到抑制,从而引起提取率下降,因此,选择酶解温度为50℃较为合适;随着液料比的增加,红枣多糖提取率呈现上升趋势,但是在10∶1之后,上升趋势变缓,从经济成本角度分析,选择液料比10∶1较为合适;在酶添加量为0.6~0.9mg/mL时,随着酶添加量的增加,多糖提取率呈现上升趋势,当添加量>0.9mg/mL时,提取率增加平缓。可能由于当酶添加量为0.9mg/mL时,底物已与酶结合完全,酶添加量的增加不会改变底物与酶的结合状况。考虑到酶添加量的增加将会增加成本,选择酶添加量为0.9mg/mL较为合适;随着酶解时间的增加,红枣多糖含量呈现上升趋势,60min以后上升趋势不明显。分析是由于60min以后酶与底物已充分反应。为减少因酶解时间增加而带来的能源浪费,提高效率,综合提取率及成本考虑,选择60min较为合适。通过上述分析,单因素筛选出各因素的最佳条件分别为酶添加量0.9mg/mL、酶解时间60min、酶解温度为50℃、液料比为10∶1。
2.2 响应面结果分析
本次共29个实验,1~24个实验是析因实验,25~29是中心实验。其中析因点为自变量,取值在由四个因素构成的三维顶点;0点为区域的中心点,0点实验重复5次,用来估算实验误差。对酶添加量、酶解时间、酶解温度、液料比进行编码,以红枣多糖提取率为响应值,实验方案及结果见表2。
2.2.1 效应模式的选择 选择何种效应模式对实验数据进行统计分析,是得到最适当的相应曲面模型的关键步骤,对实验数据进行线性(Linear)、两因子交互作用(2FI)和二阶效应(Quadratic)三种模式的方差分析,结果如表3所示。
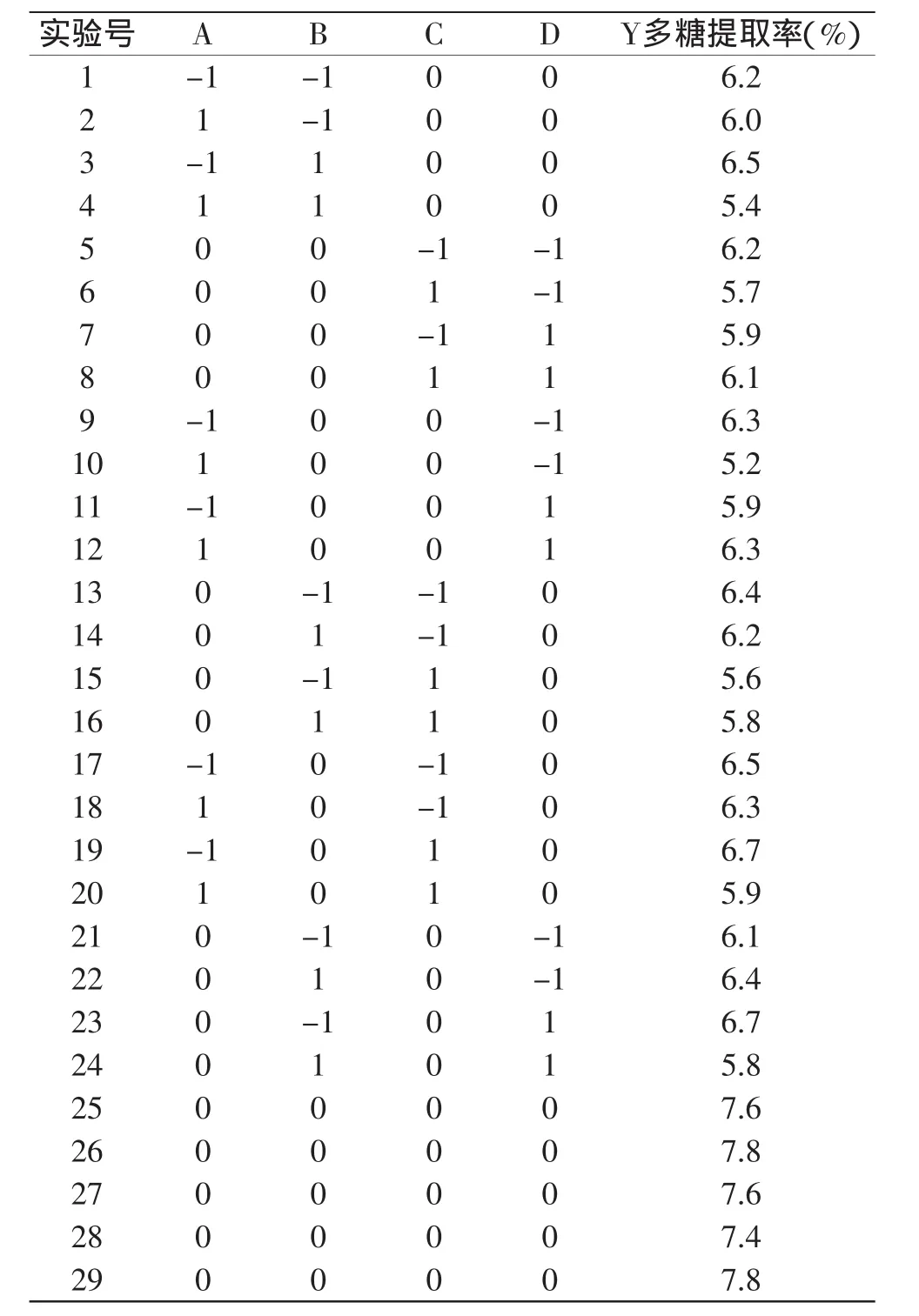
表2 响应面实验设计与结果Table 2 The experiment design and results of response surface method
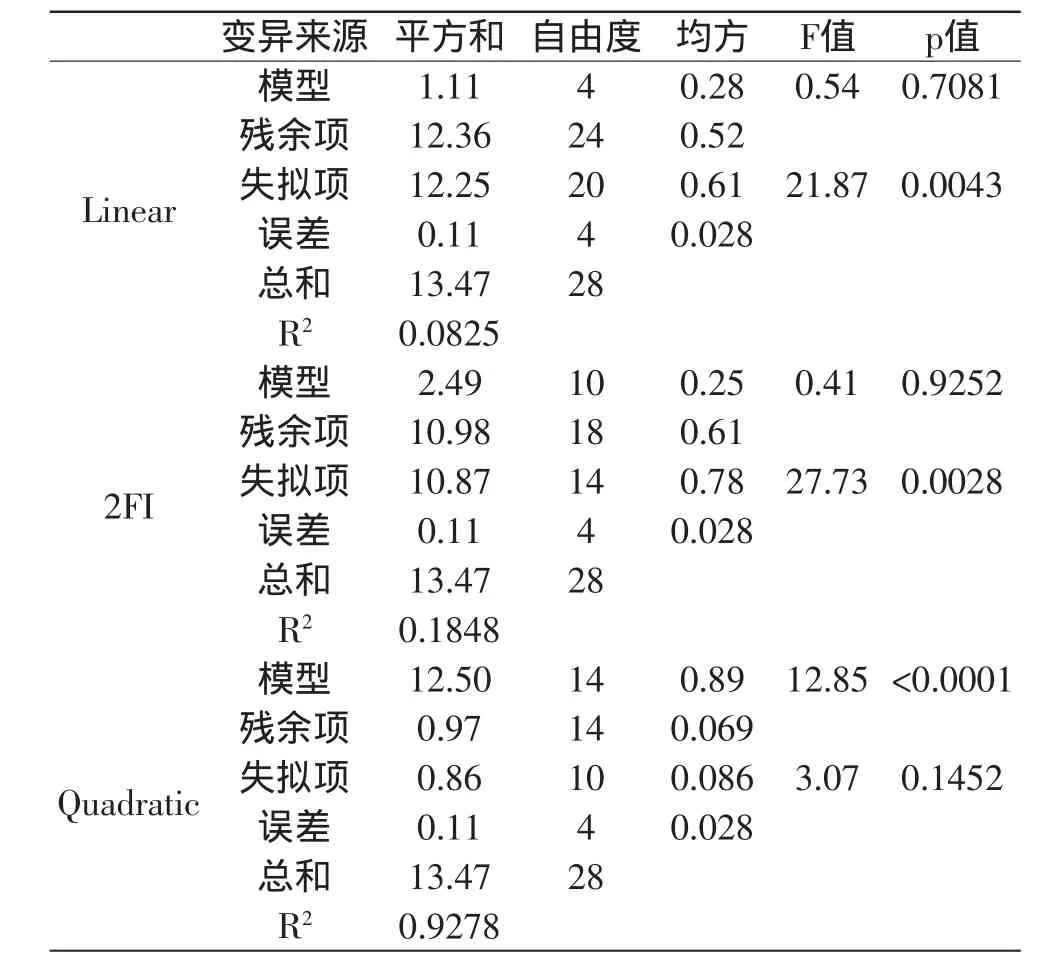
表3 不同效应模式方差分析表Table 3 Analysis of variance of different effect model
由表3分析可知,线性(Linear)及两因子交互作用(2FI)模式下的回归项,模型p值为0.7081及0.9252,说明70.8%和92.5%的F值变异是由误差造成的,两种模式的失拟项均小于0.01(0.0043、0.0028),说明两种模式下回归方程在回归空间内拟合度很差。在二阶效应(Quadratic)的模型下,该模型回归极显著(p<0.01),表明仅有小于0.01%的F值变异是由误差造成的;失拟性不显著(P>0.05),说明回归方程在回归空间内有较好的拟合度,可用回归方程进行预测。综合考虑,应选择二阶效应模型对数据进行模型分析。在选定的二阶效应模型下,对响应面进行方差分析,结果如表4所示。

表4 响应面方差分析Table 4 Analysis of variance of response surface method
由表4分析可知,该模型回归极显著(p<0.01),失拟性不显著(P>0.05),说明可用回归方程进行预测。方程系数R2=0.9278,不良适配度仅有0.0722,显示响应值与各变量之间的回归系数呈现高比例,代表回归线与回归数据间的相对适配度较好,上述四因素可解释92.8%的响应值的变化建立的模型准确度高。信噪比(Adeq Precision)=12.04>4,说明此模型可准确的反映实验结果。分析结果显示,酶添加量、酶添加量与液料比交互作用、酶解温度液料比交互作用、加酶量的二次项、酶解时间二次项、酶解温度的二次项、液料比的二次项对红枣多糖红枣的提取率影响显著(p值分别为:0.0054,0.0130,0.0391,<0.0001,<0.0001,<0.0001及<0.0001,均小于0.05)。根据参数分析结果得到红枣多糖提取率的二阶响应面回归模型为:
Y=-36.02+12.07A+0.16B+0.67C+3.50D-0.03AB-0.05AC+0.63AD+3.33×10-4BC-5.00×10-3BD+8.75×10-3CD-8.42A2-8.56×10-4B2-7.45×10-4C2-0.21D2
此回归模型的R2=0.9278,F=12.85,p<0.00001,说明模型在概率a=0.01水平上能够拟合实验数据,因此可用该回归方程代替实验真实点对实验结果进行分析。2.2.2 各因素相互作用的影响 上述响应面方程中各个因素交互作用影响可通过图2~图7所展示的响应面三维图及等高线图反映出来。等高线的形状可反映出交互作用的强弱大小,椭圆形表示两因素交互作用显著,而圆形则与之相反。通过等高线可以直观看出AD两因素、BD两因素间交互作用显著,即酶添加量与液料比、酶解时间与液料比之间交互作用显著,与方差分析表中结论相同(表4)。从三维图可以看出,过高或过低的各因素水平对红枣多糖提取率均有不利的影响。经分析认为随着酶添加量的增加,反应速度加快,但是该反应为可逆反应,正反应增加的同时,逆反应也在增加,当酶用量大于0.85mg/mL时,酶添加量过大,反应系统中总含水量增加,反应向逆方向进行,提取率下降;温度对酶法提取的影响主要有以下两方面:在温度较低的情况下,提高温度可加快酶提速度,一般来说,温度增加10℃,反应速度增加1~2倍;当温度上升到该酶的变性温度时,会完成酶的变性过程。随着酶活力的丧失,酶解能力下降,进而引起提取率下降;酶解时间和液料比两因素对提取率的影响较小,随着两因素用量的增加,提取率呈现前期快速上升后期变化平缓的趋势,从经济成本角度考虑,选择在响应面设计的0点水平较为合理。响应面方差分析及单因素结果亦可从其他角度得出相同结论。

图2 酶添加量和酶解时间对红枣多糖提取率的响应面Fig.2 Surface response plot of extract time and enzyme concentration on extract yield
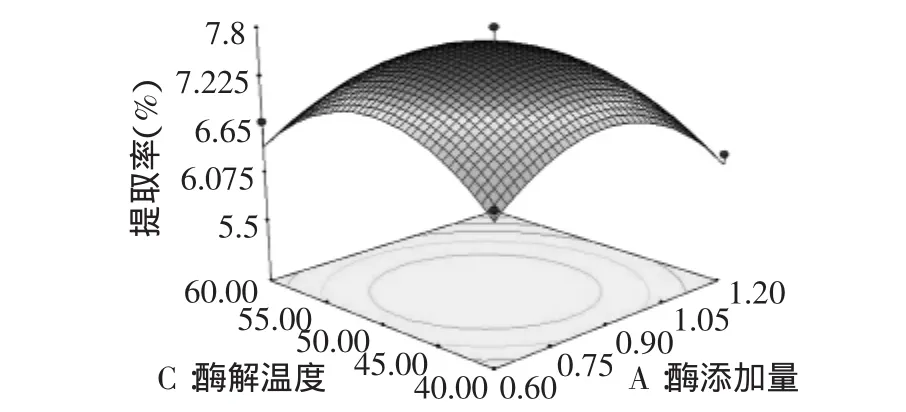
图3 酶添加量和酶解温度对红枣多糖提取率的响应面Fig.3 Surface response plot of extract temperature and enzyme concentration on extract yield
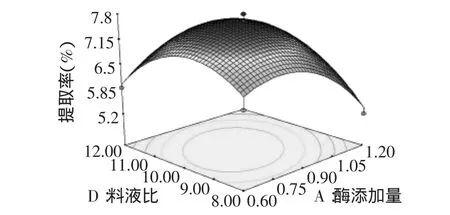
图4 酶添加量和液料比对红枣多糖提取率的响应面Fig.4 Surface response plot of liquid to solid ratio and enzyme concentration on extract yield
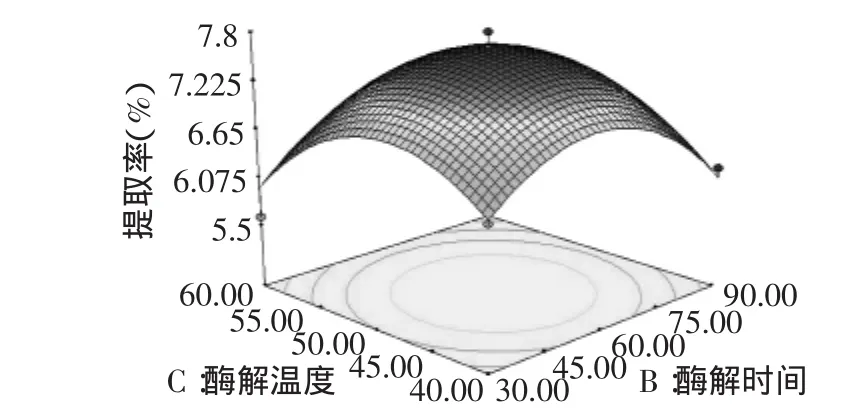
图5 酶解时间和酶解温度对红枣多糖提取率的响应面Fig.5 Surface response plot of extract temperature and extract time on extract yield
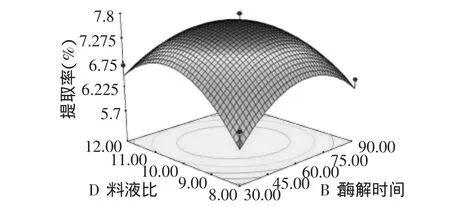
图6 酶解时间和液料比对红枣多糖提取率的响应面Fig.6 Surface response plot of liquid to solid rate and extract time on extract yield
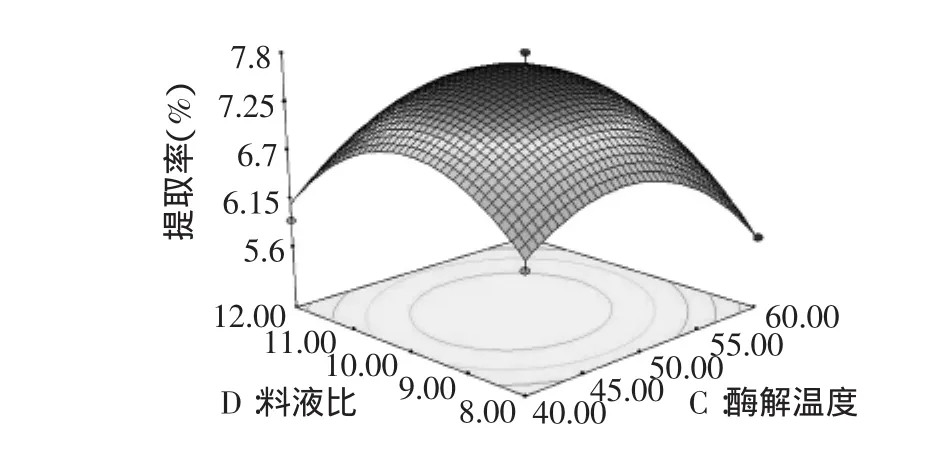
图7 酶解温度和液料比对红枣多糖提取率的响应面Fig.7 Surface response plot of extract temperature and liquid to solid ratio on extract yield
2.2.3 反应条件的优化及模型验证 根据最低成本及最大效益的原则,由回归模型来预测最佳反应条件。利用Design Expert分析,其最佳条件为:酶添加量为0.85mg/mL,酶解时间59.03min,酶解温度为49.18℃,液料比为10.01∶1,其多糖提取率达7.67%。
为了验证模型方程的适用性,同时考虑到操作的方便性,将上述条件调整为酶添加量为0.85mg/mL,酶解时间60min,酶解温度为50℃,液料比为10∶1,平行进行五组实验,最后得到多糖提取率平均值为7.71%,接近预测值。说明实验结果与模型拟合良好,建立的回归模型能真实地反映酶添加量、酶解时间、酶解温度及液料比对红枣多糖提取率的影响,通过此模型优化能够有效地提高红枣多糖的提取率。
2.3 所得样品性质测定
所得多糖样品为淡黄色粉末,无味,易溶于热水,不溶于乙醇、丙酮、乙醚等有机溶剂;经比色反应测定,苯酚硫酸、蒽酮反应均呈阳性,可证明样品为糖类化合物。茚三酮反应呈微弱阳性,说明样品中还有少量残余的蛋白质,需对其进行进一步的纯化分离。
3 结论
本研究在单因素实验的基础上,采用响应面设计实验,采用二次多项式逐步回归方法,确定了红枣多糖的最佳提取工艺。发现在酶添加量0.85mg/mL,酶解时间60min,酶解温度为50℃,液料比为10∶1条件下,得到的红枣多糖提取率为7.71%,相比其他相关报告均有显著性提高[12-13]。该工艺参数可用于实际生产中,对于相关生产加工企业具有一定的参考价值和理论指导意义。
[1]袁亚红,高振鹏,史亚歌.我国红枣的产业化开发[J].西北农林科技大学学报:自然科学版,2002,30(9):95-98.
[2]王军,张宝善,陈锦屏.红枣营养成分及其功能的研究[J].食品研究与开发,2003,24(2):68-72.
[3]李小平,陈锦屏.红枣多糖沉淀特性及抗氧化作用[J].食品科学,2005,26(10):214-216.
[4]王海元.红枣多糖对小鼠运动能力的影响及其机理的探究[D].金华:浙江师范大学,2009.
[5]焦中高,刘杰超,周洪平,等.硫酸化修饰对红枣多糖自由基和亚硝基清除活性的影响[J].中国食品学报,2007,7(2):17-20.
[6]Chang SC,Hsu BY,Chen BH.Structural characterization of polysaccharides from Zizyphus jujuba and evaluation of antioxidant activity[J].International Journal of Biological Macromolecules,2010(47):445-453.
[7]Li Jinwei,Liu Yuanfa,Lian zhong Ai,et al.Antioxidant activities of polysaccharides from the fruiting bodies of Zizyphus jujuba cv. jinsixiaozao[J].Carbohydrate Polymers,2011,84:390-394.
[8]Li Jinwei,Fan Liuping,Ding Shaodong.Isolation,purification and structure of a new water-soluble polysaccharide from Zizyphus jujuba cv.j insixiaozao[J].Carbohydrate Polymer,2011,83:477-482.
[9]Wang Bing.Chemical characterization and Ameliorating effect of polysaccharide from Chinese jujube on intestine oxidative injury by ischemia and reperfusion[J].International Journal of Biological Macromolecules,2011,48:386-391.
[10]Zhang Hao,Lu Jiang,Shu Ye,et al.Systematic evaluation of antioxidant capacities of the ethanolic extract of different tissues of jujube(Zizyphus jujuba mill.)from China[J].Food and Chemical Toxicology,2010,48:1461-1465.
[11]Dubois M,Gilles KA,Hamilton JK,et al.Colorimetric method for determination of sugars and related substances[J].Analytical Chemistry,1956,28:350-356.
[12]唐彦君,王桂华,魏文毅,等.红枣多糖提取工艺研究[J].黑龙江八一农垦大学学报,2008,20(4):64-66.
[13]李杰,梁长利,米芳.水溶性红枣多糖提取纯化工艺的研究[J].江西农业学报,2008,20(10):92-94.
Study on the enzyme extraction technology of polysaccharide from Xinjiang Zizyphus Jujube
WU Hong-bin1,WANG Yong-gang2,LIU Cheng-jiang1,WANG Jun-gang1,ZHAO Zhi-yong1,JIN Xin-wen1,*
(1.Institute of Agro-products Processing Science and Technology,Xinjiang Academy of Agricultural and Reclamation Science,Shihezi 832000,China;2.Hebi College of Vocation and Technology,Hebi 458030,China)
Choosing Xinjiang Zizyphus Jujube as raw material and using cellulase to extract polysaccharide from Zizyphus Jujube,the extraction yield of Zizyphus Jujube polysaccharide could be improved with the optimizing extract technology through response surface method(RSM).The best extraction condition was liquid solid ratio of 10∶1,temperature of 50℃,extraction time of 60min,and enzyme volume of 0.85mg/mL.Under this condition,the Zizyphus Jujube polysaccharide extract yield was up to 7.71%.Reference basis and theory support could be provided to some relative manufactories when the reasonable process was decided through the study of the best extraction condition of Zizyphus Jujube polysaccharide.
Zizyphus Jujube;polysaccharide;cellulase;extraction technology
TS255.1
B
1002-0306(2012)05-0292-05
2011-04-28 *通讯联系人
吴洪斌(1980-),男,助理研究员,硕士,研究方向:食品营养与农产品加工。
兵团科技攻关项目(2010GG61)。
