野生粉叶爬山虎种子等部位的原花青素提取纯化工艺及含量测定
2012-11-15董爱文朱深海王国庆
董爱文,朱深海,王国庆
(1.吉首大学林产化工工程湖南省重点实验室,湖南张家界427000;2.吉首大学城乡资源与规划学院,湖南张家界427000)
野生粉叶爬山虎种子等部位的原花青素提取纯化工艺及含量测定
董爱文1,朱深海2,王国庆1
(1.吉首大学林产化工工程湖南省重点实验室,湖南张家界427000;2.吉首大学城乡资源与规划学院,湖南张家界427000)
通过正交实验研究粉叶爬山虎中原花青素提取条件。结果表明:提取时间100min,乙醇体积分数75%,提取温度65℃,料液比1∶10为较佳条件。香草醛-盐酸法测得果梗、果皮、种子中含量分别为2.6317%、3.7967%、4.0934%;大孔吸附树脂分离纯化的结果表明:LSA-21树脂适合分离纯化粉叶爬山虎中原花青素,分离条件:上样液质量浓度为20mg/mL,洗脱流速为2.0BV/h,经HPLC测得纯化后果梗、果皮与种子中原花青素含量为2.39%、2.31%、3.94%;HPLC检测LSA-21树脂分离纯化后的原花青素纯度可达87%以上。
粉叶爬山虎,原花青素,提取分离,HPLC
粉叶爬山虎(Parthenocissus thomsonili planch)为葡萄科爬山虎属多年生落叶木质藤本植物,其根、茎可入药,具有破淤血、消肿毒、清凉利尿的功效[1];成熟果实为紫黑色球形浆果,爬山虎属植物是原花青素的一种潜在资源植物[2]。原花青素(proanthocyanidins,简称PC)是植物中广泛存在的一大类由儿茶素、表儿茶素等聚合而成的多酚类化合物的总称[3]。原花青素的抗氧化、清除自由基的能力是VE的50倍、VC的20倍,还能防治80多种由自由基引起的疾病,包括心脏病、关节炎等[4]。此外它还具有防癌、抗癌、防止心血管疾病、抗辐射、抗衰老、抗疲劳作用,是欧美国家最受欢迎的植物药之一[5];原花青素中药效活性高的部分为其低聚体(聚合度小于5),其含量高低为原花青素质量指标的关键[6-7]。原花青素已广泛应用于食品、药品、化妆品等领域[8]。市场对其需求量越来越大,因此寻找新的原花青素含量高且低聚体含量高,又适合于工业化生产的植物资源已成研究热点[9]。由于爬山虎属植物是原花青素的一种潜在资源植物,因此本文探讨了粉叶爬山虎中低聚原花青素提取分离纯化的方法及含量测定,为武陵山区资源丰富的爬山虎属植物的综合开发提供理论依据。
1 材料与方法
1.1 材料与仪器
粉叶爬山虎 2010年10月25日采于桑植县八大公山国家森林公园,洗净取其果皮、种子、果梗45℃烘干,粉碎过40目筛,烘至恒重,石油醚脱脂,45℃密封保存备用;无水乙醇、浓盐酸、磷酸、5%NaOH、甲醇、乙酸乙酯、石油醚、丙酮、香草醛 以上化学试剂均为分析纯;原花青素标准品 中国上海鑫马生物科技有限公司,98%,以儿茶素、表儿茶素及其二聚体为主;显色剂 A∶B=6∶3(现配现用),A:香草醛-甲醇溶液(称取10.000g香草醛溶于甲醇溶液中,定容到250mL,得到0.04g/mL的香草醛-甲醇溶液),B:浓盐酸;各种树脂 中国西安蓝晓科技公司。
ZM-1植物样品粉碎机,LC-20A高效液相色谱仪,AEG-220万分之一电子天平 日本岛津公司;Lambda-25紫外可见分光光度计 美国PerkinElmer公司;LD5-2A离心机 中国北京医用有限公司;DF-42鼓风干燥箱 日本Yamato公司;R-215旋转蒸发仪瑞士BUCHI公司;HH-6电子恒温水浴锅 中国富华仪器有限公司。
1.2 实验方法
1.2.1 紫外标准曲线测定 精密称取原花青素标准品0.500g(平行3份,取其平均值,未加说明下文均同)溶于甲醇溶液,定容到500mL容量瓶中,得到质量浓度为1mg/mL的标准溶液,吸取标准品溶液0.5mL于10mL容量瓶中,分别加入A溶液6.0mL与B溶液3.0mL,并定容于10mL容量瓶中,恒温(30℃)避光反应30min。以A溶液∶B溶液∶水=6∶3∶1(V∶V∶V)的混合溶液作对照,于紫外分光光度计上从200~800nm自动扫描,结果见图1。
从浓度为1mg/mL标准品溶液中分别取0.1、0.2、0.3、0.4、0.5、0.6mL,各加入A溶液6.0mL和B溶液3.0mL,并定容于10mL容量瓶中。按上法在紫外分光光度计上测其A520nm值。
1.2.2 HPLC标准曲线的测定
1.2.2.1 色谱条件 色谱柱为Hypersil ODS C18(150× 4mm,5μm),柱温30℃,进样量为10μL,流动相为甲醇-0.4%磷酸(1∶1),流速为1mL/min,检测波长280nm。
1.2.2.2 HPLC标准曲线的绘制 精密称取原花青素标准品0.000、2.500、5.000、7.500、10.000mg用甲醇溶解于10mL容量瓶中,并用甲醇定容,以甲醇为对照品,按1.2.2.1项色谱条件进行检测。
1.2.3 各单因素对原花青素得率的影响
1.2.3.1 提取温度对原花青素得率的影响 称取3.000g脱脂种子粉末7份,以体积分数为75%乙醇溶液作为溶剂,料液比为1∶10(g/mL),调pH为5,分别在30、45、55、65、75、85、95℃水浴中浸提1h,在紫外分光光度计上测A520nm值。
1.2.3.2 提取时间对原花青素提取率的影响 取3.000g脱脂种子粉末7份,以体积分数为75%乙醇溶液作为溶剂,料液比为1∶10(g/mL),调pH为5,在(65±1)℃水浴中分别浸提20、40、60、80、100、120、140min,在紫外分光光度计上测A520nm值。
1.2.3.3 乙醇体积分数对原花青素提取率的影响 称取3.000g脱脂种子粉末7份,按1∶10(g/mL)的料液比,调pH为5,以体积分数为30%、45%、55%、65%、75%、85%、95%的乙醇溶液作为溶剂,在65℃水浴中浸提1h,在紫外分光光度计上测A520nm值。
1.2.3.4 料液比对原花青素提取率的影响 称取3.000g脱脂种子粉末7份,以体积分数为75%乙醇溶液作为溶剂,调pH为5,料液比分别为1∶5、1∶10、1∶15、1∶20、1∶25、1∶30、1∶35(g/mL),在65℃水浴中浸提1h,在紫外分光光度计上测A520nm值。
1.2.4 粉叶爬山虎原花青素提取条件的优化 根据单因素考察的乙醇体积分数、提取温度、料液比以及提取时间对原花青素提取率的综合影响,采用L16(45)正交表设计正交实验,因素水平安排见表1,实验结果和方差分析见表2。
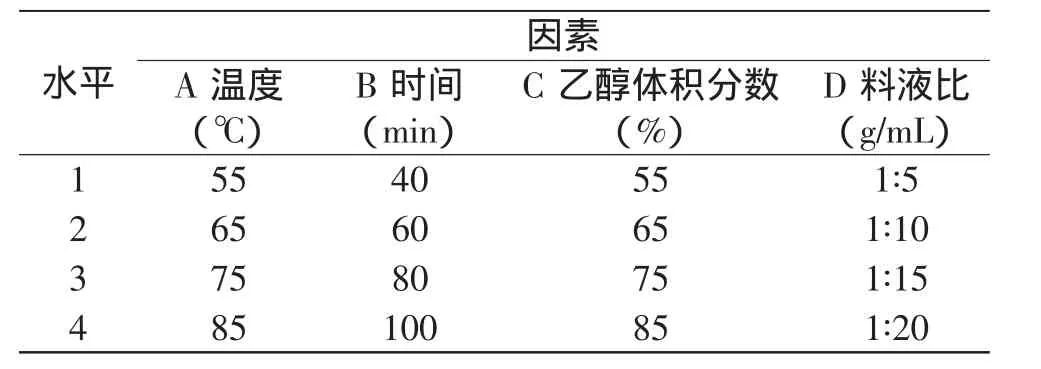
表1 正交实验因素水平表Table 1 Factors and levels of orthogonal experiments
1.2.5 粉叶爬山虎原花青素的提取与初步分离纯化 称取100.000g脱脂的野生粉叶爬山虎果梗、果皮和种子粉末,加入1000mL体积分数为75%的乙醇溶液,在65℃条件下提取100min,抽滤,滤液浓缩,按文献[10-11]中方法进行提取与纯化,得原花青素初步纯化物,对其进行Uv法测定。
1.2.6 原花青素的树脂分离纯化
1.2.6.1 大孔树脂的筛选 10种树脂预处理按文献[12]进行。在50mL的锥形瓶中加入5.000g(相当于干质量,下同)经处理的树脂,再加入15mL浓度为1.0mg/mL的原花青素标准溶液,封口,于室温振荡吸附24h,过滤,测定滤液中原花青素的质量浓度,计算各树脂的吸附率。
用30mL体积分数75%乙醇溶液对已吸附原花青素的树脂进行解吸实验,测定解吸液中原花青素的质量浓度,计算解吸率[13]。根据吸附率与解吸率筛选树脂。
1.2.6.2 进样浓度对树脂吸附速率的影响[14]准确称取20.000g处理好的树脂于锥形瓶中,分别加入100mL初始质量浓度为40、20、10mg/mL的原青花素标准品溶液,置于30℃恒温摇床中振荡(150r/min),每隔10min取样测定溶液中原花青素含量,按照如下公式计算原花青素在吸附树脂上的吸附速率,即:q=(C0-Ct)×V/W,其中,C0-溶液初始质量浓度(mg/mL);Ct-t时刻的质量浓度(mg/mL);V-溶液体积(mL);W-树脂质量(g)。记录不同进样浓度在LSA-21树脂上150min内吸附速率,以时间为横坐标,吸附速率为纵坐标作图(图7)比较分析进样浓度对树脂吸附速率的影响。
1.2.6.3 LSA-21树脂动态吸附量与洗脱剂流速选择 取40.000g LSA-21树脂(湿质量、5份)按湿法装柱,分别用0.5、1.0、1.5、2.0、3.0BV/h的流速对1.2.5项原花青素溶液进样,按每管5mL收集流出液,稀释至10mL,测定流出液中原花青素含量,直至流出液中原花青素浓度与加入液一致为止,据此计算出树脂的动态吸附容量。然后用体积分数75%乙醇溶液分别以1.0、2.0、3.0、4.0、5.0BV/h的流速对其进行洗脱,按每管5mL收集洗脱液,稀释至10mL,测定各管洗脱液中原花青素含量,确定洗脱剂的流速。
1.2.7 粉叶爬山虎原花青素树脂分离纯化 用甲醇溶解1.2.5项初步纯化的原花青素,并定容于300mL容量瓶中,提取液在大孔吸附树脂LSA-21柱上吸附24h,用体积分数75%乙醇洗脱溶液以2BV/h的流速对其进行洗脱,洗脱液浓缩并定容于100mL容量瓶中,进行HPLC与Uv法检测。
2 结果与分析
2.1 原花青素紫外标准曲线
从紫外分光光度计自动扫描图(图1)中发现原花青素的最大吸收波长为520nm[15-18]。紫外标准曲线测定后,计算得回归方程:y=0.0087x+0.0046,r=0.9980。
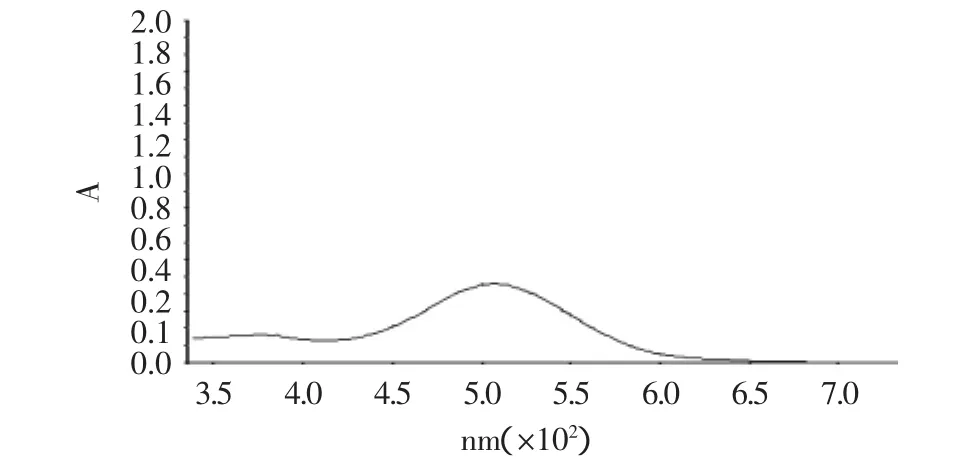
图1 原花青素紫外自动扫描图Fig.1 Proanthocyanidins ultraviolet automatic scanning map
2.2 HPLC标准曲线的绘制
图2 HPLC原花青素标准品图Fig.2 HPLC standard curve of proanthocyanidins
按1.2.2.1项色谱条件进行HPLC测定,以质量浓度与峰面积计算得回归方程:y=6659.8x+23714,r=0.9993。 HPLC检测原花青素标准品溶液的图谱见图2。
2.3 单因素对原花青素得率的影响
由图3~图6可知:温度在30~75℃范围内原花青素得率呈线性上升,在75℃左右达到得率高点,然后开始下降,结合高温对原花青素的影响,本文选取提取温度为55、65、75、85℃进行正交实验;提取时间在20~60min内原花青素得率变化较大,但时间少于40min其得率又太低,大于40min后其得率变化较小,因此本文选择提取时间为40、60、80、100min进行正交实验;乙醇溶液体积分数在30%~75%范围内原花青素得率呈上升趋势然后开始下降,但在55%以下时其得率较低,因此选择乙醇溶液体积分数55%、65%、75%、85%进行正交实验;料液比在1∶5、1∶10、1∶15(g/mL)范围时原花青素得率呈上升趋势,之后上升趋势比较平缓,而低于1∶5(g/mL)时溶液已不能完全浸没原料,因此选择料液比为1∶5、1∶10、1∶15、1∶20(g/mL)进行正交实验。
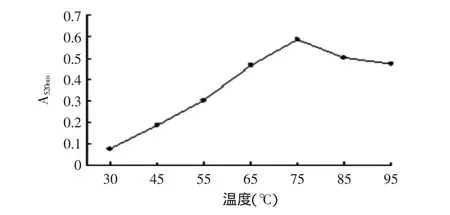
图3 不同温度下所提原花青素的吸光值Fig.3 Proanthocyanidin absorption value under different temperature
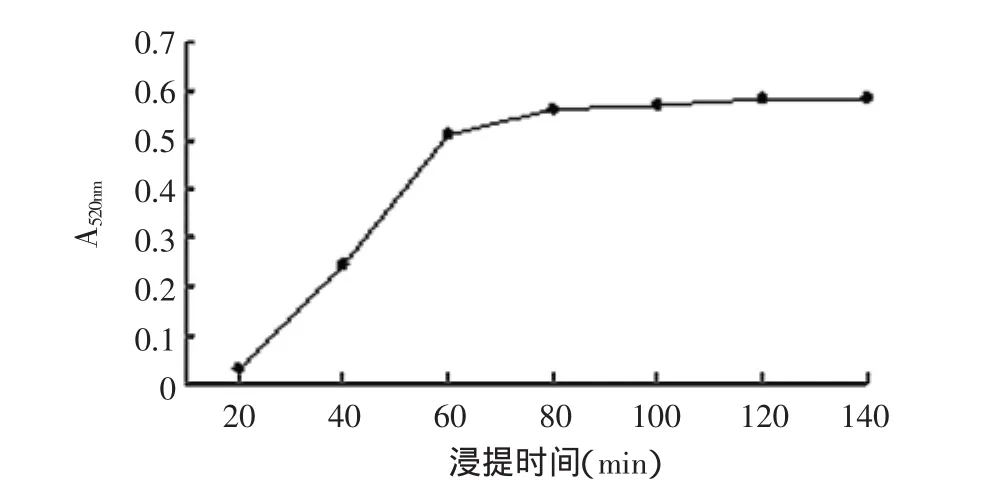
图4 不同提取时间所提原花青素的吸光值Fig.4 Proanthocyanidin absorption value under different extraction time
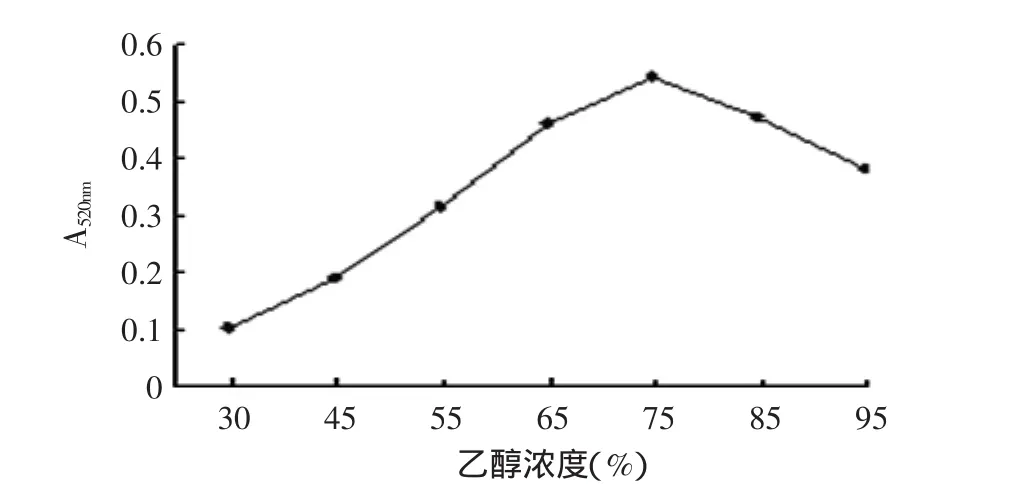
图5 不同乙醇浓度所提取原花青素的吸光值Fig.5 Proanthocyanidin absorption value under different alcohol concentration

图6 不同料液比所提原花青素的吸光值Fig.6 Proanthocyanidin absorption value under different ratio of solid to liquid
2.4 粉叶爬山虎种子中原花青素提取工艺优化结果
根据单因素实验结果,选择温度、提取时间、乙醇浓度、液料比等较优水平,按L16(45)设计正交实验,实验结果与方差分析见表2。由表2可知,影响原花青素提取率的因素顺序为:温度(A)>料液比(D)>提取时间(B)>乙醇体积分数(C)。其提取最优组合为A4B4C3D2,即提取工艺参数为温度85℃、提取时间100min、乙醇体积分数75%和料液比1∶10。但综合考虑提取温度过高对原花青素稳定性产生的影响以及节约能源,同时考虑A4与A2的k2、k4值相差较小,结合单因素实验结果在降低提取温度的同时维持较长的提取时间而达到最佳的提取效果,因此本实验选择A2B4C3D2,即提取工艺参数为温度65℃、提取时间100min、乙醇体积分数75%和料液比1∶10。
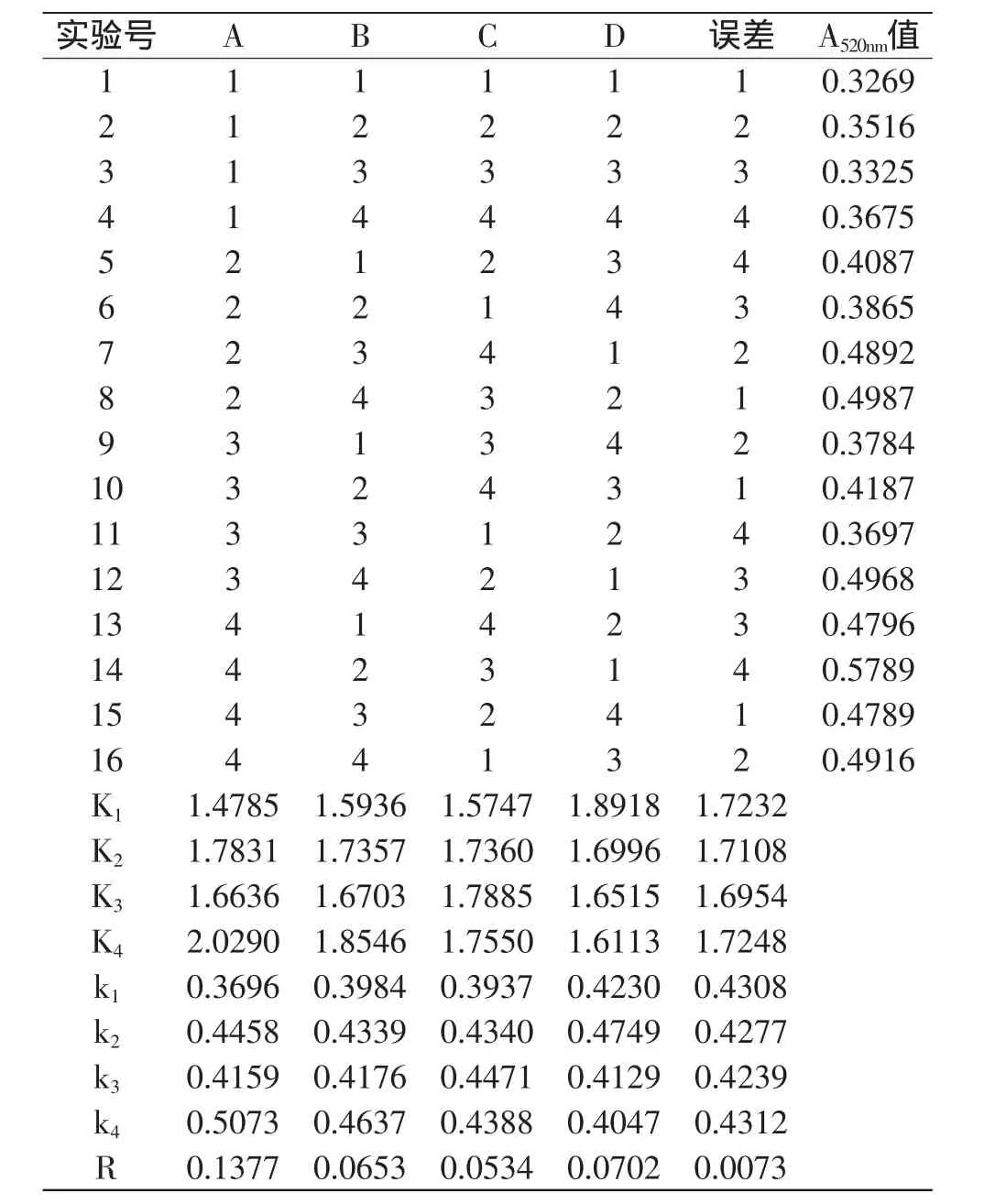
表2 正交实验结果Table 2 Results of orthogonal experiments
2.5 Uv法检测初步纯化的原花青素结果
粉叶爬山虎种子、果皮、果梗干粉中原花青素按优化工艺条件提取,经石油醚与乙酸乙酯萃取后,香草醛-盐酸法显色,紫外检测,计算得果梗、果皮、种子中原花青素的平均含量为2.6317%、3.7967%、4.0934%。
2.6 大孔吸附树脂分离纯化原花青素
2.6.1 分离树脂的筛选 10种大孔吸附树脂对粉叶爬山虎种子中原花青素的静态吸附结果见表3,可知10种树脂中有4种可实现80%以上吸附率,解吸率80%以上的也有5种,综合吸附率和解吸率,LSA-21型树脂吸附量为41.7mg/g,吸附率达92.7%,解吸率也达到89.6%。故本实验选择LSA-21树脂为原花青素分离纯化树脂。
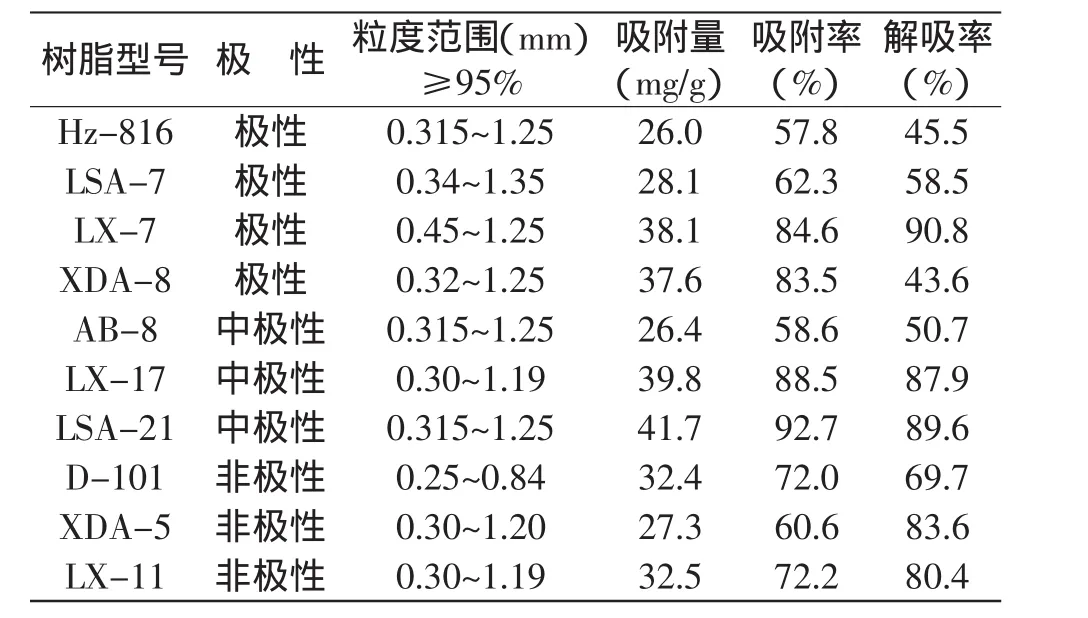
表3 不同树脂的吸附及解吸性能比较Table 3 Comparison of different resin adsorption and desorption performance
2.6.2 进样浓度对树脂吸附速率的影响 由图7可知,进样浓度越高,达到吸附平衡所需的时间越短,说明吸附速率与溶液浓度有相关,但不同浓度的平衡时间相差不大,如当平衡质量浓度为40mg/mL时,平衡所需时间为30min,而浓度20mg/mL时平衡时间为33min,两者相差不大,因此本文选择进样浓度为20mg/mL。

图7 原花青素在LSA-21树脂上的吸附速率Fig.7 Adsorption rate of LSA-21 resin on proanthocyanidins
2.6.3 LSA-21树脂动态吸附量与洗脱剂流速选择 当流经吸附柱的原花青素溶液体积达到两倍床层体积时,流出液的浓度基本不变,接近饱和吸附;当流出液体积从15mL升至22mL时,流出液中原花青素浓度急剧增高,22mL以后,流出液中原花青素浓度几乎不变,说明此时树脂对原花青素吸附饱和。据此计算出LSA-21树脂动态吸附容量为156.4mg/g。洗脱液流速为1.0、2.0、3.0BV/h时,洗脱效果相差不大,当洗脱液流速达到4.0BV/h时,洗脱效果明显减弱,但是如果流速太小,解吸速度就慢,因此本实验选择洗脱液流速为2.0BV/h。
2.7 LSA-21树脂分离纯化后原花青素的HPLC检测
经过LSA-21大孔吸附树脂分离纯化的野生粉叶爬山虎种子、果皮中原花青素HPLC检测图谱见图8、图9,分离纯化后的各种原花青素与标准品成分基本一致。而果梗中原花青素经同样方法处理后,HPLC检测(图10)发现其与标准品的检测图谱在3.2min均有出峰外,其它出峰时间与峰数存在差异,说明果梗中所含成分与标准品及果皮、种子有差异,这主要是原花青素是一大类由不同数量的儿茶素或表儿茶素单体及其聚合体形成的多酚类化合物,虽然它在植物不同部位广泛存在,但不同部位所含单体种类及聚合程度不一样。野生粉叶爬山虎种子、果皮与果梗中原花青素存在哪些差异成分有待进一步研究。
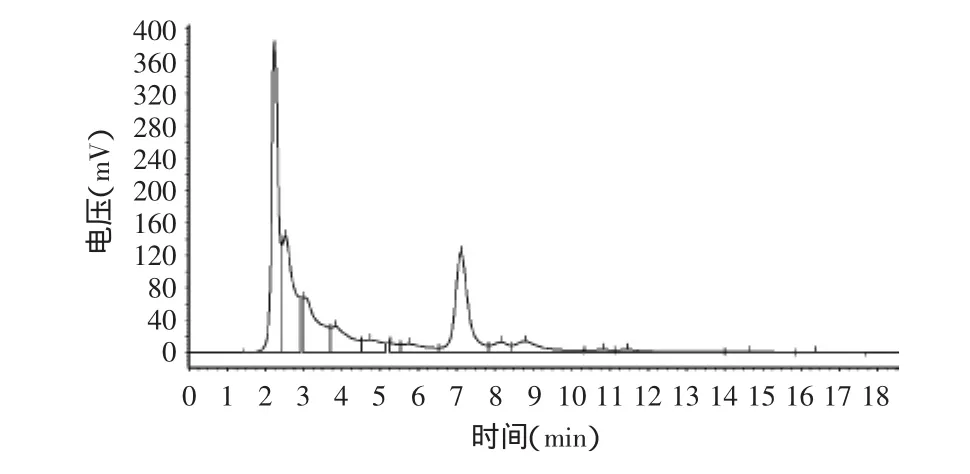
图8 种子中原花青素HPLC检测图谱Fig.8 HPLC detection chart of proanthocyanidins in seed
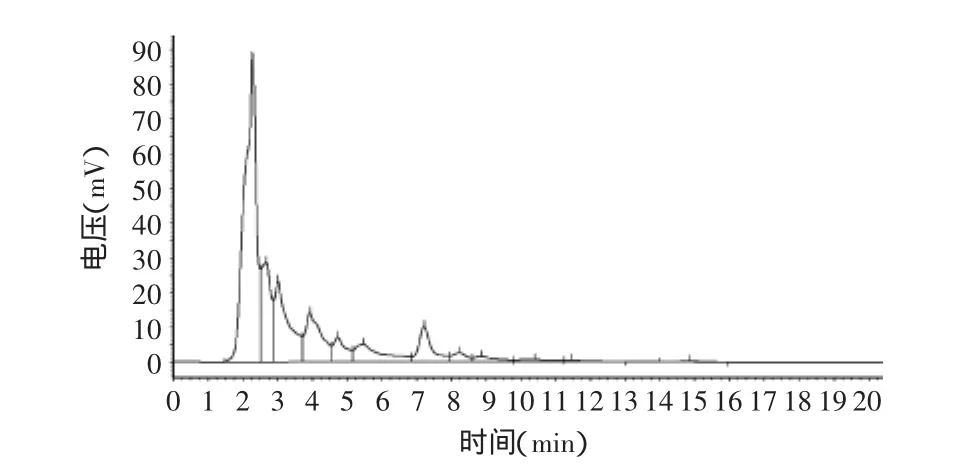
图9 果皮中原花青素HPLC检测图谱Fig.9 HPLC detection chart of proanthocyanidins in fruit peel
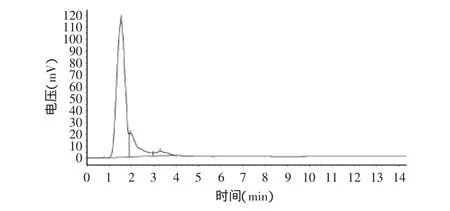
图10 果梗中原花青素的HPLC检测图谱Fig.10 HPLC detection chart of proanthocyanidins in fruit stem
2.8 树脂分离纯化后原花青素含量的测定
各种原花青素提取液经LSA-21树脂分离纯化后,用HPLC检测,按归一法计算得果梗、果皮、种子中平均含量为2.39%、2.31%、3.94%,纯度均达87%以上。
3 结论
3.1 通过单因素和正交实验并经方差分析优选出粉叶爬山虎种子、果皮、果梗中原花青素提取较佳条件:提取时间100min,乙醇体积分数75%,提取温度65℃,料液比1∶10。紫外检测果梗、果皮、种子中原花青素平均含量为2.6317%、3.7967%、4.0934%。
3.2 从10种树脂中筛选出较佳的LSA-21树脂,分离时进样质量浓度为20mg/mL,洗脱液流速为2.0BV/h,以体积分数75%的乙醇为洗脱液,经LSA-21树脂分离纯化,HPLC检测,计算得果梗、果皮、种子中原花青素含量为2.39%、2.31%、3.94%;原花青素纯度均达87%以上,且与以儿茶素、表儿茶素及其二聚体为主的标准品的HPLC图谱一致。
[1]董爱文,赵虹桥,施立毛.爬山虎植物多糖含量的比较研究[J].天然产物研究与开发,2005,17(6):746-749.
[2]祁承经.湖南植物名录[M].长沙:湖南科学技术出版社,1987:235-236.
[3]张泽生,高薇薇,张颖,等.山楂果原花青素稳定性研究[J].食品工业科技,2010,31(8):108-111.
[4]吴娟,魏和平,许远.原花青素提取工艺的优化及稳定性分析[J].食品工业科技,2010,31(6):103-104,343.
[5]董爱文,于华忠,冯英英.爬山虎籽中原花青素提取纯化工艺研究及含量测定[J].食品科学,2010,31(14):88-92.
[6]石翠芳,孙智达,刘畅,等.沙枣果肉原花青素的分离纯化[J].食品与发酵工业,2007,33(4):137-140.
[7]吕丽爽,曹栋.脱脂葡萄籽中低聚原花青素的提取[J].无锡轻工大学学报,2001,20(2):208-210.
[8]罗宝生,戴万生.大黄原花青素提取纯化工艺研究[J].云南中医中药杂志,2007,28(1):36-37.
[9]张小军,夏春镗,吴建铭,等.原花青素的资源研究[J].中药材,2009,32(7):1154-1160.
[10]刘通讯,金宁,孙寒潮.山楂原花青素的提取纯化工艺及其组分鉴定[J].食品与发酵工业,2006,28(12):142-144.
[11]谢伟光,张黎明.山楂叶原花青素提取分离工艺研究[J].食品工业科技,2008,29(3):216-218.
[12]纪小燕,王玉,丁兆堂,等.大孔吸附树脂对茶多酚和咖啡碱吸附及洗脱性能研究[J].食品工业科技,2011,32(2):118-120.
[13]李瑞丽.葡萄籽中原花青素的提取工艺研究[D].北京:北京化工大学,2006.
[14]何钊,吴彩娟,任其龙.原花青素在X-5树脂上吸附性能的研究[J].中国食品学报,2006,6(2):50-53.
[15]姚开,何强,吕远平,等.葡萄籽提取物中原花青素含量的测定[J].食品与发酵工业,2002,28(3):17-19.
[16]严赞开.仙人掌中多酚的分光光度法测定[J].安徽农业科学,2006,34(13):2957-2958.
[17]鲍俊竹,陈月坤,徐桂花.测定葡萄籽提取物中原花青素含量的方法[J].农业科学研究,2005,26(3):43-45.
[18]杨磊,苏文强,汪振洋,等.落叶松树皮提取物中低聚原花青素含量测定方法的研究[J].林产化学与工业,2004,24(8):111-114.
Extraction technique conditions of procyanidins from seed and other parts of wild grown Parthenocissus thomsonili planch and its content determination
DONG Ai-wen1,ZHU Shen-hai2,WANG Guo-qing1
(1.HunanProvincalKeyLaboratoryofForestProductsandChemicalEngineering,JishouUniversity,Zhangjiajie427000,China;2.College of Rural-Urban Resources and Planning Science,Jishou University,Zhangjiajie 427000,China)
Orthogonal experiments were designed for optimization of the extraction and purification technologic conditions of procyanidins from Parthenocissus thomsonili planch.Results showed that extraction for 80min,ethanol volume fraction of 75%,the optimum combined conditions were extraction temperature at 65℃,solution ratio of 1∶10.After preliminary purification of extract solution,color reactions produced by vanillin hydrochloric acid method,the average procyanidins contents of stem,fruit peel and seed determined by ultraviolet spectrophotometry method were 2.6317% ,3.7967%,4.0934%respectively.The results of isolation and purification of procyanidins by macroporous absorptive resin showed that LSA-21 was suitable for isolation and purification of procyanidins from Parthenocissus thomsonili planch,the optimum conditions of column isolation were that the mass concentration of initial feed solution was 20mg/mL,eluting speed was 2.0BV/h.The average contents of purified procyanidins of fruit peel,seed and stem determined by high performance liquid chromatography(HPLC)and ultraviolet spectrophotometry were 2.39%,2.31%,3.94%respectively.The purities of procyanidins purified by LSA-21 and determined by HPLC reached above 87%.
Parthenocissus thomsonili planch;procyanidins;isolation and extraction;HPLC
TS201.2
B
1002-0306(2012)05-0230-05
2011-04-25
董爱文(1967-),男,副教授,硕士,主要从事植物及其有效成分研究。
湖南省科技厅资助项目(2011NK3043);湖南省科技厅课题(2008TP4008-3);张家界市科技局课题(2010YB010)。
