芡种壳乙酸乙酯提取物的毛细管电泳法分离
2012-11-15贾小丽
张 汆,李 敏,贾小丽
(滁州学院生物与食品工程学院,安徽滁州239000)
芡种壳乙酸乙酯提取物的毛细管电泳法分离
张 汆,李 敏,贾小丽
(滁州学院生物与食品工程学院,安徽滁州239000)
芡植株各组织器官中均含有丰富的酚类物质,其中以实种壳中多酚含量最高(183.037mg/g,干基),其次为块根、叶及芡果皮。为分析芡种壳乙酸乙酯提取物的化学成分,采用高效毛细管电泳(HPCE)法对芡种壳乙酸乙酯提取物进行分离,并以标准物为对照,对其主要成分进行初步定性。结果显示,HPCE法可用于芡种壳乙酸乙酯提取物(EAE)中多酚类物质的分离,其分离条件为:弹性石英毛细管柱(总长42.5cm,有效长度34cm),电泳缓冲液由200mmol/L硼酸、5.4mmol/L β-CD、10mmol/L KH2PO4和27.5%乙腈组成,检测波长230nm,压力进样50mbar,5s,电压20kV,柱温20℃。初步分析认为,芡种壳乙酸乙酯提取物中基本不含儿茶素、表儿茶素和芦丁,含少量绿原酸组分。
芡种壳,乙酸乙酯提取物,高效毛细管电泳,分离
芡实是睡莲科芡属植物芡(Euryale ferox Salisb.)的成熟种仁,又称鸡头米。芡实是我国传统的中药原料和滋补食材,具有多种生理保健功能,被视为延年益寿的上品[1-2]。芡实种子外被一层厚约1~2mm的木质坚硬外壳覆盖,去壳是其加工的第一步。芡种壳约占其种子质量的30%~40%,是芡米加工中的主要副产物,年产量在3000t以上,尚未开发利用。研究表明,芡实果皮[3-4]、种仁[5-6]以及芡种壳、茎、叶、果皮、根茎中均含有丰富的植物多酚类物质。其中芡种壳的总酚含量最高(17.76%),是提取植物多酚物质的理想原料。多酚物质作为植物组织中的一种次生代谢产物,广泛分布于各种植物源食物和中药材中,具有多种生理活性,而有关芡种壳中多酚物质的组成及其生理活性目前还不了解。高效毛细管电泳(High performance capillary electrophoresis,HPCE)是一种较新型的分析技术,具有快速、灵敏、环保等优点,已广泛用于中药材、医药、食品、保健品中功效成分的分析与鉴定[7-9]。本文采用乙酸乙酯对芡种壳中的多酚物质进行分离提取,采用高效毛细管电泳(HPCE)技术对其分子结构进行了初步分离和定性,为提高芡种壳资源的综合利用率,为其在医药、保健品、食品添加剂领域的应用提供理论依据。
1 材料与方法
1.1 材料与仪器
芡种壳 取当年产带壳芡实,手工剪开芡种壳,取出芡实种仁,将芡种壳于40℃烘箱内干燥后,粉碎(过80目筛网),装入聚乙烯自封袋内,于4℃冰箱内贮藏备用;乙酸乙酯、焦性没食子酸、硼酸、β-CD、KH2PO4、乙腈等 购自国药集团上海试剂公司,均为分析纯试剂;芦丁、绿原酸、儿茶素和表儿茶素对照品 购自中国药物检验所。
CP224s型电子天平 Sartorius AG Germany;L-550型离心机 湖南湘仪;SHB-Ⅲ型循环水式多用真空泵,双华HH-S数显恒温水浴锅 郑州长城科工贸有限公司;DGX-9073BC-1型电热鼓风干燥箱 上海福玛实验设备有限公司;LGJ-10B型冷冻干燥机 北京四环科学仪器厂有限公司;Cart 100型紫外-可见分光光度计 美国Varian公司;G1600A型高效毛细管电泳仪(弹性石英毛细管柱,总长42.5cm,有效长度34cm),紫外检测器 美国Agilent公司。
1.2 实验方法
1.2.1 组分测定 水分和挥发性物质含量采用GB/ T5009.3-2003测定。
总酚含量的分析[10-11]:采用Folin-Ciocalteus(FC)试剂法,以焦性没食子酸为标准物进行测定。总酚测定标准曲线方程为:总酚(mg)=0.1077×A680+0.0009,R2=0.9943。
1.2.2 芡种壳乙酸乙酯提取物(Ethyl Acetate Extract, EAE)制备[8,12]芡种壳→40℃干燥,粉碎(过80目筛)→用乙酸乙酯(pH调至5~6),超声浸提(20℃,5min)2次→离心分离,合并上清液,减压浓缩→真空冷冻干燥48h,即得淡黄色的提取物(EAE)。
1.2.3 多酚样品组分的高效毛细管电泳(HPCE)分析[8-9]G1600A型高效毛细管电泳仪(美国Agilent公司),紫外检测器。弹性石英毛细管柱,总长42.5cm,有效长度34cm。分别对缓冲体系及其浓度、电压、进样量、柱温等条件进行了分析。电泳介质、标准溶液和样品溶液在进样前均用微孔滤膜过滤。两次进样间用0.1mol/L NaOH、超纯水和电泳介质分别冲洗毛细管5min。
1.2.4 数据处理 实验数据均重复测定3次,取平均值。采用Excel和DPSv7.55数据处理软件对数据进行分析。
2 结果与分析
2.1 芡组织器官中总酚的分布
芡组织器官中总酚含量如表1所示。结果表明,芡植株各组织器官中均含有丰富的酚类物质,其中以实种壳中多酚含量最高(183.037mg/g,干基),其次为块根、叶、果实海绵质以及芡果皮。由此可见,芡种壳、叶、根等均是提取植物多酚的良好资源。
此外,芡种仁是我国常用中药材和滋补食材,其中的总酚含量为1.270mg/g(鲜重),要高于葡萄籽(1.005mg/g)[13],但稍低于苹果(1.32~2.67mg/g)[14]中的总酚含量。Samarjit Das等[15]、刘玉鹏等[16]研究表明,芡种仁提取物具有较强的保健功能和抗氧化活性。在前期研究的基础上,结合前人的研究结果,分析认为,酚类物质在芡实医药保健功能中可能扮演重要作用,而目前对芡实中多酚物质的组成和生理活性还缺乏研究。
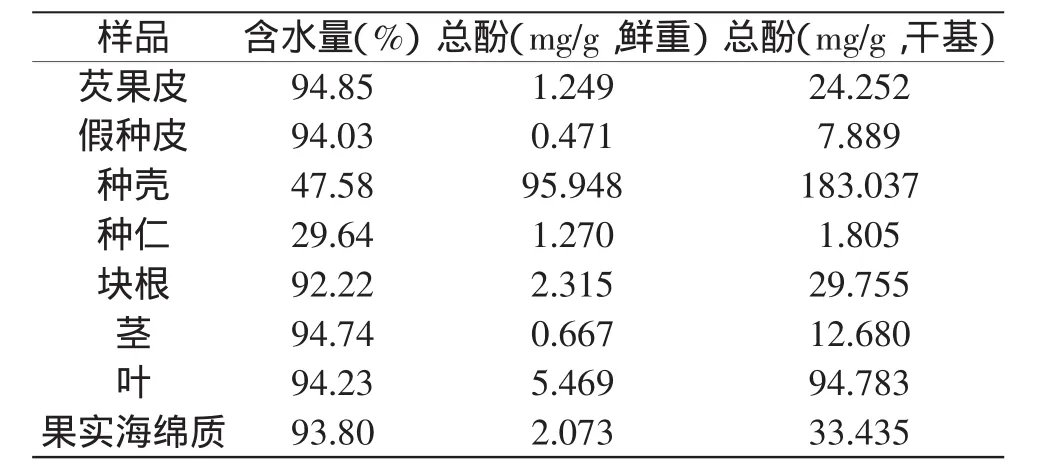
表1 多酚物质在芡组织器官中的分布Table 1 The polyphonics distribution in gorgon nut frond tissues
2.2 EAE样品中各组分的HPCE分离条件分析
为了解芡种壳多酚的分子组成,本实验采用HPCE法对其进行分析,以下就HPCE的分析条件进行了初步探索。
2.2.1 电泳缓冲体系选择 本实验分别选择磷酸盐和硼酸两种缓冲体系作为分离EAE样品的电泳介质,为增加分离效果加入β-CD。β-CD是一种常用的手性选择剂,它能与对映体形成具有不同稳定常数的包容配合物,借此实现对映体的分离[9]。此外,有机溶剂乙腈可以减小流动相的极性改变毛细管管壁的Zeta电势,降低电渗流的速度,从而提高选择性。
分析结果显示,随着电泳缓冲液中乙腈含量的增加,HPCE图谱中各组分的迁移时间不断延长,各峰之间分离度提高。通过调节硼酸、β-CD、KH2PO4和乙腈之间的比例,发现当200mmol/L硼酸、5.4mmol/L β-CD、10mmol/L KH2PO4和27.5%乙腈的混合溶液作为电泳缓冲液,压力进样50mbar,5s,在电压20kV、柱温30℃,检测波长200nm时,各峰可以较好分离,共分离出12个峰,分析时间10min,最强峰出峰时间在6.5min处(如图1)。

图1 所选电泳缓冲液体系下EAE的HPCE图谱Fig.1 The HPCE chromatography of EAE with elected buffer system
2.2.2 检测波长的选择 样品EAE乙醇溶液紫外吸收图谱(图2A)显示其最大吸收峰为278nm,而HPCE分离图谱的3D图(图2B)显示,样品中各主要组分230nm处均有较强吸收,所以,本实验选择230nm作为EAE样品的检测波长。
2.2.3 电压、柱温和进样量的选择 在选定电泳缓冲液条件下,不同电压(20~30kV)下的分析结果表明:随着电压的升高,基线噪声增大,各峰之间分离度降低,总峰数减少,故选择电泳分离电压为20kV。随着柱温升高(20~30℃),组分的迁移时间缩短,但分离度降低,当柱温为20℃时分析效果较合适。调整进样为50mbar,3s后,各峰之间区分度降低,峰高也有所降低,故选择压力进样条件为50mbar,5s。
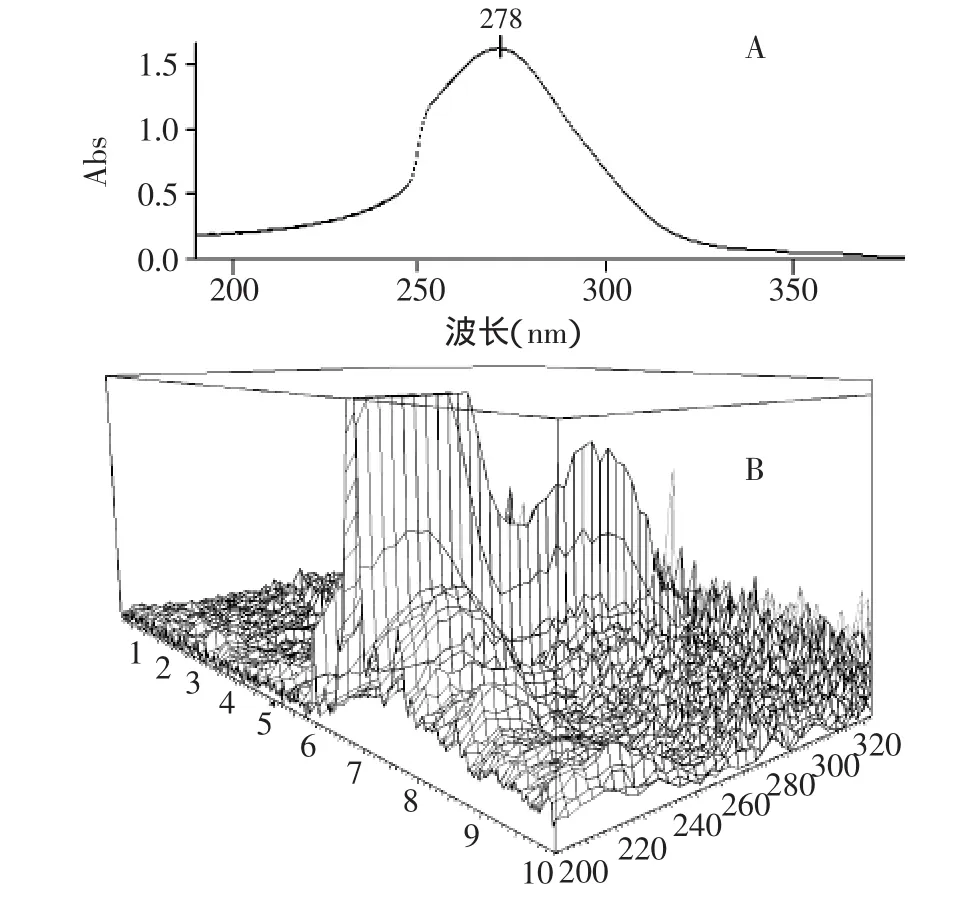
图2 样品EAE溶液紫外吸收图谱(A)及其HPCE分离图谱的三维图(B)Fig.2 The UV-absorption spectrum(A)of EAE sample solution and its three dimensional graphics(B)
因此,在本实验条件下,样品EAE适宜的HPCE分离条件为:电泳缓冲液体系由200mmol/L硼酸、5.4mmol/L β-CD、10mmol/L KH2PO4和27.5%乙腈组成。压力进样50mbar,5s,电压20kV、柱温20℃。在此条件下,样品EAE中各组分可以获得较好的分离,共分离出22个峰,分析时间15min,最高峰出峰时间为6.45min(图3)。
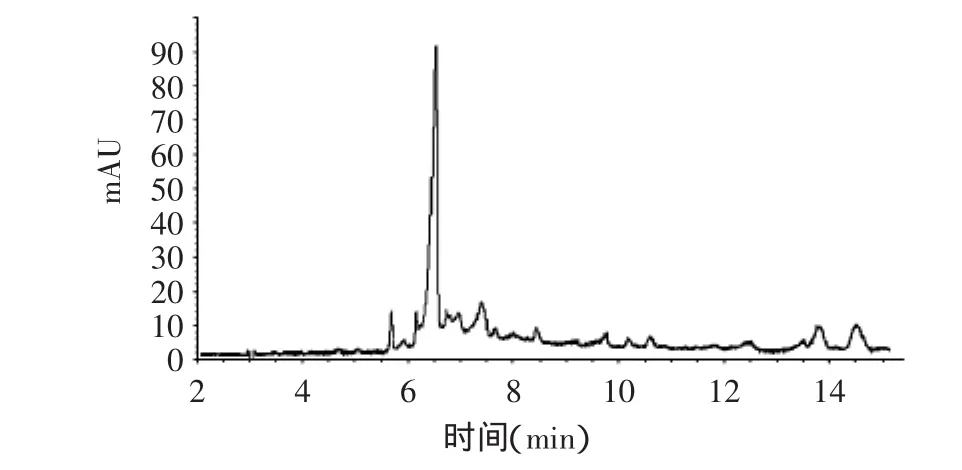
图3 样品EAE的HPCE图谱Fig.3 The HPCE atlas of sample EAE
2.3 EAE样品中各组分的定性分析
在样品EAE中各组分在现有实验条件下得到较理想分离的条件下,以标准物质对样品EAE各组分进行初步定性分析。图4是儿茶素、表儿茶素、芦丁和绿原酸等4种标准物质的HPCE图谱。
在相同的电泳分析条件下,通过比对混合标准物质和样品EAE的HPCE图谱,结合将4种标准物质分别加入样品EAE溶液后的HPCE图谱变化,初步分析认为,样品EAE中基本不含儿茶素、表儿茶素和芦丁,含少量的绿原酸(图5)。因本实验中所用标准物质种类有限,HPCE图谱中峰面积最大的组分(保留时间6.45min)还不能确定其为何种物质。
由于本实验中所用芡种壳乙酸乙酯提取物(EAE)是一个多组分混合物,样品EAE组成的确切定性还需对样品做进一步的纯化处理,并结合其他分析技术,如紫外、红外、液相色谱、液相色谱-质谱联用等方法,这将是后续的研究内容。
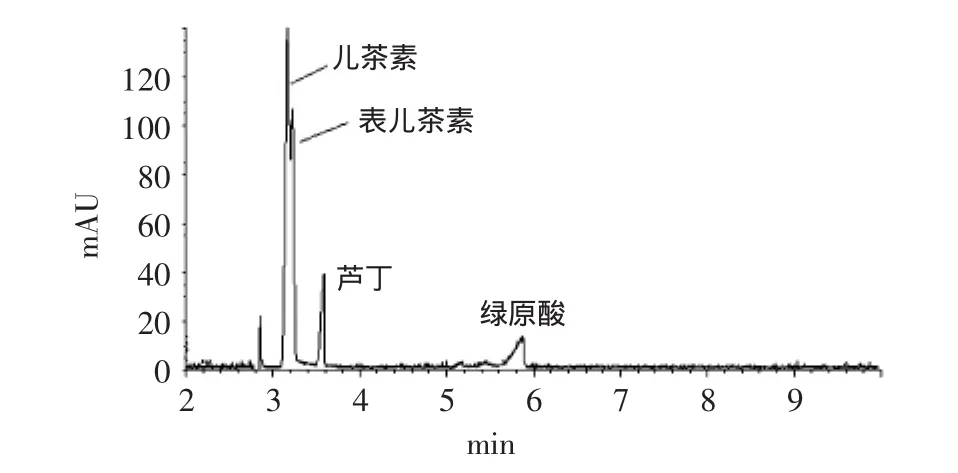
图4 混合标准样品的HPCE图谱Fig.4 The HPCE atlas of mixed standard substances

图5 添加标准物的样品HPCE图谱Fig.5 The HPCE atlas of EAE with standard substances addition
3 结论
芡植株各组织器官中均含有丰富的多酚物质,其中以实种壳中多酚含量最高(183.037mg/g,干基),是提取植物多酚的良好资源。
高效毛细管电泳(HPCE)法分离芡种壳乙酸乙酯提取物(EAE)的条件为:弹性石英毛细管柱(总长42.5cm,有效长度34cm),电泳缓冲液由200mmol/L硼酸、5.4mmol/L β-CD、10mmol/L KH2PO4和27.5%乙腈组成,检测波长230nm,压力进样50mbar,5s,在电压20kV、柱温20℃。在此条件下,样品EAE中各组分得到了较好分离,共得到22个峰。
在HPCE法分离基础上,采用标准物质定性分析认为,芡种壳乙酸乙酯提取物(EAE)中基本不含儿茶素、表儿茶素和芦丁,含少量绿原酸。HPCE图谱中峰面积最大的组分(保留时间6.45min)还不能确定其为何种物质。
[1]顾观光.神农本草经(清)[M].兰州:兰州大学出版社,2004:60.
[2]李时珍.本草纲目(明)[M].中国书店影印(三),2003:121.
[3]邓宇.表面活性剂在芡实栲胶提取中作用的初步研究[J].化学工业与工程技术,2002,23(2):1-3.
[4]王和才.芡实种皮总鞣质的提取及含量测定[J].食品工业科技,2009,30(8):224-226.
[5]张汆,薛连海,贾小丽,等.D101树脂分离纯化芡实多酚的特性研究[J].食品科学,2009,30(20):260-264.
[6]李成良,陈学好,李良俊,等.芡实黄酮类物质的提取及抗氧化性研究[J].长江蔬菜:学术版,2010(14):57-61.
[7]Jürgen Harms,Georg Schwedt.Applications of capillary electrophoresis in element speciation analysis of plant and food extracts[J].Fresenius'Journal of Analytical Chemistry,1994,350:93-100.
[8]YH Cao,Y Wang,Q Yuan.Analysis of flavonoids and phenolic acid in propolis by capillary electrophoresis[J].Chromatographia,2004,59:135-140.
[9]吕元琦,李新民.β-环糊精修饰区带毛细管电泳法测定野菊花中刺槐素、木犀草素和槲皮素[J].理化检验:化学分册,2005,41(7):464-466.
[10]Aline MCRacanicci,Bodil Helene Allesen-Holm,Leif H Skibsted.Sensory evaluation of precooked chicken meat with mate(Ilex paraguariensis)added as antioxidant[J].Eur Food Res Technol,2009,229:277-280.
[11]田树革,魏玉龙,刘宏炳.Folin-Ciocalteus比色法测定石榴不同部位总多酚的含量[J].光谱实验室,2009(2):342-344.
[12]杨会成,曾名勇,刘尊英,等.超声波、微波复合提取海带多酚的工艺研究[J].食品与发酵工业,2007(11):132-135.
[13]Ramila Guendez,Stamatina Kallithraka,Dimitris P Makris. An analytical survey of the polyphenols of seeds of varieties of grape(Vitis vinifera)cultivated in greece:Implications for exploitation as a source of value-added phytochemicals[J]. Phytochem Anal,2005,16:17-23.
[14]Hui Jiang,Baoping Ji,Jiangfen Liang,et al.Changes of contents and antioxidant activities of polyphenols during fruit development of four apple cultivars[J].Eur Food Res Technol,2006,223:743-748.
[15]Samarjit Das,Peter Der,Utpal Raychaudhuri,et al.The effect of Euryale ferox(makhana),an herb of aquatic origin on myocardial ischemic reperfusion injury[J].Molecular and Cellular Biochemistry,2006(289):55-63.
[16]刘玉鹏,刘梅,刘俊英,等.30种中草药的抗氧化活性研究[J].烟台大学学报:自然科学与工程版,2000,13(1):70-73.
Preliminary separation and identification of the ethyl acetate extract from Gorgon Nut(Euryale ferox Salisb.)seed coat
ZHANG Cuan,LI Min,JIA Xiao-li
(School of Bioamp;Food Engineering,Chuzhou University,Chuzhou 239000,China)
The gorgon nut frond tissues contained much of phenolics,which was found most in gorgon nut seed coat(183.037mg/g,dry base),and the root,leaf and the fruit peel were followed.In order to analyze the components of ethyl acetate extract(EAE)from gorgon nut(Euryale ferox Salisb.)seed coat,the main components of EAE sample were separated by the high performance capillary electrophoresis(HPCE)method and preliminaryly identified with standards.The results showed the HPCE method could be used to separate the polyphenol in the EAE sample.Analysing conditions was:springy quartz capillary column(total length is 42.5cm,effect length is 34cm),the electrophoresis buffer was made of boric acid(200mmol/L),β-cyclodextrin(β-CD,5.4mmol/L),potassium dihydrogen phosphate(10mmol/L)and acetonitrile(27.5%),sampling press was 50mbar and 5 seconds,and at 230nm wave length,20kV and 20℃ column temperature.The results indicated that no catechin,epicatechin and lutin,and little chlorogenic acid were found in EAE sample.
Gorgon nut seed coat;ethyl acetate extract;high performance capillary electrophoresis(HPCE);separation
TS201.2
B
1002-0306(2012)05-0223-04
2011-05-09
张汆(1970-),女,博士,副教授,研究方向:食品化学与营养学、膳食蛋白、功能食品。
安徽省应用化学省级重点学科建设项目(200802187C);滁州市科技计划项目(201057)。
