多孔淀粉制备工艺及应用研究进展
2012-11-15张斌,陈国
张 斌,陈 国
(华侨大学生物工程与技术系,福建厦门361021)
多孔淀粉制备工艺及应用研究进展
张 斌,陈 国*
(华侨大学生物工程与技术系,福建厦门361021)
多孔淀粉是一种用途广泛的环境友好型材料,其制备方法有物理法、化学法和生物法。在简述多孔淀粉基本性质的基础上,首先介绍了物理法和酸法制备多孔淀粉的工艺及研究现状,然后详细阐述了生物法制备多孔淀粉涉及的酶的选择、成孔机理、生淀粉的选择、预处理和制备工艺,最后对多孔淀粉的应用研究和未来多孔淀粉的研究方向进行了展望。
多孔淀粉,制备,应用
多孔淀粉(porous starch),又称微孔淀粉,指采用物理、化学及生物的方法使淀粉颗粒由表及里形成具有孔洞结构的变性淀粉颗粒,其小孔直径约为1μm,一般孔隙率为50%左右,是一种用途广泛环境友好的新型生物材料[1-2]。多孔淀粉的理化性质由颗粒结构决定,经改性处理制得的多孔淀粉颗粒,其基本性能不发生显著性改变[3],继承了生淀粉的良好生物相容性、无毒、可生物降解等性质。但淀粉颗粒的粒度、表面形貌、结晶度等发生了较为显著的改变,从而导致多孔淀粉的溶解度、糊化性质及吸附性能等相应产生变化[4-5]。因此,多孔淀粉往往具备天然淀粉所没有的独特性质[6]:更大的孔隙率;更大的比表面积;堆积密度、颗粒密度低;良好的吸水、吸油能力;干燥状态下良好的机械强度;分散在水及其他溶剂中能保持明显的结构完整性;加工过程安全、无毒、使用剂量不受限制。在国外,多孔淀粉已被广泛应用于食品、医药卫生、农业、造纸、印刷、化妆品、洗涤剂等行业,但在我国仍处于生产与应用的起步阶段,且对多孔淀粉制备工艺的研究亦较盲目[7]。本文对多孔淀粉的制备工艺进行了较详细的综述,并重点阐述应用潜力较大的生物法制备多孔淀粉工艺。
1 多孔淀粉的制备
1.1 物理法
物理法制备多孔淀粉主要通过超声波处理、喷雾、醇变性、机械撞击和挤压等方法实现[2]。Degrois等[8-9]用超声波对淀粉悬浮液处理一段时间,发现淀粉表面形成许多锥形坑,表面布满凹坑的淀粉较生淀粉的比表面积更大、吸附能力更佳。进一步研究表明超声波对淀粉表面的腐蚀程度主要受周围气体种类的影响,在氢气中淀粉表面形成的坑较空气和氧气的深,在二氧化碳中的腐蚀较弱,而在真空环境下几乎不腐蚀。喷雾干燥是将淀粉溶液雾化后与热气流接触而瞬间干燥的方法,普渡大学研究人员将不同淀粉与少量黏结剂混合,喷雾干燥后形成一种多孔性的端聚物球体可吸附食物组分如香味,还可控制香味从多孔颗粒中的释放,Yan等[10]发现,喷雾干燥制得的变性淀粉,DE值较低,且颗粒中空、外形规则。通过醇变性也可制得多孔性淀粉,姚卫蓉等[11]在糊化的籼米粉中加入乙醇,再冷冻干燥,得到表面含孔状结构的淀粉颗粒。机械撞击法是指将淀粉固定在一块金属板上,然后通过高速金属粒子的撞击在淀粉表面形成一些凹坑。挤压法[10]是在高剪切力和温度下对淀粉颗粒进行机械挤压,制得的产品外观呈不规则的石头状,内部为孔洞结构,其微结构受淀粉材料对剪切、温度及挤压过程的温度上升速率的敏感性影响。
物理法制备多孔淀粉的工艺目前尚未实现工业化,因为由物理法制得的多孔淀粉多在表面形成部分腐蚀和凹坑,未形成纵横贯穿的多孔结构,其吸附能力增加有限,所以物理法作为单一制备方法的应用前景并不乐观[2]。但在制备多孔淀粉的过程中,物理处理却是一种很好的预处理手段,不仅可以明显提高淀粉颗粒对酶的敏感性,而且还降低了反应条件,故常被用作生物法制备多孔淀粉的一种辅助手段。
1.2 化学法
酸水解是化学法制备多孔淀粉主要手段,而酸法中又以盐酸水解为主。酸法制备多孔淀粉的一般工艺流程[12-14]为:淀粉→加入盐酸溶液调配成匀质淀粉乳→恒温震荡→加入饱和碳酸钠溶液中→抽滤→洗涤数次除去残留NaCl和Na2CO3→鼓风干燥→研磨成粉得多孔淀粉。
此法的关键在于反应条件的控制,酸对淀粉的水解作用受盐酸浓度、温度、反应时间、搅拌速度等因素的影响[13-14]。盐酸浓度是决定多孔淀粉形成的关键因素,当其高于6.0%时,小麦淀粉极易糊化,很难形成多孔淀粉;而低于0.5%时,酸对淀粉的性能影响非常微弱,较适宜的浓度为0.5%~6.0%。反应温度对淀粉水解的影响较大,应严格控制,一般选择40~50℃,越接近糊化温度,淀粉对温度越敏感,淀粉链间的氢键越易断裂,缺少氢键连接的松散结构易被酸侵蚀而无法保持颗粒的完整形态,同时,升高温度可破坏淀粉粒表面的水束层,使盐酸易与淀粉表面结合,反应容易进行。多孔淀粉的吸油率还受反应时间的影响,随时间的延长而增加,但一段时间后增幅减少。可能由于先反应的是淀粉颗粒中无定形区域的支链淀粉,其结构松散,在盐酸作用下反应较快,随时间变化性较强。当非结晶区域反应完成以后,继续反应结晶区的直链淀粉和支链淀粉,而结晶区的直链淀粉结构紧密,具有耐酸特性,反应时间较长,吸油率增加不明显。周小柳等[14]通过正交实验,以多孔淀粉的吸水率、吸油率为指标考察不同反应条件对盐酸制备小麦多孔淀粉的影响,发现各因子的影响顺序依次为:盐酸溶液浓度>反应温度>反应时间>搅拌速度,并综合考虑进一步选定最佳工艺:盐酸浓度4.0%,反应时间16h,反应温度45℃,搅拌速度为1500r/min。
与可工业化的酶法相比,酸法具有较大的价格优势。但酸法中淀粉水解的速率较慢,随机性强,不易形成孔状结构,且经酸水解的淀粉,其结构较脆弱,因此酸法制备多孔淀粉还停留在实验阶段[13]。
1.3 生物法
生物法即酶水解法,利用酶对淀粉进行部分水解产生多孔淀粉。酶解生产多孔淀粉的工艺简单易行、所得产品吸附性好、安全性高、综合品质优良,较适合工业化生产[2]。下面将从酶的选择及成孔机理、生淀粉的选择、原料的预处理和制备工艺等方面对酶法制备多孔淀粉的现状进行概述。
1.3.1 酶的选择及成孔机理 生淀粉酶是酶法制备多孔淀粉的关键因素。生淀粉酶指可直接在糊化温度以下水解未糊化淀粉的酶,种类有α-淀粉酶、β-淀粉酶、葡萄糖淀粉酶、异淀粉酶、脱枝酶、普鲁蓝酶、磷酸化酶等,来源包括曲霉、细菌、酵母、动物体内的消化液、植物、发芽的种子等[2]。不同的酶对生淀粉的水解差异较大,有的能将淀粉颗粒大部分降解,有的却只在表面形成轻微腐蚀。Aggarwal等[15-16]用糖化酶水解四种不同来源的生淀粉,酶解后大部分颗粒都能在表面形成凹坑或孔洞,且随着酶浓度及酶解时间的增加,水解程度加剧直至完全瓦解。Sujka等[17]通过SEM和AFM的观察发现,枯草芽孢杆菌α-淀粉酶水解的玉米和马铃薯淀粉颗粒表面,形成约121nm左右的孔和凹坑。姚卫蓉等[18]对国内十种具代表性的生淀粉酶进行活力测定,结果显示糖化酶、α-淀粉酶均有水解生淀粉能力,且糖化酶普遍较强,而β-淀粉酶无活力,进一步用糖化酶、α-淀粉酶水解籼米粉,得到多孔淀粉。有研究者认为[19-20],联合使用α-淀粉酶和糖化酶的水解效果更佳,且两者的质量比为1∶1~1∶4时产品性能最优。综合可知,选用糖化酶或α-淀粉酶将更易制得多孔淀粉,且复合酶的效果更佳。
α-淀粉酶及糖化酶的酶解机理较为清楚,分子水平上,α-淀粉酶通过任意水解淀粉链中相邻葡萄糖间的1,4-糖苷键降解淀粉,主要产物为麦芽糖。糖化酶则从淀粉链的非还原性末端一步水解出单个的葡萄糖残基,且还能水解支链淀粉支链中的1,6-糖苷键[15-16]。颗粒水平上,通过两种方式影响淀粉颗粒[17]:a.腐蚀颗粒的表面形成裂缝和凹坑; b.沿着颗粒上的通道一直水解到中心,颗粒的完整性被弱化,最后完全裂解。姚惠源等[21]对复合酶法的成孔机理进行了考察,首先,糖化酶沿着淀粉分子的非还原末端逐级降解,水解颗粒表面的不规则部分及无定形区,其次,随着水解的进行,淀粉的溶涨使α-淀粉酶能接近颗粒内部,其随机内切作用为糖化酶提供新的非还原性末端,两者的协同作用不仅提高了水解速度,也使水解沿着更多的点向颗粒内部推进,最终形成中空的多孔结构。
1.3.2 生淀粉的选择 淀粉是一种天然植物多糖,以颗粒形式广泛存于植物的果实、根、茎中,根据植物学来源的不同可分为谷物类、豆类、棕榈类以及根茎类等几个亚系[19]。不同来源的淀粉对酶的敏感性不一致,一般谷物类强于根茎类,并非所有淀粉皆能水解成多孔淀粉。除来源外,淀粉的水解还受颗粒结构的影响[19],如:直链和支链淀粉的含量、粒径、晶体类型及天然孔等。直链淀粉能维持颗粒的完整性,含量越高颗粒越难水解,姚卫蓉等[22]对7种不同直链淀粉含量的稻米淀粉的研究显示,直链淀粉含量与淀粉的水解率在1%水平上呈显著负相关。原料的粒径影响其对酶的吸附量,Aggarwal[16]认为小颗粒淀粉的水解快于大颗粒,因为小颗粒的可利用表面区域较大,吸附的酶量更多。淀粉颗粒的晶体结构分A型、B型和C型三种,C型为A、B型的混合物,谷物淀粉多属A型,根茎淀粉多为B型,而豆类淀粉则C型居多,一般A型晶体相对水解率最高,其次为C型,B型最低[22]。淀粉颗粒表面的天然孔可促进其水解,Fannon等[23]认为这些孔可能是酶作用的最初位点,酶吸附其上,不断扩大孔径并向内部推进,研究表明,蜡质和普通玉米淀粉颗粒均存在微孔,大麦、燕麦、稻米及小麦则无。综合考虑[22,24],生淀粉对酶的敏感顺序为:蜡质玉米>小麦>普通玉米>绿豆>木薯>籼米>红薯>高直链玉米>土豆,表1是几种常见淀粉的基本性质。由文献可知,选用谷物类的玉米淀粉、籼米淀粉、小麦淀粉、大麦淀粉,和根茎类的木薯淀粉、甘薯淀粉、土豆淀粉等更易制得多孔淀粉,其中又以玉米淀粉和籼米淀粉最为常用。
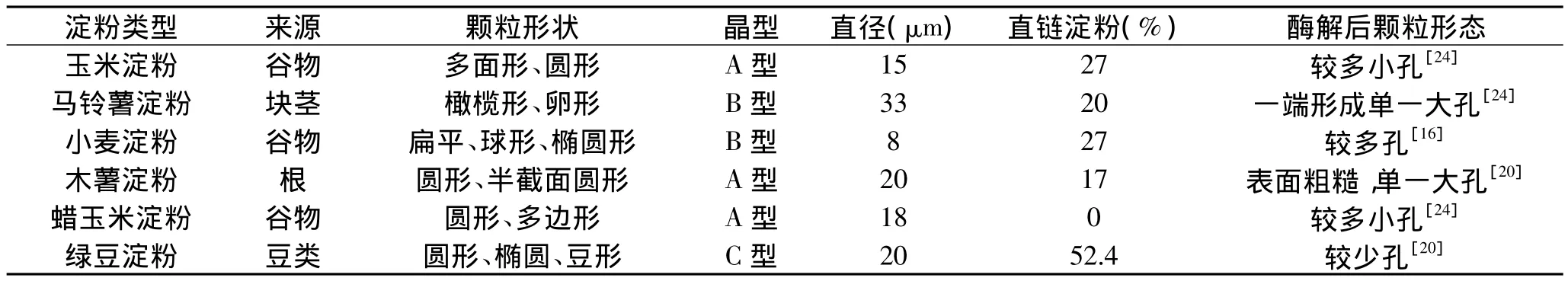
表1 几种常见淀粉的基本特征Table 1 The basic characteristics of several common starch
1.3.3 预处理 低于糊化温度时,生淀粉对酶的敏感性较低,故生物法常需加大酶量或延长反应时间以提高产率。研究表明,加入适当的预处理可显著提高生淀粉对酶的敏感性,降低反应条件,且制得的产品性能更佳,一般的预处理手段有物理法和化学法两类。
物理法中以研磨处理和热处理最为常用。研磨即机械球磨,对淀粉的颗粒结构和理化性质都有一定的影响[5,25],研磨后颗粒会部分破碎且表面出现微孔和裂缝,结构上,内部双螺旋的有序排列会因氢键遭破坏而弱化,使颗粒的无定型区域增加、结晶度减少,但直链淀粉的含量及内部结构仍保持不变;理化性能上,淀粉的吸水性、溶水性和膨胀度都显著提高,糊化粘度变化较小,糊化温度和焓则表现为降低。热处理指酶解前对淀粉预热,包括恒温预热和退火处理。恒温预热的条件较温和,Shariffa等[19]用60℃的水浴对木薯和甜土豆淀粉预热30min,结果显示,预热后的淀粉颗粒表面变得粗糙、多孔,对酶的吸附能力和敏感性提高,且酶解时的水解率显著增加。退火即淀粉在过量水中逐级加热到玻璃化温度以上糊化温度以下的过程,Brien等[24]对五种商业淀粉进行退火处理,发现蜡质和普通玉米淀粉对α-淀粉酶及糖化酶的敏感性不变,但HylonV、VII和马铃薯淀粉的α-淀粉酶水解及马铃薯淀粉的糖化酶水解都增强了,可能是B型晶体结构较A型更易受退火处理影响的缘故。
化学法包括碱液浸泡和交联变性。碱液浸泡是一种常用的预处理手段,Nadiha等[26]研究西米、马铃薯和玉米淀粉对碱液的敏感性时发现,在0.025mol/L的NaOH溶液中浸泡30d后,三种淀粉的颗粒表面均出现不同程度的腐蚀,且直链淀粉含量都显著减少,颗粒的膨胀力和溶解性增加,但糊化性能并未受太大影响。多孔化后的淀粉颗粒结构稳定性低,通过交联改性可有效改善颗粒机械性能[27]。根据淀粉的醇羟基与交联剂的多元官能团结合形式不同,其交联作用可分为醚化和酯化交联,常用的交联剂有环氧氯丙烷、三偏磷酸钠、三氯氧磷等。周美琴[27]分别以环氧氯丙烷和三偏磷酸钠为交联剂,探讨醚化、酯化及复合交联对玉米多孔淀粉的影响,结果显示交联后颗粒仍呈蜂窝状且晶型不变,但结晶度有所下降;颗粒平均粒径增加,且粒径分布的均一性提高;颗粒的比表面积减小,平均孔径和比孔容都增大。
1.3.4 制备工艺 生物法工艺简单,产品性能好,工业化潜力巨大。其工艺流程为[20]:淀粉→加入一定pH的缓冲液调浆→加酶水解→灭酶活→过滤→洗涤→干燥→多孔淀粉。生产多孔淀粉时,既要保证颗粒表面布满小孔,又要使其完整,这就需要选择合适的制备条件,因此目前生物法的研究主要集中在工艺条件的优化上。
影响酶法水解的因素主要有酶的种类及用量,生淀粉的来源和反应条件等[28]。实验证明[20],α-淀粉酶和糖化酶无论单一或混合使用都能水解生淀粉,得到带孔颗粒,因此常作为制备多孔淀粉的水解酶。除种类外,酶用量对淀粉的水解也影响较大,Aggarwal等[15]发现酶量为0.8IU时,玉米淀粉颗粒的表面只发生轻微改变,十倍地增加酶量(8IU),则出现很大的针孔,当增加到80IU时,颗粒的骨架结构几乎被毁。合适的反应条件是酶法的关键,早期Whistler对酶法的制备工艺进行了研究,并在反应温度低于50℃,时间8~24h,酶量0.5%~1.0%,pH为4.2~5.5的情况下制得多孔淀粉。生淀粉的来源不同,制备工艺往往也不一致。胡霞等[29]认为粳米多孔淀粉的最佳制备工艺为:温度30℃,反应时间8h,pH4.0,底物浓度0.5g/L,酶量30%(理论水解30%淀粉的加酶量),该条件下制得的产品吸油率达105.97%。徐忠等[30]则在温度45℃,pH4,酶用量为1%,时间24h的工艺下,制得吸胭脂量3.12mg/g、吸油脂率89.75%的马铃薯多孔淀粉。
来源不同的淀粉对酶的敏感性不一致,即使来源相同,若改变工艺参数,则所得的多孔淀粉其孔的数目、大小、深度,颗粒坚固性及结构稳定性都会改变,因此,在选择多孔淀粉的最佳制备工艺条件时,应综合考虑这些相关的影响因素,形成稳定的工艺条件。
2 多孔淀粉的应用
2.1 微囊化
多孔淀粉的比表面积大、载物能力强,是一种良好的微胶囊芯材,吸附目的物后,对其进行合适的壁材包埋即得微胶囊,在特定环境下通过一定的机械挤压或壁材的溶解可释放目的物[31]。根据目的物的性质不同,微囊化应用可分为以下几类:a.改善目的物的稳定性及溶解性,通过对一些在常态下易挥发、易变性及难溶的物质进行微囊化,可显著提高其稳定性和溶解性,如DHA、维生素E、维生素A、姜黄素、薄荷油等[6]。姜黄素是一种具多种生物学活性的可食用色素,但稳定性低且不溶于水,只能用作色素添加剂和防腐剂,Wang等[32]以多孔淀粉为芯材、可食用动物胶作壁材,喷雾干燥制得一种姜黄素微胶囊,结果显示,这种微胶囊的水溶性和稳定性显著高于自由姜黄素,且仍具有对食物类病原菌的抗细菌和真菌的能力。b.控制目的物的特定释放。Tetsuro[33]以多孔淀粉为芯材吸附蛋白酶 YP-SS及Alcalase,冷冻干燥后再通过不同溶解性的壁材包埋,可使Alcalase只在肠液中释放,而蛋白酶YP-SS却在胃液中释放。c.封闭苦味、臭味,一些功能性食品如:森林匙羹藤酸[6]、大豆短肽[34]等常含异味,通过微囊化可提高其食用品质。
2.2 吸附
多孔淀粉是一种具有广泛用途的吸附剂,不仅吸附能力强,且吸附工艺简单[6,17]:当目的物为液体时,将其喷雾到多孔淀粉上,或直接将淀粉颗粒加入其中,再经过滤或离心分离出吸附后的颗粒,最后干燥即可,载物量可通过调节目的物在溶液中的浓度来控制;目的物为固体时,将两者高速混合即可。多孔淀粉作吸附剂主要有以下几个用途:a.减缓医药品、农业用品的释放速度,提高其利用率,如阿司匹林[35]、氨苄青霉素[36]、除草剂[37]等。Ishli将水不溶性的2,4-D与多孔淀粉一起分散在水中,吸附一段时间后抽滤、干燥制得的除草剂,可明显延长其使用时间。b.油脂或溶于油脂的物质粉末化,如鱼油、胱氨酸等[6],粉末后的油脂稳定性好、耐储存、运输方便,且载油量也较高。c.防止高倍率均质稀释物质或密度大的物质均质混合的粉体分离,如化妆品、萘普生[38]等。d.用于生物质及生物过程的吸附,如肽、蛋白质、酶,甚至是活菌等[17,33]。e.在化工行业中,多孔淀粉也大有用途,如在造纸业,多孔淀粉可增强纸张表面强度,提高产品质量[7];在洗涤业,包埋了香味或织物柔软剂的多孔淀粉可作洗涤剂的辅助添加剂[39];多孔淀粉还可用于污水处理,吸附污水中的染料成分[40]。
2.3 其他
除作微胶囊芯材及吸附剂用途外,多孔淀粉还有望成为一种理想的脂肪替代物。脂肪的日常摄入是人体所必须的,但过多则会引发多种疾病,Whistler[41]曾对多孔淀粉进行一系列的处理,以改变其流变学特性和感官性质,然后将颗粒粉碎至0.1~1μm,制得的产品可部分或完全替代食品中的脂肪。多孔淀粉还可作为多功能性材料的支架,用于制备多孔型的碳球体[42]。碳球体是一种极具有潜在应用价值的碳材料,可用于催化剂载体、药物缓释、润滑材料、气体存储介质、锂离子二次电池等,Wang[1]在玉米多孔淀粉的表面涂上一层Na2SnO3或Na2SiO3,然后将其碳化,得到一种多孔型碳球体,经电化学性能检测后发现,这种碳球体在50个循环后能维持513mA/g的比容,是一种很好的锂离子电池阳极材料。
3 展望
多孔淀粉是一种用途广泛的变性淀粉,其制备方法有物理法、化学法以及生物法,工业中制备多孔淀粉以生物法为主。生物法制备多孔淀粉的工艺简单易行,所得产品吸附性好、安全性高、综合品质优良。随着多孔淀粉在医药、农业以及其它领域应用的逐渐展开,生物法生产多孔淀粉的工业化变得越来越重要。
现今国内对生物法的研究仍停留在工艺参数的寻找上,距工业化生产还有一定的距离,仅个别厂家利用酶法进行试生产。这主要是由于影响多孔淀粉形成及性能的因素较多,生物法不仅要找到互相匹配的生淀粉酶和生淀粉,而且还要掌握生物法的主要工艺条件,如酶用量、pH、反应时间和反应温度等。对于同一个工艺条件,如果选用不同来源的生淀粉或生淀粉酶,得到的结果往往不一致,因此生产的稳定性及产品的稳定性难以保证。所以,生物法的关键是研究其成孔机理,根据需要可控孔结构和孔隙率,稳定生产产品质量均一的多孔淀粉。多孔淀粉未大规模生产的另一原因是其应用研究进展较慢,大多仍停留在实验室阶段,因此加大多孔淀粉在各领域的应用研究开发力度,是多孔淀粉工业化生产的前提。
[1]Wang H,Dai Q,Li Q,et al.Preparation of porous carbon spheres from porous starch[J].Solid State Ionics,2009,180(26-27):1429-1432.
[2]姚卫蓉,姚惠源.多孔淀粉概述[J].粮食与饲料工业,2004 (3):25-27.
[3]NodaT,TakigawaS,Matsuura-EndoC,etal.The physicochemical propertiesofpartially digested starch from sprouted wheat grain[J].Carbohydrate Polymers,2004,56(3): 271-277.
[4]Raina C,Singh S,Bawa A,et al.A comparative study of Indian rice starches using different modification model solutions[J].LWT-Food Science and Technology,2007,40(5):885-892.
[5]Martinez-Bustos F,Lopez-Soto M,San Martin-Martinez E,et al.Effects of high energy milling on some functional properties of jicama starch(Pachyrrhizus erosus L.Urban)and cassava starch (Manihot esculenta Crantz)[J].Journal of Food Engineering,2007,78(4):1212-1220.
[6]姚卫蓉,姚惠源,刘传宁.多孔淀粉的应用[J].粮食与饲料工业,2001(1):45-47.
[7]许丽娜,董海洲,张绪霞,等.多孔淀粉制备及开发前景[J].粮食与油脂,2007(2):18-20.
[8]Degrois M,Gallant D,Baldo P,et al.The effects of ultrasound on starch grains[J].Ultrasonics,1974,12(3):129-131.
[9]Gallant D,Degrois M,Sterling C,et al.Microscopic Effects of Ultrasound on the Structure of Potato Starch Preliminary Study[J].Starch-St rke,1972,24(4):116-123.
[10]Yan H,Zhengbiao G.Morphology of modified starches prepared by different methods[J].Food Research International,2009,43(3):767-772
[11]姚卫蓉,姚惠源.醇变性糊化籼米粉的研究[J].粮食与饲料工业,2000(6):44-45.
[12]Niemann C,Whistler R.Effect of acid hydrolysis and ball milling on porous corn starch[J].Starch-St rke,1992,44(11): 409-414.
[13]杨巍巍,印方平.酸法制备玉米多孔淀粉的工艺优化及其产品特性的研究[J].现代食品科技,2009,25(5):538-541,545.
[14]周小柳,唐忠锋,陈晓伟.盐酸制备小麦微孔淀粉的性能及结构研究[J].食品工业科技,2009,30(3):237-239.
[15]Aggarwal P,DollimoreD.Degradationofstarchyfood material by thermal analysis[J].Thermochimica Acta,2000,357: 57-63.
[16]Aggarwal P,Dollimore D.A thermal analysis investigation of partially hydrolyzed starch[J].Thermochimica Acta,1998,319 (1-2):17-25.
[17]Sujka M,Jamroz J.[alpha]-Amylolysis of native potato and corn starches-SEM,AFM,nitrogen and iodine sorption investigations[J].LWT-Food Science and Technology,2009,42 (7):1219-1224.
[18]姚卫蓉,姚惠源.多孔淀粉的研究Ⅰ酶和原料粒度对形成多孔淀粉的影响[J].中国粮油学报,2001(1):36-39.
[19]Shariffa Y,Karim A,Fazilah A,et al.Enzymatic hydrolysis of granular native and mildly heat-treated tapioca and sweet potato starches at sub - gelatinization temperature[J] .Food Hydrocolloids,2009,23(2):434-440.
[20]Uthumporn U,Zaidul I,Karim A.Hydrolysis of granular starch at sub-gelatinization temperature using a mixture of amylolytic enzymes[J].Food and Bioproducts Processing,2010,88(1):47-54.
[21]姚卫蓉,姚惠源.多孔淀粉的形成过程[J].食品与生物技术学报,2005(3):94-97.
[22]姚卫蓉,姚惠源.淀粉性质及预处理对多孔淀粉形成的影响[J].中国粮油学报,2005(5):55-60.
[23]Fannon J,Hauber R,BeMiller J.Surface pores of starch granules[J].Cereal Chem,1992,69(3):284-288.
[24]O'Brien S,Wang Y.Susceptibility of annealed starches to hydrolysis by[alpha]-amylase and glucoamylase[J]. Carbohydrate Polymers,2008,72(4):597-607.
[25]Cavallini C,Franco C.Effect of acid-ethanol treatment followed by ball milling on structuraland physicochemical characteristics of cassava starch[J].Starch-St rke,2010,62(5): 236-245.
[26]Nor Nadiha M,Fazilah A,Bhat R,et al.Comparative susceptibilities of sago,potato and corn starches to alkali treatment[J].Food Chem,2010,121(4):1053-1059.
[27]徐忠,周美琴.不同交联处理对玉米多孔淀粉颗粒结构的影响[J].精细化工,2009(5):489-492.
[28]Oezbek A.|á-Amylase inactivation by temperature during starch hydrolysis[J].Process Biochemistry,2004,39(9):1137-1144.
[29]胡霞,李晓琪,姚卫蓉.粳米多孔淀粉的制备工艺研究[J].粮食与饲料工业,2006(2):14-16.
[30]徐忠,张亚丽.马铃薯微孔淀粉的制备及吸附性能研究[J].化学与黏合,2005(1):24-27.
[31]张燕萍,李世勇.变性淀粉作VE微胶囊壁材的研究[J].粮食与饲料工业,2001(6):36-37.
[32]Wang Y,Lu Z,Wu H,et al.Study on the antibiotic activity of microcapsule curcumin againstfoodborne pathogens[J]. International journal of food microbiology,2009,136(1):71-74.
[33]Yoshimaru T,Matsumoto K,Kuramoto Y,et al.Preparation of microcapsulated enzymes for lowering the allergenic activity of foods[J].J Agric Food Chem,1997,45(10):4178-4182.
[34]IshiiT,Hasegawa N,Katsuro M,et al.Powdery pharmaceutical preparation and method of manufacturing same[P].JP:1995017909,1995.
[35]Masumi K,HirotakaH,KazumasaS.Porouscarrier,preparation produced therefrom and their production[P].JP: 5112469,1993.
[36]Mundargi R,Shelke N,Rokhade A,et al.Formulation and in-vitro evaluation of novel starch-based tableted microspheres for controlled release of ampicillin[J].Carbohydrate Polymers,2008,71(1):42-53.
[37]Ishii T,Hasegawa N,Katsuro M,et al.Powder preparation and a process for preparing the same[P].US:5919486,1999.
[38]Nagata K,Okamoto H,Danjo K.Naproxen particle design using porous starch[J].Drug DevIndPharm,2001,27(4): 287-296.
[39]Angell A,Surutzidis A,Kvietok F,etal.Processfor producing a particulate laundry additive composition for perfume delivery[P].US:5648328,1997.
[40]DelvalF,Crini G,Bertini S,et al.Preparation,characterization and sorption properties of crosslinked starchbased exchangers[J].Carbohydrate Polymers,2005,60(1): 67-75.
[41]Whistler R.Subgranular crystalline starch as fat substitute[P].US:5580390,1996.
[42]Wang X,Wang H,Dai Q,et al.Preparation of novel porous carbon spheres from corn starch[J].Colloids and Surfaces A: Physicochemical and Engineering Aspects,2009,346(1-3): 213-215.
Research progress in preparation process and application of porous starch
ZHANG Bin,CHEN Guo*
(Department of Bioengineering and Biotechnology,Huaqiao University,Xiamen 361021,China)
Porous starch is a versatile environmentally friendly materials.The methods of porous starch preparation include physical,chemical and biological.With the brief introduction of the basic properties of porous starch,it presented the technological processes and research status of the physical and chemical methods for porous starch preparation.Furthermore,the paper focused on the selection of enzymes,the pore formation mechanism,the selection of raw starch,the pretreatment and the processes of the biological method for porous starch preparation. In the end,the application and future development of porous starch were prospected.
porous starch;preparation;application
TS231
A
1002-0306(2012)02-0399-05
2010-11-01 *通讯联系人
张斌(1986-),男,硕士,研究方向:生物化工。
国家自然科学基金(20906035);华侨大学基本科研业务费专项基金(JB-SJ1008);泉州市科技人员服务企业专项(2010N21)。
