萜类微生物生物合成研究进展
2012-11-14高允允王秋艳黄黎锋李海峰
高允允,王秋艳,黄黎锋,李海峰
(杭州师范大学生物医药与健康研究中心,浙江 杭州 311121)
萜类微生物生物合成研究进展
高允允,王秋艳,黄黎锋,李海峰
(杭州师范大学生物医药与健康研究中心,浙江 杭州 311121)
萜类是一类具有重要研究及药用价值的天然化合物.近年来,随着萜类合成途径中各种关键酶基因克隆、异源表达和功能鉴定,许多萜类生物合成途径逐渐清晰.以萜类微生物生物合成过程中的中间产物为线索,综述了应用代谢工程、合成生物学、系统生物学等技术开展的萜类微生物生物合成的研究进展.
萜类;微生物;生物合成
萜类化合物是广泛存在于植物、微生物、昆虫中的一类具有丰富种类多样性和复杂结构多样性的天然化合物,在天然药物、高级香料、食品添加剂、杀虫剂、除草剂等方面都具有广泛应用[1-3],对人类的健康、生产和生活具有重要价值.但是萜类作为次生代谢产物,在天然原料中的含量极低,直接提取纯化难度大、成本高,不利于其规模化生产和广泛应用.随着萜类合成研究的不断进展,多种萜类的生物合成途径得以解析.利用分子生物学技术将萜类合成途径中的多个酶基因克隆后导入微生物重组表达,重组酶在细胞内重新组建合成途径,利用微生物的基础代谢分子为起始物完成萜类的合成,称为萜类的微生物生物合成.微生物生长速度快、发酵成本低等的优势将极大降低萜类生产成本;并且与植物相比遗传背景更清晰的微生物易于进行遗传改造,为通过代谢工程和合成生物学技术大幅提高萜类产量以及发掘新结构、新活性的萜类衍生物提供了便利.萜类微生物生物合成研究开发了明显优于传统的天然提取分离的生产技术的新的萜类生产技术,为未来萜类的工业化生物合成生产奠定基础.
本文将以研究较多的紫杉醇和青蒿素两种高价值萜类化合物为主要阐述对象,对微生物生物合成萜类化合物的研究进展进行综述总结.
1 紫杉醇
紫杉醇(taxol)又称红豆杉醇,最早从太平洋红豆杉Taxusbrevifolia的树皮中分离得到的一类具有显著抗癌活性的二萜类化合物,紫杉醇类药物已经被广泛用于临床治疗.紫杉醇的生物合成途径如图1所示.由紫杉烯合酶(taxadiene synthase)催化香叶基香叶基二磷酸(GGPP)环化生成的紫杉烯(taxadiene)是具有紫杉烷母核结构的第一个重要中间体,该化合物再经一系列氧化、羟化反应生成紫杉醇.
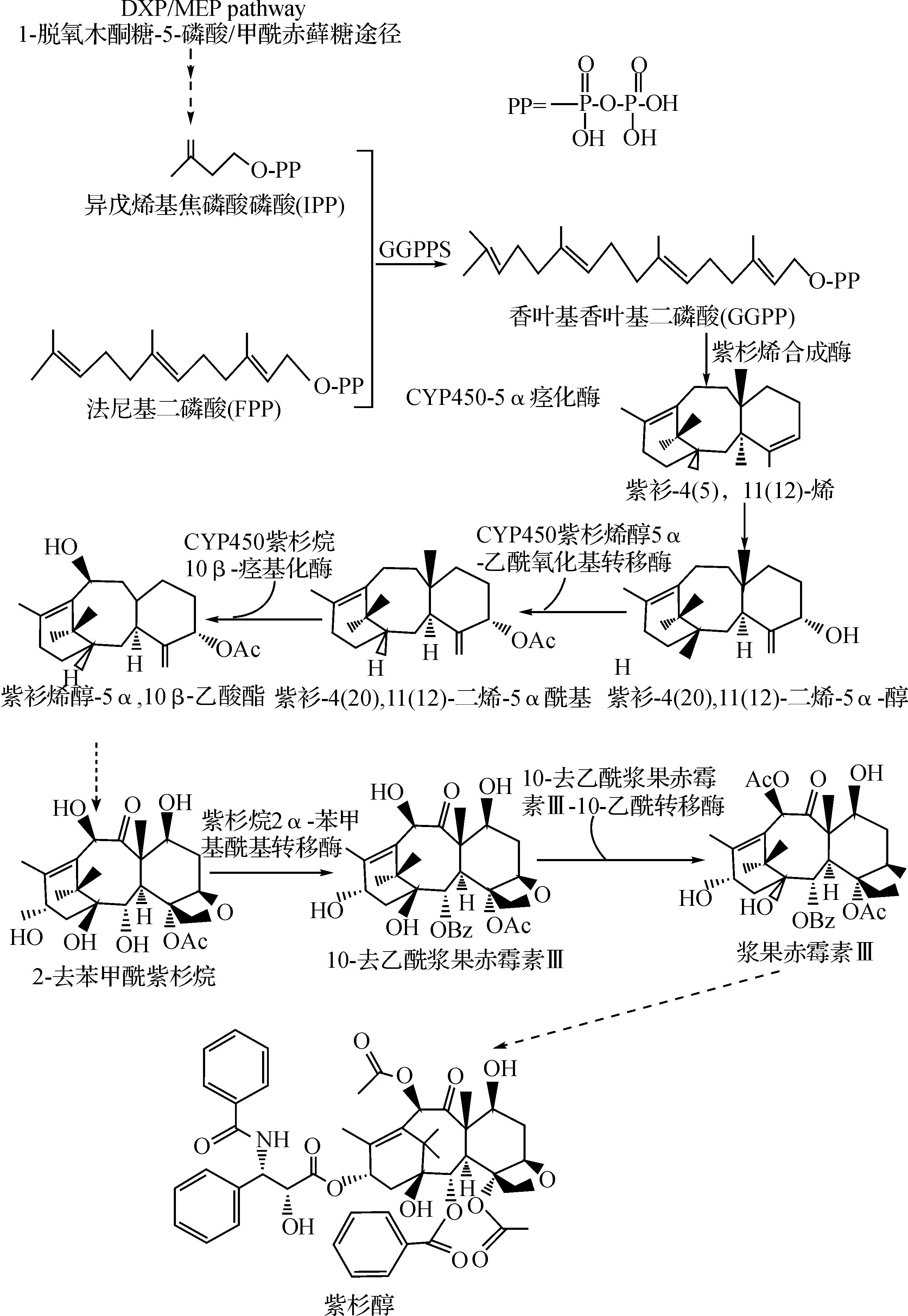
图1 紫杉醇生物合成途径Fig.1 The biosynthetic pathway of taxol
1.1大肠杆菌中紫杉烯生物合成研究
大肠杆菌有自身的脱氧木酮糖-5-磷酸途径(DXP),可以提供紫杉烯合成需要的异戊烯焦磷酸(IPP)前体,但是大肠杆菌缺乏自身的GGPP合成酶,无法进一步提供合成所需的GGPP.因此在大肠杆菌中合成紫杉烯,不仅需要导入紫杉烯合成酶还要导入外源的GGPP合成酶.Huang等[4]将IPP异构酶、GGPP合酶和紫杉烯合酶3个基因导入大肠杆菌进行共表达,获得了1.3 mg/L培养物紫杉烯.Ajikumar等[5]将紫杉烯的生物合成途径分成负责供应IPP前体的上游DXP途径模块,和负责紫杉烯合成的下游GGPP合酶和紫杉烯合酶模块,通过多变量模块优化的方法对2个合成模块的进行参数变量优化,例如启动子强度和质粒拷贝数等,探索出使这2个合成途径达到最佳平衡状态的培养条件,从而提高了紫杉烯的产量,使之达到了大约1 g/L发酵液(相当于初始产量的15 000倍).
虽然大肠杆菌具有培养条件简单、生长周期短、适合高密度发酵等优点,适宜用来生物合成紫杉烯,但是大肠杆菌几乎无法活性表达植物来源的P450酶,因此不适合用来合成紫杉烯下游产物.
1.2 酿酒酵母中紫杉醇生物合成
相对于大肠杆菌缺少GGPP合成途径,酿酒酵母自身具有类异戊二烯/固醇代谢途径,该途径合成的GGPP可用于生物合成紫杉醇中间体紫杉烯.由紫杉烯到紫杉醇需要多个II型P450氧化酶参与,相对于大肠杆菌的简单细胞结构,酿酒酵母具有完整的细胞内膜系统,可以确保与紫杉醇生物合成相关的羟化酶基因的活性表达.因此,酿酒酵母表达系统非常适合于紫杉烯及其下游中间体的生物合成研究.
虽然酿酒酵母自身具有GGPP合成途径,但是其代谢流仅能满足自身所需的甾醇和麦角固醇等萜类的合成需要,为了合成大量紫杉烯及其下游产物,需要通过外源表达增加合成途径的限速步骤的催化酶(例如羟甲基戊二酰CoA还原酶,HMGR)的表达量,从而提高IPP和GGPP供应量.甾醇和麦角固醇合成需要消耗IPP和GGPP前体,对于紫杉烯的合成具有很强的前体竞争抑制作用.因此减少前体竞争性抑制是提高酿酒酵母合成紫杉烯的产量的关键.Engels等[6]将修饰过的HMGR的基因,导入含有紫杉烯合成酶,并且敲除了甾醇和麦角固醇合成酶的酿酒酵母工程菌中,紫杉烯产量提高了50%;而导入密码子优化过的硫化叶菌(Sulfolobusacidocaldarius)的GGPP合酶基因使得紫杉烯的产量提高了40倍,高达8.7±0.85 mg/L,但同时副产物GGPPOH(拢牛儿基拢牛儿基醇)的产量为33.1 mg/L.这些结果虽然消除了部分前体竞争抑制,但是说明增加的GGPP代谢流仍然有很大部分并没有用来合成目的产物,具体原因尚不明朗,但同时也暗示代谢流如果都能用来合成紫杉烯,其产量可以进一步提高.
P450酶在紫杉醇生物合成中起着关键的作用.紫杉醇生物合成途径中大约一半的酶催化反应是在P450单加氧酶的催化下完成的.由紫杉烯到紫杉醇分子的合成途径尚不完全清晰,但已知至少有10多步酶催化反应,大部分为P450酶参与的氧化还原反应,产生的中间体分子多达上百种.虽然紫杉醇只是其中几种中间体的终产物,但催化反应之间的相互作用,中间体之间的相互竞争作用对紫杉醇的合成具有重要作用.因此研究紫杉醇合成途径中的P450酶对于阐明紫杉醇合成途径和实现终产物紫杉醇的微生物生物合成具有重要意义.Jennewein等[7]从红豆杉的cDNA文库中克隆的一个紫杉烯5α-羟基化酶(Cytochrome P450 taxadiene5α-hydroxylase),在酿酒酵母中进行了重组表达,能够有效地催化taxa-4(5),11(12)-diene和taxa-4(20),11(12)-diene生成taxa-4(20),11(12)-dien-5α-ol.Kaspera等[8]发现了6种新的紫杉烯的CYP450单加氧酶,这6种酶的基因序列具有高度同源性(>70%),和其他植物的同源性却很低.尽管这些酶具有如此高的同源性,酶功能分析显示在生物合成途径的早期,就具有显著的底物特异性.DeJong等[9]分别克隆了紫杉烯生物合成途径中的GGPP合酶,紫杉烯合酶,以及紫杉烯5α、10β、13α-羟化酶(Cytochrome P450 taxoid 5α,10β,13α-hydroxylases),紫杉烯-5α-ol-O-乙酰基转移酶,紫杉烯10β-羟化酶的8个基因,并将这8个基因在酿酒酵母中分别进行了重组表达.他们将3个基团转移酶基因同时导入酵母,并在酵母中检测到了微量的(25 μg/L)紫杉烯的一种下游氧化产物taxadien-5α-ol,说明在酵母中导入多个基因合成紫杉烯的下游产物甚至是紫杉醇从技术上是完全可行的.
从GGPP形成紫杉醇只有约19步酶催化反应,而紫杉醇类似物却有好几百种.Kaspera等[8]证明除了以紫杉烯为中间产物的主干合成途径,一定存在其他旁路,形成紫杉碱、taxinines、taxayunnanines以及其他最终代谢产物.因此这些紫杉烷单加氧酶和基团转移酶的底物选择性,在紫杉醇的合成转化中起着最关键的作用.Croteau[10]认为由于对紫杉醇合成酶基因进行功能鉴定的过程中使用的底物一般都是替代底物,而生物合成途径中真正的底物是什么却不十分清楚,反应步骤的先后顺序也不是很明确,这给紫杉醇生物合成的研究带来了难度,也是后续研究需要突破的问题.
1.3 内生真菌生物合成紫杉醇
某些植物中分离出来的内生真菌具有与宿主植物产生相同天然产物的能力.Stierle等[11]从太平洋红豆杉树皮中分离出一个内生真菌,命名为Taxomycesandreanae,它具有稳定产生紫杉醇的能力,产量约为24~50 ng/L.随后很多实验室相继分离出一系列产紫杉醇的内生真菌.不过目前分离出的内生真菌紫杉醇产量都不高,还达不到工业化的要求.但是真菌的遗传操作比植物更简单,筛选高产紫杉醇的内生真菌,通过克隆内生真菌中紫杉醇合成途径相关基因,建立内生真菌的遗传转化系统,并将紫杉醇合成途径关键酶基因构建到真菌表达载体上,利用基因工程手段提高内生真菌中紫杉醇含量,是目前解决药源问题的有效途径之一.
通过上述描述我们知道微生物生物合成紫杉醇的研究目前主要集中在紫杉烯的产量提高上,这也是最接近工业化生产的研究前沿.虽然工程菌直接生物合成紫杉醇目前还不可行,但是合成中间产物紫杉烯的产量已经达到工业标准.紫杉烯经过化学转化后可以制得多种紫杉醇衍生物,具有不亚于紫杉醇的抗癌效果,同时能够克服病灶对紫杉醇的耐药性.
2 青蒿素
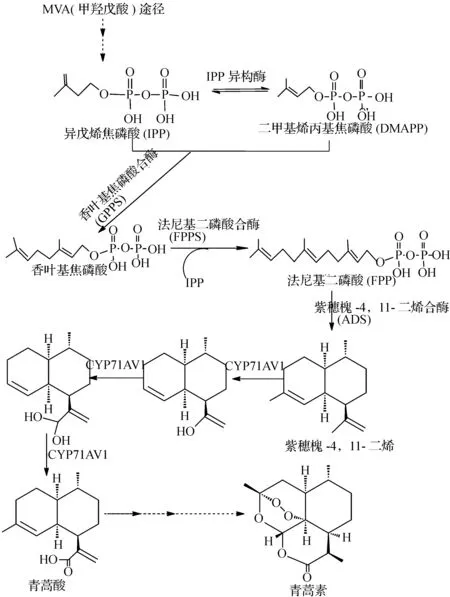
图2 青蒿素的半生物合成路线Fig2 The semi-biosynthetic pathway of artemisinin
青蒿素是我国科学工作者20世纪70年代初首次从黄花蒿中分离并鉴定出的抗疟有效单体,具有高效低毒的抗疟特性,被世界卫生组织称为目前世界上唯一有效的疟疾治疗药物.青蒿素目前主要从黄花蒿叶片、花蕾中提取,是一种环氧化的倍半萜内酯,其现有的半生物合成路线如图2所示.它的生成由乙酰CoA经甲羟戊酸(mevalonic acid, MVA)途径合成FPP,经紫穗槐-4,11-二烯合酶(ADS)催化生成紫穗槐-4,11-二烯,在紫穗槐-4,11-二烯P450羟基化酶(CYP71AV1)催化下生成青蒿酸,再经过其他催化反应最后生成青蒿素.其中紫穗槐-4,11-二烯和青蒿酸是关键性前体(中间体).
虽然目前用工程菌生产青蒿素前体取得了重大的进展,但还只能生产前体紫穗槐二烯和青蒿酸.因为青蒿酸到青蒿素的酶催化步骤及其相关酶还未完全阐明,至今还没有实现用微生物直接合成青蒿,但化学转化青蒿酸到青蒿素仅需要2步简单的反应,已具备工业生产可行性.因此实现青蒿素的生物合成实际上仅需要实现青蒿酸的生物合成.
2.1 大肠杆菌生产紫穗槐二烯
法尼基焦磷酸(Farnesyl pyrophosphate,FPP)是在大肠杆菌细胞内广泛存在的合成辅酶Q和细胞壁必不可少的物质;同时它又是青蒿素合成的基本单体之一,这为利用大肠杆菌生产青蒿素提供了必需的物质基础.紫穗槐二烯合成酶催化FPP合成紫穗槐二烯(Amorpha-4,11-diene),是青蒿素合成的重要中间体.Martin等[12-13]将来自黄花蒿的紫穗槐二烯合成酶基因(ADS)导入大肠杆菌,检测到了微量目的产物紫穗槐-4,11-二烯;将大肠杆菌中再导入甲羟戊酸(MVA)途径合成酶,目的产物产量达到24 mg/L.虽然产量较低,但这是首次成功利用工程菌生物合成重要天然药物,意味着有可能应用微生物更加有效地大量生产其他市售的天然产物类昂贵药物.Newman等[14]利用Martin构建的大肠杆菌紫穗槐-4,11-二烯工程菌,使用分区生物反应器培养大肠杆菌,通过两相培养法提取挥发性萜类化合物.获得了产量高达0.5 g/L的紫穗槐-4,11-二烯,说明通过对工程菌相关发酵条件进行优化,是完全有可能将目的产物的产量提高到工业化水平.萜类合成的产量除了与前体供应量和发酵条件有关系外,还与合成途径中各部分代谢能力的平衡有重要的关系.导入的MVA途径中的3-羟基-3-甲基戊二酰辅酶A合成酶(HMGS)和3-羟基-3-甲基戊二酰辅酶A还原酶(HMGR)的代谢活性是上述合成途径中的限速环节,因此Tsuruta[15]在前者研究基础上,从金黄色葡萄球菌中克隆HMGS和HMGR基因,导入大肠杆菌中,取代了前者研究中使用的来自于酿酒酵母的相应酶.这两个酶能够很好地与已有合成途径的其他催化酶协同作用,实现高通量的代谢流的平衡.接下来通过发酵培养条件中碳和氮的浓度优化,产生的紫穗槐-4,11-二烯的浓度高达27.4 g/L.这是已报道的青蒿素前体的最高产量,也是微生物合成萜类化合物的已知最高产量.如此之高的产量使得生物合成青蒿素呈现很好的产业化前景,同时也充分证明了大肠杆菌在合成萜类化合物上具有巨大的潜力,完全具备工业化生产的能力.
从青蒿素的前体紫穗槐-4,11-二烯,还需要P450酶的几步氧化反应才能生成青蒿素.Teoh等[16]从黄花蒿腺毛的cDNA文库中分离得到一个P450氧化酶基因CYP71AV1.实验证明,CYP71AV1是一个多功能的酶,可以氧化紫穗槐-4,11-二烯生成青蒿醛,再转化为青蒿酸.但是在大肠杆菌中表达植物来源的P450酶一直是公认的难题之一.相对于植物来源的P450酶难于原核活性表达和需要NADPH的FMN/FAD还原酶配合使用,巨大芽孢杆菌的P450BM3酶因其本身即为氧化酶和还原酶的融合蛋白,且易于原核活性表达,而具有独特的优势.Dietrich等[17]将巨大芽孢杆菌的P450BM3突变体在产物紫穗槐二烯的大肠杆菌表达,在胞内将产物紫穗槐二烯选择性氧化,得到了250mg/L的arteminsinic-11s,12-epoxide.该产物可通过简单的化学反应合成二氢青蒿酸,最后合成青蒿素.该方法路线不仅比之前使用CYP71AV1所得到的氧化产物青蒿酸合成青蒿素路线的产量更高,P450BM3合成途径的培养时间减少2~7 d,而且不需要将副产物末端烯烃分离出来.
2.2 酿酒酵母工程菌生产青蒿素
酿酒酵母自身存在MVA途径,能够生产大量的胞内IPP和FPP用于自身甾醇的合成,酿酒酵母遗传操作技术已经非常成熟,而且在酿酒酵母中不存在对于大部分萜类化合物对大肠杆菌的毒害作用,因此酿酒酵母是萜类合成的适宜宿主菌.Ro等[18]以酿酒酵母为宿主菌,导入克隆的ADS基因,然后通过外源重组载体导入MVA途径相关酶基因,增加酶的拷贝数从而增加了酶的表达量,增加IPP和FPP的供应量,产物紫穗槐-4,11-二烯产量达到了153 mg/L;在导入CYP71AV1基因,诱导表达得到115 mg/L的青蒿酸,再通过更简单的化学反应转化为青蒿素.
目前,大肠杆菌合成紫穗槐二烯的产量已经达到27.4 g/L发酵液,而酿酒酵母合成青蒿酸的产量也达到115 mg/L发酵液的水平.两个前体都可以通过化学转化获得终产物青蒿素.两者的研究成果表明青蒿素的半生物合成技术路线已经基本满足了大规模的工业生产需要,有理由相信生物合成的青蒿素产品将最终取代天然提取的青蒿素产品,成为市场的主流.
3 其他萜类化合物的微生物生物合成
微生物生物合成萜类化合物在其他萜类化合物中的研究也受到了学者的广泛关注.Yoon等[19]将构建的pT-DHB重组子和pSSN12Didi一起导入大肠杆菌,使β-胡萝卜素的产量提高到49.3 mg/g细胞干重,把微生物合成类胡萝卜素的产量提高到一个新的水平.Albermann[20]crtI重组质粒的过表达,crtE和crtB单拷贝表达,显著提高了四脱氢番茄红素产量,高达253 μg/g细胞干重.Miao等[21]构建了一个名为MK19的突变体红法夫酵母,优化培养条件后,得到最高25.8 mg/L的虾青素的产量.Leonard E等[22]通过外源基因导入及对下游途径中的限制步骤进行改造,构建的GGPP合酶和LPS的重组突变体合成左旋海松二烯产量大约提高了2 600倍,最大产量约700 mg/L.
4 结 语
萜类化合物作为一大类具有各种生物活性的天然产物,在医药、食品工业具有重要应用价值.大部分萜类物质的天然提取方式都存在含量低、难分离的问题,同时自然资源匮乏的现实也促使科学家寻找新的生产方式.大肠杆菌、链霉菌等工程菌合成抗生素、氨基酸等天然产物的研究给微生物合成萜类物质提供了借鉴.大肠杆菌体系具有遗传背景清晰、遗传操作体系成熟、发酵周期短、生产成本低、产量高等优点,非常适合作为萜类合成的宿主系统.而事实也证明,对于不含氧原子的萜烯类的生物合成,大肠杆菌系统是最佳选择.但是大肠杆菌系统很难功能性表达植物来源的P450酶等萜类合成后期修饰酶,因此对于结构复杂的含氧萜类来说,合成的产物基本为萜类上游中间体,例如青蒿素和紫杉醇合成.相对于大肠杆菌来说,酿酒酵母不仅能够合成萜类上游中间体,其完整的内外膜结构还能够很好地活性表达植物来源的P450氧化酶,在胞内对上游中间体进行氧化反应,得到结构上更接近于终产物的下游中间体,为其化学转化为相关活性衍生物和终产物提供便利.尽管目前大肠杆菌仍然是用来合成萜类的最多选择,而且大肠杆菌的生长量和生物转化量要明显超过酿酒酵母;但是随着许多萜类的合成途径中P450酶催化反应机理的逐步阐明,酿酒酵母将会是含氧原子的萜醇类合成的最佳选择.除了上述两种微生物外,链霉菌、芽孢杆菌、假单胞菌、毕赤酵母在合成萜类天然产物方面均有过报道,虽然具有各自相应的优点,但是由于遗传背景不清、操作技术落后、产量低等缺点,距离实际工业生产还是有相当远的距离.
微生物合成萜类是生物合成研究的新领域,它是分子生物学、代谢工程、系统生物学和微生物学融合交叉后产生的新学科——合成生物学的代表性研究内容,也是合成生物学最接近生产实践的前沿研究.合成生物学的最终目的是实现工业化生产,而微生物合成萜类必将成为其工业化生产的成功典范,为人类的健康事业贡献力量.
[1] Ajikumar P K, Tyo K, Carlsen S,etal. Terpenoids: opportunities for biosynthesis of natural productdrugs using engineered microorganisms [J]. Molecular Pharmaceutics,2008,5(2):167-190.
[2] Kirby J, Keasling J D. Biosynthesis of plant isoprenoids: perspectives for microbial engineering [J]. Annual Review of Plant Biology,2009,60:335-355.
[3] Willot M, Christmann M. Total synthesis: towards artificial terpene cyclases [J]. Nature Chemistry,2010,2(7):519-520.
[4] Huang Q, Roessner C A, Croteau R,etal. EngineeringEscherichiacolifor the synthesis of taxadiene, a key intermediate in the biosynthesis of taxol [J]. Bioorganic & Medicinal Chemistry,2001,9(9):2237-2242.
[5] Ajikumar P K, Xiao W H, Tyo K E J,etal. Isoprenoid pathway optimization for taxol precursor overproduction inEscherichiacoli[J]. Science,2010,330(6000):70-74.
[6] Engels B, Dahm P, Jennewein S. Metabolic engineering of taxadiene biosynthesis in yeast as a first step towards Taxol (Paclitaxel) production [J]. Metabolic Engineering,2008,10(3/4):201-206.
[7] Jennewein S, Long R M, Williams R M,etal. Cytochrome P450 taxadiene 5α-hydroxylase, a mechanistically unusual monooxygenase catalyzing the first oxygenation step of taxol biosynthesis [J]. Chemistry & Biology,2004,11(3):379-387.
[8] Kaspera R, Croteau R. Cytochrome P450 oxygenases of taxol biosynthesis [J]. Phytochemistry Reviews,2006,5(2):433-444.
[9] DeJong J H M, Liu Y, Bollon A P,etal. Genetic engineering of taxol biosynthetic genes inSaccharomycescerevisiae[J]. Biotechnology and Bioengineering,2006,93(2):212-224.
[10] Croteau R, Ketchum R E B, Long R M,etal. Taxol biosynthesis and molecular genetics [J]. Phytochemistry Reviews,2006,5(1):75-97.
[11] Stierle A, Strobel G, Stierle D. Taxol and taxane production by Taxomyces andreanae, an endophytic fungus of Pacific yew [J]. Science,1993,260(5105):214-216.
[12] Martin V J J, Yoshikuni Y, Keasling J D. The in vivo synthesis of plant sesquiterpenes byEscherichiacoli[J]. Biotechnology and Bioengineering,2001,75(5):497-503.
[13] Martin V J J, Pitera D J, Withers S T,etal. Engineering a mevalonate pathway inEscherichiacolifor production of terpenoids [J]. Nature Biotechnology,2003,21(7):796-802.
[14] Newman J D, Marshall J, Chang M,etal. High-level production of amorpha-4, 11-diene in a two-phase partitioning bioreactor of metabolically engineeredEscherichiacoli[J]. Biotechnology and Bioengineering,2006,95(4):684-691.
[15] Tsuruta H, Paddon C J, Eng D,etal. High-level production of amorpha-4, 11-diene, a precursor of the antimalarial agent artemisinin, inEscherichiacoli[J]. PloS One,2009,4(2):e4489.
[16] Teoh K H, Polichuk D R, Reed D W,etal.ArtemisiaannuaL. (Asteraceae) trichome-specific cDNAs revealCYP71AV1, a cytochrome P450 with a key role in the biosynthesisof the antimalarial sesquiterpene lactone artemisinin [J]. FEBS Letters,2006,580(5):1411-1416.
[17] Dietrich J A, Yoshikuni Y, Fisher K J,etal. A novel semi-biosynthetic route for artemisinin production using engineered substrate-promiscuous P450BM3 [J]. ACS Chemical Biology,2009,4(4):261-267.
[18] Ro D K, Paradise E M, Ouellet M,etal. Production of the antimalarial drug precursor artemisinic acid in engineered yeast [J]. Nature,2006,440(7086):940-943.
[19] Yoon S H, Park H M, Kim J E,etal. Increased β-carotene production in recombinantEscherichiacoliharboring an engineered isoprenoid precursor pathway with mevalonate addition [J]. Biotechnology Progress,2007,23(3):599-605.
[20] Albermann C. High versus low level expression of the lycopene biosynthesis genes from Pantoea ananatis inEscherichiacoli[J]. Biotechnology Letters,2011,33(2):313-319.
[21] Miao Lili, Wang Yongxing, Chi Shuang,etal. Reduction of fatty acid flux results in enhancement of astaxanthin synthesis in a mutant strain of Phaffia rhodozyma [J]. Journal of Industrial Microbiology & Biotechnology,2010,37(6):595-602.
[22] Leonard E, Ajikumar P K, Thayer K,etal. Combining metabolic and protein engineering of a terpenoid biosynthetic pathway for overproduction and selectivity control [J]. Proceedings of the National Academy of Sciences,2010,107(31):13654-13659.
AdvanceinTerpenoidMicrobialBiosynthesis
GAO Yun-yun, WANG Qiu-yan, HUANG Li-feng, LI Hai-feng
(Center for Biomedicine and Health,Hangzhou Normal University, Hangzhou 311121, China)
Terpenoid is a class of natural compounds with research and medicinal value. In recent years, the researches on terpenoid microbial biosynthesis have made great progress. Using the intermediates in the biosynthesis as clues, this paper summarized the research advance of terpenoid microbial biosynthesis by using the technology of metabolic engineering, synthetic biology and systematic biology.
terpenoids; microorganism; biosynthesis
2012-02-15
李海峰(1980—),男,助理研究员,博士,主要从事微生物生物合成天然药物研究.E-mail:lihaifengwater@163.com
11.3969/j.issn.1674-232X.2012.04.017
Q812
A
1674-232X(2012)04-0374-06
